
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ

- Комплексное соединение - сложное соединение, образующееся при взаимодействии более простых структурных частиц (атомов, ионов или молекул), каждая из которых способна существовать независимо в обычных условиях.
![[Cu(NH 3 ) 4 ]SO 4 CuSO 4 NH 3 Na [ Al(OH) 4 ] N aOH Al(OH) 3](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img2.jpg)
[Cu(NH 3 ) 4 ]SO 4
CuSO 4
NH 3
Na [ Al(OH) 4 ]
N aOH
Al(OH) 3

Комплексными соединениями , или просто комплексами, называют соединения, имеющие в своем составе комплексные ионы.
![Комплекс означает центральный атом или ион металла, окруженный набором лигандов. [ Co ( NH 3 ) 6 ] 3+ - комплекс [ Co ( NH 3 ) 6 ] Cl 3 – комплексное соединение (соль) . [Fe ( CO ) 5 ] – комплекс и комплексное соединение](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img4.jpg)
Комплекс означает центральный атом или ион металла, окруженный набором лигандов.
[ Co ( NH 3 ) 6 ] 3+ - комплекс
[ Co ( NH 3 ) 6 ] Cl 3 – комплексное соединение (соль) .
[Fe ( CO ) 5 ] – комплекс и комплексное соединение
![Основные положения координационной теории 1 Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями. Катионы: металлов (d- элементов ) : С u +2 , Co +3 , Fe +3 , Hg +2 и др. (реже р-элементы): Al +3 ( иногда неметаллы):В +3 , Si +4 . + +3 K 3 [ Fe(CN) 6 ]](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img5.jpg)
Основные положения координационной теории
1
Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями.
Катионы:
- металлов (d- элементов ) :
С u +2 , Co +3 , Fe +3 , Hg +2 и др.
- (реже р-элементы): Al +3
- ( иногда неметаллы):В +3 , Si +4 .
+
+3
K 3 [ Fe(CN) 6 ]

Основные положения координационной теории
2 .
Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами.
Молекулы:
H 2 O, NH 3 ,
Анионы:
CN - , OH - , Cl - , Br - , NO 2 -
..
..
..
![Основные положения координационной теории 3. Координационное число – количество лигандов, которые может присоединять комплексообразователь . Координационное число – обычно в 2 раза больше, чем С.О. центрального иона. +1 (2) +2 ( 4 , 6) +3 ( 6 , 4) +4 ( 8 , 6) +2 [Cu(NH 3 ) 4 ] +2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img7.jpg)
Основные положения координационной теории
3.
Координационное число – количество лигандов, которые может присоединять комплексообразователь .
Координационное число – обычно в 2 раза больше, чем С.О. центрального иона.
+1 (2)
+2 ( 4 , 6)
+3 ( 6 , 4)
+4 ( 8 , 6)
+2
[Cu(NH 3 ) 4 ] +2
![Основные положения координационной теории 4. Комплексообразователь и лиганды составляют внутреннюю сферу комплекса. [Cu(NH 3 ) 4 ] +2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img8.jpg)
Основные положения координационной теории
4.
Комплексообразователь и лиганды составляют внутреннюю сферу комплекса.
[Cu(NH 3 ) 4 ] +2
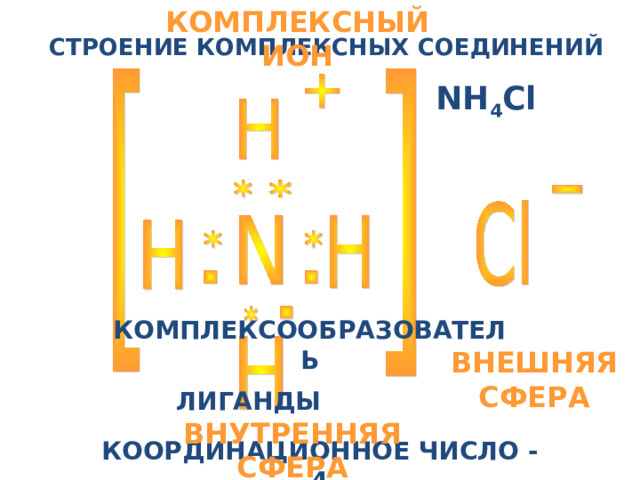
КОМПЛЕКСНЫЙ ИОН
СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
NH 4 Cl
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ВНЕШНЯЯ СФЕРА
ЛИГАНДЫ
ВНУТРЕННЯЯ СФЕРА
КООРДИНАЦИОННОЕ ЧИСЛО - 4
![[N -3 H +1 4 ]Cl -1 ВНУТРЕННЯЯ СФЕРА : [NH 4 ] + КОМПЛЕКСНЫЙ ИОН N -3 КОМПЛЕКСООБРАЗОВАТЕЛЬ H + ЛИГАНДЫ Cl - ВНЕШНЯЯ СФЕРА АНИОН](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img10.jpg)
[N -3 H +1 4 ]Cl -1
ВНУТРЕННЯЯ СФЕРА :
[NH 4 ] +
КОМПЛЕКСНЫЙ ИОН
N -3
КОМПЛЕКСООБРАЗОВАТЕЛЬ
H +
ЛИГАНДЫ
Cl -
ВНЕШНЯЯ СФЕРА
АНИОН
![Строение комплексного соединения Внешняя сфера Внутренняя сфера K 3 [Fe(CN) 6 ] Координационное число Ион-комплексообразователь (центральный атом) Лиганды](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img11.jpg)
Строение комплексного соединения
Внешняя
сфера
Внутренняя сфера
K 3 [Fe(CN) 6 ]
Координационное
число
Ион-комплексообразователь
(центральный атом)
Лиганды
![Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от комплекса. Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом. Координационное число (КЧ) – число донорных атомов, которые связаны с центральным атомом. [Fe ( CO ) 5 ] [ Co ( NH 3 ) 6 ] 3+](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img12.jpg)
Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от комплекса.
Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом.
Координационное число (КЧ) – число донорных атомов, которые связаны с центральным атомом.
[Fe ( CO ) 5 ]
[ Co ( NH 3 ) 6 ] 3+
![Примеры лигандов Анионы бескислородных кислот F - , Cl - , Br - , I - (фторо-лиганд и т.д.) Пример: K 2 [HgI 4 ] – тетра иод о меркур ат (II) калия Донорный атом O Остатки кислородсодержащих кислот CH 3 COO - - ацетато-лиганд CO 3 2- - карбонато-лиганд C 2 O 4 2- - оксалато-лиганд SO 4 2- - сульфато-лиганд Пример: K 3 [ Fe ( C 2 O 4 ) 3 ] – три оксалат о ферр ат ( III ) калия Не «железат» , «ртутат» и т.д. Элементы с исконно русскими названиями: медь, золото, серебро, углерод, кислород, азот, водород и т.д.](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img13.jpg)
Примеры лигандов
Анионы бескислородных кислот
F - , Cl - , Br - , I - (фторо-лиганд и т.д.)
Пример: K 2 [HgI 4 ] – тетра иод о меркур ат (II) калия
Донорный атом O
Остатки кислородсодержащих кислот
CH 3 COO - - ацетато-лиганд
CO 3 2- - карбонато-лиганд
C 2 O 4 2- - оксалато-лиганд
SO 4 2- - сульфато-лиганд
Пример: K 3 [ Fe ( C 2 O 4 ) 3 ] –
три оксалат о ферр ат ( III ) калия
Не «железат» , «ртутат» и т.д. Элементы с исконно русскими названиями: медь, золото, серебро, углерод, кислород, азот, водород и т.д.
![Донорный атом O OH - - гидроксо-лиганд O 2- - оксо-лиганд O 2 2- - пероксо-лиганд K 2 [ Zn ( OH ) 4 ] – тетра гидрокс о цинкат( II ) калия Электоронейтральные молекулы с донорными атомами O : H 2 O – аква-лиганд [ Fe ( H 2 O ) 6 ] (ClO 4 ) 3 – перхлорат гекса акважелеза( III )](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img14.jpg)
Донорный атом O
OH - - гидроксо-лиганд
O 2- - оксо-лиганд
O 2 2- - пероксо-лиганд
K 2 [ Zn ( OH ) 4 ] – тетра гидрокс о цинкат( II ) калия
Электоронейтральные молекулы с донорными атомами O : H 2 O – аква-лиганд
[ Fe ( H 2 O ) 6 ] (ClO 4 ) 3 – перхлорат гекса акважелеза( III )
![(OH) - 4 [Zn +x Na + ] 2 (+1) + x + (-1) ·2 ·4 = 0 x = 0-2+4 x = +2 Na 2 + [Zn +2 (OH) - 4 ]](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img15.jpg)
(OH) -
4
[Zn +x
Na +
]
2
(+1)
+ x
+ (-1)
·2
·4 = 0
x = 0-2+4
x = +2
Na 2 + [Zn +2 (OH) - 4 ]
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3 [AlF 6 ] Ответ: Na + 3 [Al +3 F - 6 ] K[MgCl 3 ] Ответ: K + [Mg +2 Cl - 3 ] Na[Al(OH) 4 ] Ответ: Na + [Al +3 (OH) - 4 ] Na 4 [Fe(CN) 6 ] Ответ: Na + 4 [Fe +2 (CN) - 6 ] Na 3 [Al(OH) 6 ] Ответ: Na + 3 [Al +3 (OH) - 6 ] [Cu(NH 3 ) 4 ]Cl 2 Ответ: [Cu +2 (NH 3 ) 0 4 ]Cl - 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img16.jpg)
РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na 3 [AlF 6 ]
Ответ: Na + 3 [Al +3 F - 6 ]
K[MgCl 3 ]
Ответ: K + [Mg +2 Cl - 3 ]
Na[Al(OH) 4 ]
Ответ: Na + [Al +3 (OH) - 4 ]
Na 4 [Fe(CN) 6 ]
Ответ: Na + 4 [Fe +2 (CN) - 6 ]
Na 3 [Al(OH) 6 ]
Ответ: Na + 3 [Al +3 (OH) - 6 ]
[Cu(NH 3 ) 4 ]Cl 2
Ответ: [Cu +2 (NH 3 ) 0 4 ]Cl - 2

Строение комплексных соединений
- Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило, незавершенный d - уровень .
- Образование комплексного иона можно объяснить наличием у катионов d -металлов вакантных орбиталей на s -, p -, d - и f - подуровнях, которые принимают участие в донорно-акцепторном механизме образования связей в комплексных соединениях.
Co 0
4 s
3 d
4 р
Co 3+
4 s
4 р
3 d

Строение комплексных соединений
- Для образования прочных связей внутри комплексного соединения энергетически выгодно освободить две d -орбитали спариванием электронов :
Co 3+
4 s
4 р
3 d
- Свободные орбитали атомов кобальта, в свою очередь, являются вакансиями для неподелённой электронной пары азота в молекуле аммиака. Так происходит образование внутренней координационной сферы комплексного соединения:
Co 3+
..
..
..
..
..
..
NH 3
NH 3
NH 3
NH 3
NH 3
NH 3
Классификация комплексных соединений
по заряду комплекса
по виду лигандов
по составу внешней сферы
![Классификация По заряду комплекса Катионные Нейтральные [Cr(H 2 O) 4 ] 3+ Cl 3 [PtCl 4 (NH 3 ) 2 ] Катионно - анионные Анионные K 2 [PtCl 6 ] 2- [Cu(NH 3 ) 4 ] 2+ [PtCl 4 ] 2-](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img20.jpg)
Классификация По заряду комплекса
Катионные
Нейтральные
[Cr(H 2 O) 4 ] 3+ Cl 3
[PtCl 4 (NH 3 ) 2 ]
Катионно - анионные
Анионные
K 2 [PtCl 6 ] 2-
[Cu(NH 3 ) 4 ] 2+ [PtCl 4 ] 2-
![Классификация По составу внешней сферы Кислоты Соли H 2 [PtCl 6 ] Na 3 [AlF 6 ] Основания Неэлектролиты [Pt(NH 3 ) 2 Cl 2 ] [Ag(NH 3 ) 2 ] OH](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img21.jpg)
Классификация По составу внешней сферы
Кислоты
Соли
H 2 [PtCl 6 ]
Na 3 [AlF 6 ]
Основания
Неэлектролиты
[Pt(NH 3 ) 2 Cl 2 ]
[Ag(NH 3 ) 2 ] OH
![Классификация По виду лигандов Аква комплексные Ацидо комплексные [Fe( H 2 O ) 6 ]SO 4 K[Au( CN ) 4 ] Смешанные Амино комплексные [Zn( NH 3 ) 4 ]Cl 2 [CoCl( NH 3 ) 3 ( H 2 O ) 2 ]( NO 3 ) 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img22.jpg)
Классификация По виду лигандов
Аква комплексные
Ацидо комплексные
[Fe( H 2 O ) 6 ]SO 4
K[Au( CN ) 4 ]
Смешанные
Амино комплексные
[Zn( NH 3 ) 4 ]Cl 2
[CoCl( NH 3 ) 3 ( H 2 O ) 2 ]( NO 3 ) 2

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
ди -
2-
H 2 O - аква
3-
три -
NH 3 - амин
4-
тетра -
С O - карбонил
5-
пента -
O Н - - гидроксо-
гекса -
6-
(С N) - - циано
( NO 3 ) - - нитро
F - , Cl - , Br - , I - - фторо-, хлоро-, бромо-, йодо-

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ АНИОНОВ:
Fe - феррат
От латинского названия комплексообразователя с добавлением суффикса
-ат
Cu - купрат
Ag - аргентат
Au - аурат
Hg - меркурат
Zn - цинкат
Al - алюминат
![НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na + 2 4 ] (OH) - [Zn +2 цинкат натрия гидроксо тетра 6 ] Cl - 3 (H 2 O) 0 [Cr +3 хлорид аква гекса x рома (III) K + 2 [Hg +2 4 ] I - тетра йодо меркурат (II) калия](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img25.jpg)
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na + 2
4 ]
(OH) -
[Zn +2
цинкат
натрия
гидроксо
тетра
6 ]
Cl - 3
(H 2 O) 0
[Cr +3
хлорид
аква
гекса
x рома (III)
K + 2
[Hg +2
4 ]
I -
тетра
йодо
меркурат (II)
калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3 [AlF 6 ] Гексафтороалюминат натрия Na[Al(OH) 4 ] Тетрагидроксоалюминат натрия K 4 [Fe(CN) 6 ] Гексационоферрат (II) калия](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img26.jpg)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na 3 [AlF 6 ]
Гексафтороалюминат натрия
Na[Al(OH) 4 ]
Тетрагидроксоалюминат натрия
K 4 [Fe(CN) 6 ]
Гексационоферрат (II) калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3 ) 4 ]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3 ) 2 ]Cl Хлорид диамминсеребра [Cr(H 2 O) 6 ]Cl 3 Хлорид гексааквахрома (III)](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img27.jpg)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH 3 ) 4 ]SO 4
Сульфат тетраамминмеди (II)
[Ag(NH 3 ) 2 ]Cl
Хлорид диамминсеребра
[Cr(H 2 O) 6 ]Cl 3
Хлорид гексааквахрома (III)
![СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2 [PtCl 6 ] Нитрат хлоронитротетраамминкобальта (III) Ответ: [Co(NH 3 ) 4 (NO 3 )Cl]NO 3 Гексагидроксохромат (III) натрия Ответ: Na 3 [Cr(OH) 6 ] Нитрат гексаамминникеля (II) Ответ: [Ni(NH 3 ) 6 ](NO 3 ) 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img28.jpg)
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Гексахлороплатинат (IV) калия
Ответ: K 2 [PtCl 6 ]
Нитрат хлоронитротетраамминкобальта (III)
Ответ: [Co(NH 3 ) 4 (NO 3 )Cl]NO 3
Гексагидроксохромат (III) натрия
Ответ: Na 3 [Cr(OH) 6 ]
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH 3 ) 6 ](NO 3 ) 2
![ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Лабораторный опыт. Получение тетрагидроксоалюмината натрия AlCl 3 +3NaOH = Al(OH) 3 ↓+3NaCl Al(OH) 3 + NaOH = Na[Al(OH) 4 ] Лабораторный опыт. Получение гидроксида тетраамминмеди (II) CuCl 2 +2NH 3 +2H 2 O = Cu(OH) 2 ↓+NH 4 Cl Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img29.jpg)
ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Лабораторный опыт.
Получение тетрагидроксоалюмината натрия
AlCl 3 +3NaOH = Al(OH) 3 ↓+3NaCl
Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
Лабораторный опыт.
Получение гидроксида тетраамминмеди (II)
CuCl 2 +2NH 3 +2H 2 O = Cu(OH) 2 ↓+NH 4 Cl
Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2
![Химические свойства комплексных соединений 1. В растворе комплексные соединения ведут себя как сильные электролиты, т.е. полностью диссоциируют на катионы и анионы . [Pt(NH 3 ) 4 ]Cl 2 = [Pt(NH 3 ) 4 ] 2+ + 2Cl – , K 2 [PtCl 4 ] = 2K + + [PtCl 4 ] 2– [Cu(NH 3 ) 4 ]SO 4 ↔ [Cu(NH 3 ) 4 ] 2+ + SO 4 2-](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img30.jpg)
Химические свойства комплексных соединений
- 1. В растворе комплексные соединения ведут себя как сильные электролиты, т.е. полностью диссоциируют на катионы и анионы .
[Pt(NH 3 ) 4 ]Cl 2 = [Pt(NH 3 ) 4 ] 2+ + 2Cl – ,
K 2 [PtCl 4 ] = 2K + + [PtCl 4 ] 2–
[Cu(NH 3 ) 4 ]SO 4 ↔ [Cu(NH 3 ) 4 ] 2+ + SO 4 2-
![2. Реакции по внешней сфере FeCl 3 +K 4 [Fe(CN) 6 ]→KFe[Fe(CN) 6 ]↓+3KCl [Cu(NH 3 ) 4 ]SO 4 +BaCl 2 → → [Cu(NH 3 ) 4 ]Cl 2 +BaSO 4 ↓ ХИМИЧЕСКИЕ СВОЙСТВА](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img31.jpg)
2. Реакции по внешней сфере
FeCl 3 +K 4 [Fe(CN) 6 ]→KFe[Fe(CN) 6 ]↓+3KCl
[Cu(NH 3 ) 4 ]SO 4 +BaCl 2 →
→ [Cu(NH 3 ) 4 ]Cl 2 +BaSO 4 ↓
ХИМИЧЕСКИЕ СВОЙСТВА
![ХИМИЧЕСКИЕ СВОЙСТВА 3. Реакции с участием лигандов [Cu(NH 3 ) 4 ]SO 4 +4HCl→4NH 4 Cl+CuSO 4 4. Реакции по центральному иону Обменные: [Ag(NH 3 ) 2 ]Cl + KI → AgI↓ + KCl + 2NH 3 Окислительно-восстановительные: 2 [Ag(NH 3 ) 2 ]OH +R-C=O H → 2Ag↓+RCOONH 4 +H 2 O+3NH 3](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img32.jpg)
ХИМИЧЕСКИЕ СВОЙСТВА
3. Реакции с участием лигандов
[Cu(NH 3 ) 4 ]SO 4 +4HCl→4NH 4 Cl+CuSO 4
4. Реакции по центральному иону
Обменные:
[Ag(NH 3 ) 2 ]Cl + KI → AgI↓ + KCl + 2NH 3
Окислительно-восстановительные:
2 [Ag(NH 3 ) 2 ]OH +R-C=O
H
→ 2Ag↓+RCOONH 4 +H 2 O+3NH 3
![5. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH 3 ) 4 ]SO 4 = CuSO 4 + 4NH 3 .](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img33.jpg)
- 5. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
[Cu(NH 3 ) 4 ]SO 4 = CuSO 4 + 4NH 3 .
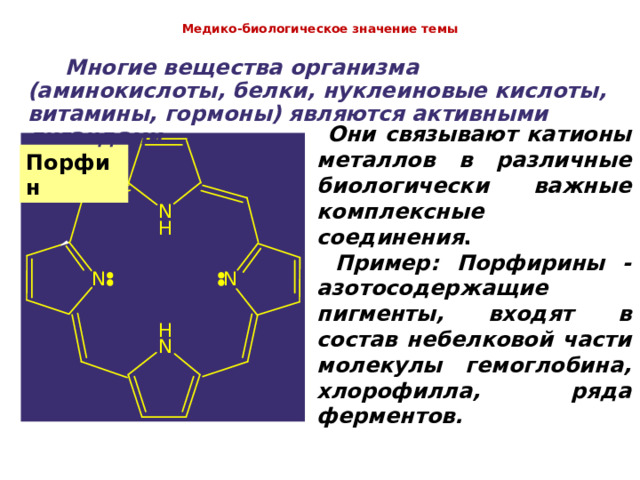
Медико-биологическое значение темы
Многие вещества организма (аминокислоты, белки, нуклеиновые кислоты, витамины, гормоны) являются активными лигандами.
Они связывают катионы металлов в различные биологически важные комплексные соединения . Пример: Порфирины - азотосодержащие пигменты, входят в состав небелковой части молекулы гемоглобина, хлорофилла, ряда ферментов.
Порфин
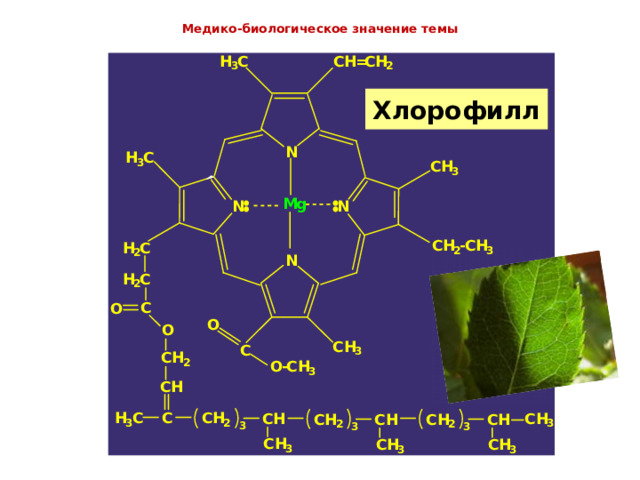
Медико-биологическое значение темы
Хлорофилл
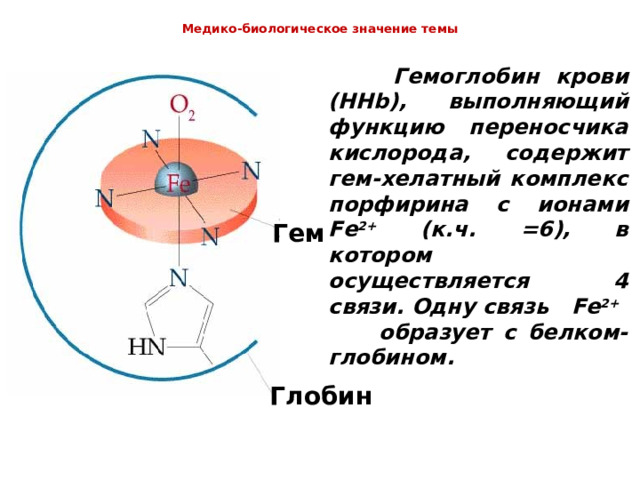
Медико-биологическое значение темы
Гемоглобин крови (HHb) , выполняющий функцию переносчика кислорода, содержит гем-хелатный комплекс порфирина с ионами Fe 2+ (к.ч. =6), в котором осуществляется 4 связи. Одну связь Fe 2+ образует с белком-глобином.
Гем
Глобин
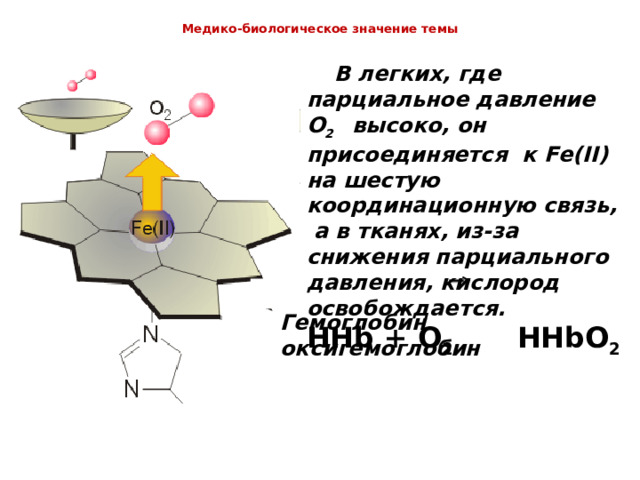
Медико-биологическое значение темы
В легких, где парциальное давление O 2 высоко, он присоединяется к Fe ( II ) на шестую координационную связь, а в тканях, из-за снижения парциального давления, кислород освобождается.
HHb + O 2 HHbO 2
Гемоглобин оксигемоглобин
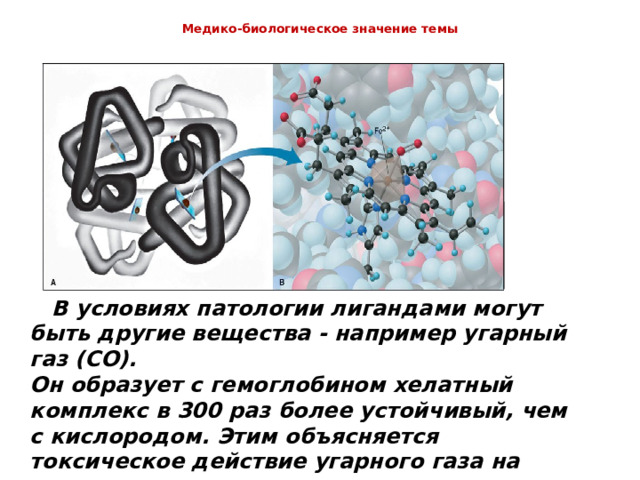
Медико-биологическое значение темы
В условиях патологии лигандами могут быть другие вещества - например угарный газ ( CO ).
Он образует с гемоглобином хелатный комплекс в 300 раз более устойчивый, чем с кислородом. Этим объясняется токсическое действие угарного газа на организм.
![Медико-биологическое значение темы B 12 - это хелат Co 3+ c порфирином B 12 (Co[C 62 H 88 N 13 O 14 P])CN](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img39.jpg)
Медико-биологическое значение темы
B 12 - это хелат Co 3+ c порфирином
B 12 (Co[C 62 H 88 N 13 O 14 P])CN
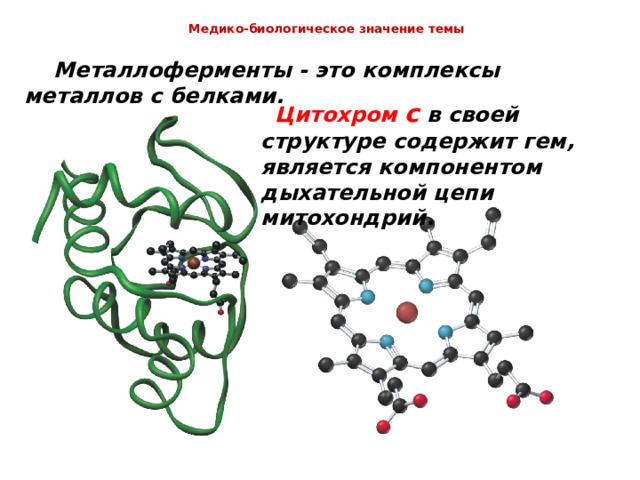
Медико-биологическое значение темы
Металлоферменты - это комплексы металлов с белками.
Цитохром с в своей структуре содержит гем, является компонентом дыхательной цепи митохондрий.

Медико-биологическое значение темы
Гормон инсулин - хелат Zn 2+ c белком.
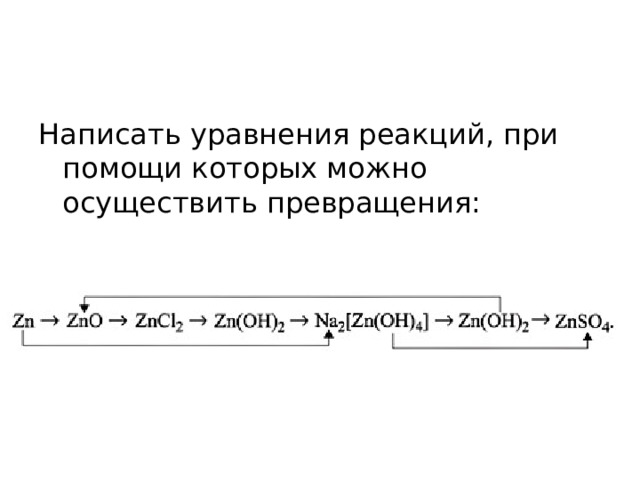
Написать уравнения реакций, при помощи которых можно осуществить превращения:

Хелаты. Комплексоны
Лиганды могут присоединяться к комплексообразователю посредством одного или нескольких атомов, т.е.
лиганды обладают координационной емкостью - дентатностью.
Монодентатные лиганды присоединяются к комплексообразователю одним атомом и образуют одну координационную связь.
Например: H 2 O, NH 3 , Cl - , CN - , OH - и др.

Хелаты. Комплексоны. Краун-эфиры
Полидентатные лиганды присоединяются к комплексообразователю посредством нескольких атомов.
Например: функциональные органические соединения.
Большое практическое значение имеют комплексоны – полидентатные лиганды, содержащие несколько функциональных групп и образующие прочные комплексы практически со всеми двухзарядными ионами металлов ( Ca 2+ , Mg 2+ , Zn 2+ , Cu 2+ , Pt 2+ …).

Хелаты. Комплексоны. Краун-эфиры
Н-р, комплексон - I :
содержит два атома азота.
За счет электронных пар этих атомов этилендиамин присоединяется к комплексообразователю двумя координационными связями.
Этилендиамин
En
![Хелаты. Комплексоны. Краун-эфиры [Pt 2+ (Е n ) 2 ] 2+ этилендиаминплатина ( II )](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img46.jpg)
Хелаты. Комплексоны. Краун-эфиры
[Pt 2+ (Е n ) 2 ] 2+
этилендиаминплатина ( II )
![Хелаты. Комплексоны. Краун-эфиры [Co 3 + (Е n ) 3 ] 3 + этилендиаминкобальт( II )](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img47.jpg)
Хелаты. Комплексоны. Краун-эфиры
[Co 3 + (Е n ) 3 ] 3 +
этилендиаминкобальт( II )

Хелаты. Комплексоны. Краун-эфиры
Для удобства координации молекулы
полидентатных лигандов сворачиваются в циклы. В
таких комплексах комплексообразователь зажат
«клешней» лигандов.
Комплексы, содержащие полидентатные лиганды, называются хелатами (от греч. chelate - клешня).
Термин «хелат»,
1920 г. Морган и Дрю
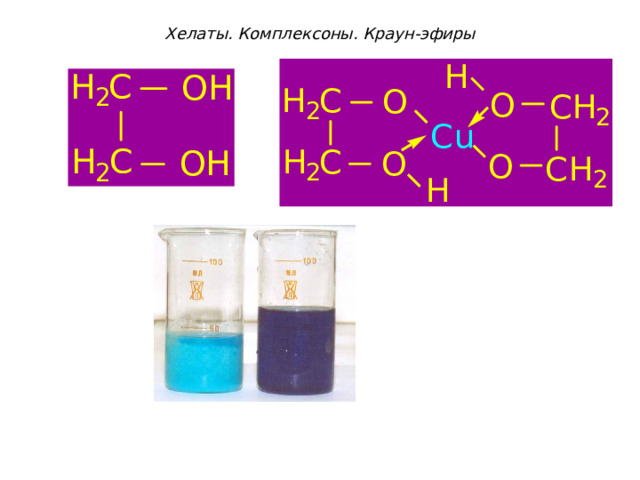
Хелаты. Комплексоны. Краун-эфиры
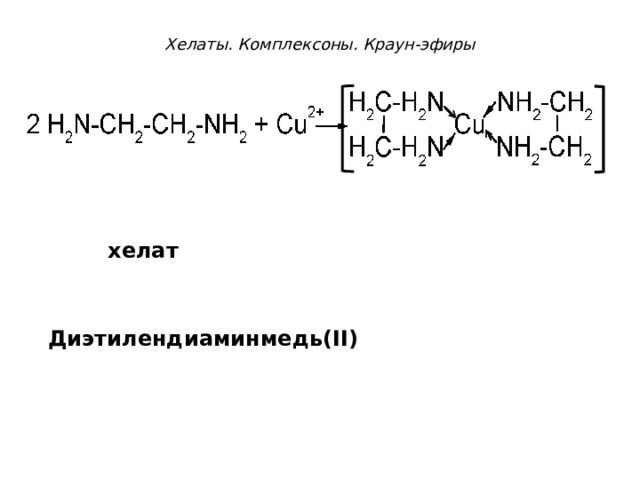
Хелаты. Комплексоны. Краун-эфиры
+2
хелат
Диэтилендиаминмедь( II)
![Хелаты. Комплексоны. Краун-эфиры Обычно хелаты гораздо устойчивее комплексных соединений, содержащих монодентатные лиганды, т.к. комплексообразователь связан с лигандами несколькими донорно-акцепторными связями. Наиболее известными комплексонами высшего порядка являются: комплексон - II этилендиаминтетрауксусная кислота (ЭДТА) комплексон- III двузамещенная натриевая соль ЭДТА - Трилон Б: Na 2 [ H 2 Tr ]](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img51.jpg)
Хелаты. Комплексоны. Краун-эфиры
Обычно хелаты гораздо устойчивее комплексных соединений, содержащих монодентатные лиганды, т.к. комплексообразователь связан с лигандами несколькими донорно-акцепторными связями.
Наиболее известными комплексонами высшего порядка являются:
- комплексон - II этилендиаминтетрауксусная кислота (ЭДТА)
- комплексон- III двузамещенная натриевая соль ЭДТА - Трилон Б: Na 2 [ H 2 Tr ]
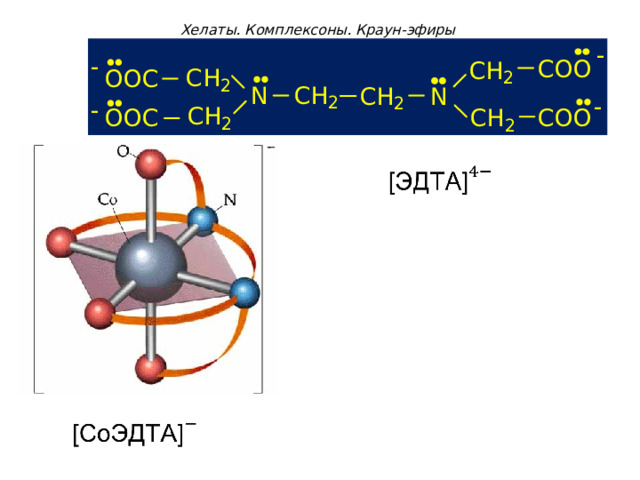
Хелаты. Комплексоны. Краун-эфиры
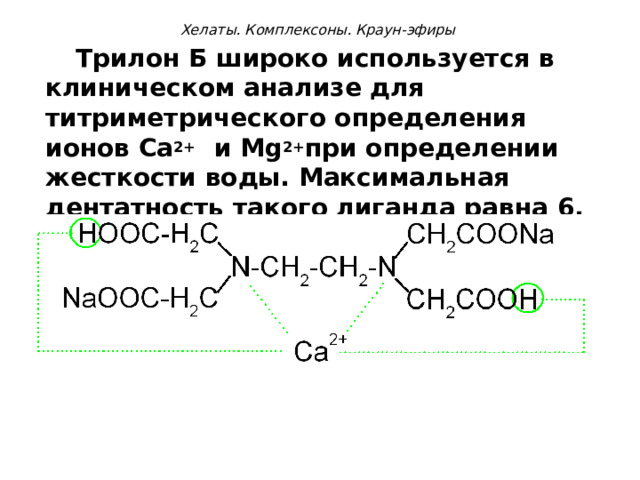
Хелаты. Комплексоны. Краун-эфиры
Трилон Б широко используется в клиническом анализе для титриметрического определения ионов Са 2+ и М g 2+ при определении жесткости воды. Максимальная дентатность такого лиганда равна 6.
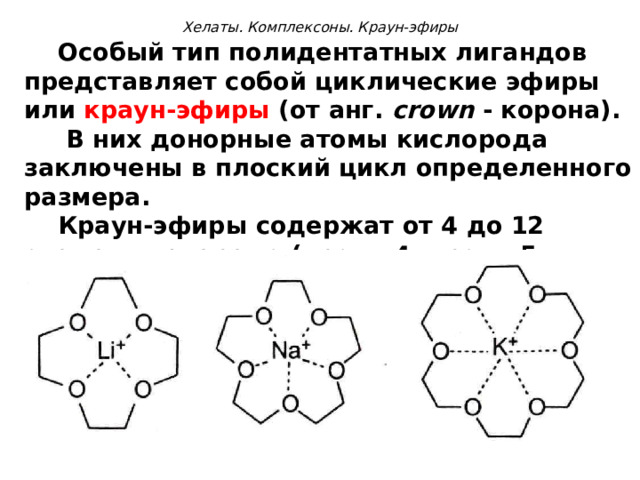
Хелаты. Комплексоны. Краун-эфиры
Особый тип полидентатных лигандов представляет собой циклические эфиры или краун-эфиры (от анг. crown - корона).
В них донорные атомы кислорода заключены в плоский цикл определенного размера.
Краун-эфиры содержат от 4 до 12 атомов кислорода (краун-4, краун-5 и т.д).
Полости краун-эфиров имеют строго определенные размеры. Поэтому краун-эфиры могут избирательно связывать ионы металлов, размеры которых близки к размерам полости.
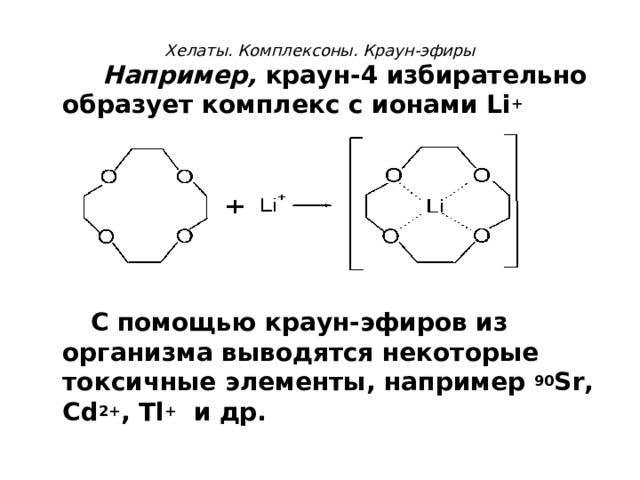
Хелаты. Комплексоны. Краун-эфиры
Например, краун-4 избирательно образует комплекс с ионами Li +
+
С помощью краун-эфиров из организма выводятся некоторые токсичные элементы, например 90 S r, Cd 2+ , Tl + и др.







![[Cu(NH 3 ) 4 ]SO 4 CuSO 4 NH 3 Na [ Al(OH) 4 ] N aOH Al(OH) 3](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img2.jpg)

![Комплекс означает центральный атом или ион металла, окруженный набором лигандов. [ Co ( NH 3 ) 6 ] 3+ - комплекс [ Co ( NH 3 ) 6 ] Cl 3 – комплексное соединение (соль) . [Fe ( CO ) 5 ] – комплекс и комплексное соединение](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img4.jpg)
![Основные положения координационной теории 1 Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями. Катионы: металлов (d- элементов ) : С u +2 , Co +3 , Fe +3 , Hg +2 и др. (реже р-элементы): Al +3 ( иногда неметаллы):В +3 , Si +4 . + +3 K 3 [ Fe(CN) 6 ]](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img5.jpg)

![Основные положения координационной теории 3. Координационное число – количество лигандов, которые может присоединять комплексообразователь . Координационное число – обычно в 2 раза больше, чем С.О. центрального иона. +1 (2) +2 ( 4 , 6) +3 ( 6 , 4) +4 ( 8 , 6) +2 [Cu(NH 3 ) 4 ] +2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img7.jpg)
![Основные положения координационной теории 4. Комплексообразователь и лиганды составляют внутреннюю сферу комплекса. [Cu(NH 3 ) 4 ] +2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img8.jpg)

![[N -3 H +1 4 ]Cl -1 ВНУТРЕННЯЯ СФЕРА : [NH 4 ] + КОМПЛЕКСНЫЙ ИОН N -3 КОМПЛЕКСООБРАЗОВАТЕЛЬ H + ЛИГАНДЫ Cl - ВНЕШНЯЯ СФЕРА АНИОН](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img10.jpg)
![Строение комплексного соединения Внешняя сфера Внутренняя сфера K 3 [Fe(CN) 6 ] Координационное число Ион-комплексообразователь (центральный атом) Лиганды](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img11.jpg)
![Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от комплекса. Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом. Координационное число (КЧ) – число донорных атомов, которые связаны с центральным атомом. [Fe ( CO ) 5 ] [ Co ( NH 3 ) 6 ] 3+](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img12.jpg)
![Примеры лигандов Анионы бескислородных кислот F - , Cl - , Br - , I - (фторо-лиганд и т.д.) Пример: K 2 [HgI 4 ] – тетра иод о меркур ат (II) калия Донорный атом O Остатки кислородсодержащих кислот CH 3 COO - - ацетато-лиганд CO 3 2- - карбонато-лиганд C 2 O 4 2- - оксалато-лиганд SO 4 2- - сульфато-лиганд Пример: K 3 [ Fe ( C 2 O 4 ) 3 ] – три оксалат о ферр ат ( III ) калия Не «железат» , «ртутат» и т.д. Элементы с исконно русскими названиями: медь, золото, серебро, углерод, кислород, азот, водород и т.д.](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img13.jpg)
![Донорный атом O OH - - гидроксо-лиганд O 2- - оксо-лиганд O 2 2- - пероксо-лиганд K 2 [ Zn ( OH ) 4 ] – тетра гидрокс о цинкат( II ) калия Электоронейтральные молекулы с донорными атомами O : H 2 O – аква-лиганд [ Fe ( H 2 O ) 6 ] (ClO 4 ) 3 – перхлорат гекса акважелеза( III )](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img14.jpg)
![(OH) - 4 [Zn +x Na + ] 2 (+1) + x + (-1) ·2 ·4 = 0 x = 0-2+4 x = +2 Na 2 + [Zn +2 (OH) - 4 ]](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img15.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3 [AlF 6 ] Ответ: Na + 3 [Al +3 F - 6 ] K[MgCl 3 ] Ответ: K + [Mg +2 Cl - 3 ] Na[Al(OH) 4 ] Ответ: Na + [Al +3 (OH) - 4 ] Na 4 [Fe(CN) 6 ] Ответ: Na + 4 [Fe +2 (CN) - 6 ] Na 3 [Al(OH) 6 ] Ответ: Na + 3 [Al +3 (OH) - 6 ] [Cu(NH 3 ) 4 ]Cl 2 Ответ: [Cu +2 (NH 3 ) 0 4 ]Cl - 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img16.jpg)



![Классификация По заряду комплекса Катионные Нейтральные [Cr(H 2 O) 4 ] 3+ Cl 3 [PtCl 4 (NH 3 ) 2 ] Катионно - анионные Анионные K 2 [PtCl 6 ] 2- [Cu(NH 3 ) 4 ] 2+ [PtCl 4 ] 2-](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img20.jpg)
![Классификация По составу внешней сферы Кислоты Соли H 2 [PtCl 6 ] Na 3 [AlF 6 ] Основания Неэлектролиты [Pt(NH 3 ) 2 Cl 2 ] [Ag(NH 3 ) 2 ] OH](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img21.jpg)
![Классификация По виду лигандов Аква комплексные Ацидо комплексные [Fe( H 2 O ) 6 ]SO 4 K[Au( CN ) 4 ] Смешанные Амино комплексные [Zn( NH 3 ) 4 ]Cl 2 [CoCl( NH 3 ) 3 ( H 2 O ) 2 ]( NO 3 ) 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img22.jpg)


![НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na + 2 4 ] (OH) - [Zn +2 цинкат натрия гидроксо тетра 6 ] Cl - 3 (H 2 O) 0 [Cr +3 хлорид аква гекса x рома (III) K + 2 [Hg +2 4 ] I - тетра йодо меркурат (II) калия](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img25.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3 [AlF 6 ] Гексафтороалюминат натрия Na[Al(OH) 4 ] Тетрагидроксоалюминат натрия K 4 [Fe(CN) 6 ] Гексационоферрат (II) калия](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img26.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3 ) 4 ]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3 ) 2 ]Cl Хлорид диамминсеребра [Cr(H 2 O) 6 ]Cl 3 Хлорид гексааквахрома (III)](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img27.jpg)
![СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2 [PtCl 6 ] Нитрат хлоронитротетраамминкобальта (III) Ответ: [Co(NH 3 ) 4 (NO 3 )Cl]NO 3 Гексагидроксохромат (III) натрия Ответ: Na 3 [Cr(OH) 6 ] Нитрат гексаамминникеля (II) Ответ: [Ni(NH 3 ) 6 ](NO 3 ) 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img28.jpg)
![ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Лабораторный опыт. Получение тетрагидроксоалюмината натрия AlCl 3 +3NaOH = Al(OH) 3 ↓+3NaCl Al(OH) 3 + NaOH = Na[Al(OH) 4 ] Лабораторный опыт. Получение гидроксида тетраамминмеди (II) CuCl 2 +2NH 3 +2H 2 O = Cu(OH) 2 ↓+NH 4 Cl Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img29.jpg)
![Химические свойства комплексных соединений 1. В растворе комплексные соединения ведут себя как сильные электролиты, т.е. полностью диссоциируют на катионы и анионы . [Pt(NH 3 ) 4 ]Cl 2 = [Pt(NH 3 ) 4 ] 2+ + 2Cl – , K 2 [PtCl 4 ] = 2K + + [PtCl 4 ] 2– [Cu(NH 3 ) 4 ]SO 4 ↔ [Cu(NH 3 ) 4 ] 2+ + SO 4 2-](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img30.jpg)
![2. Реакции по внешней сфере FeCl 3 +K 4 [Fe(CN) 6 ]→KFe[Fe(CN) 6 ]↓+3KCl [Cu(NH 3 ) 4 ]SO 4 +BaCl 2 → → [Cu(NH 3 ) 4 ]Cl 2 +BaSO 4 ↓ ХИМИЧЕСКИЕ СВОЙСТВА](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img31.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА 3. Реакции с участием лигандов [Cu(NH 3 ) 4 ]SO 4 +4HCl→4NH 4 Cl+CuSO 4 4. Реакции по центральному иону Обменные: [Ag(NH 3 ) 2 ]Cl + KI → AgI↓ + KCl + 2NH 3 Окислительно-восстановительные: 2 [Ag(NH 3 ) 2 ]OH +R-C=O H → 2Ag↓+RCOONH 4 +H 2 O+3NH 3](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img32.jpg)
![5. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH 3 ) 4 ]SO 4 = CuSO 4 + 4NH 3 .](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img33.jpg)





![Медико-биологическое значение темы B 12 - это хелат Co 3+ c порфирином B 12 (Co[C 62 H 88 N 13 O 14 P])CN](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img39.jpg)






![Хелаты. Комплексоны. Краун-эфиры [Pt 2+ (Е n ) 2 ] 2+ этилендиаминплатина ( II )](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img46.jpg)
![Хелаты. Комплексоны. Краун-эфиры [Co 3 + (Е n ) 3 ] 3 + этилендиаминкобальт( II )](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img47.jpg)



![Хелаты. Комплексоны. Краун-эфиры Обычно хелаты гораздо устойчивее комплексных соединений, содержащих монодентатные лиганды, т.к. комплексообразователь связан с лигандами несколькими донорно-акцепторными связями. Наиболее известными комплексонами высшего порядка являются: комплексон - II этилендиаминтетрауксусная кислота (ЭДТА) комплексон- III двузамещенная натриевая соль ЭДТА - Трилон Б: Na 2 [ H 2 Tr ]](https://fsd.multiurok.ru/html/2022/07/12/s_62cd44ebe09a3/img51.jpg)






















