

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Комплект контрольно-измерительных материалов по учебной дисциплине «Химия»
КИМ разработаны в рамках программы подготовки специалистов среднего звена (ППССЗ) по специальности 35.02.03 «Технология деревообработки», 22.02.06 «Сварочное производство», 08.02.01 «Строительство и эксплуатация зданий и сооружений».
Просмотр содержимого документа
«Комплект контрольно-измерительных материалов по учебной дисциплине «Химия»»
Министерство образования Омской области
бюджетное профессиональное образовательное учреждение Омской области
«Омский техникум строительства и лесного хозяйства»
Утверждаю
зам.директора БПОУ «ОТСЛХ»
______________ С.Г. Бурлачёнок
«___»_______2018 г.
Комплект
контрольно-измерительных материалов
по учебной дисциплине «Химия»
в рамках программы подготовки специалистов среднего звена (ППССЗ)
по специальности
35.02.03 «Технология деревообработки»
22.02.06 «Сварочное производство»
08.02.01 «Строительство и эксплуатация зданий и сооружений»
Омск 2018
Организация –разработчик : бюджетное профессиональное образовательное учреждение Омской области «Омский техникум строительства и лесного хозяйства» (БПОУ «ОТСЛХ»)
Разработчики:
преподаватель химии и биологии Ваганова Н.М.
Рассмотрено и рекомендовано Методическим объединением преподавателей
_________________________________________________________________________
Протокол № __ от « » августа 2018 г.
Председатель МО _____________/ Рыбель Л.А./
СОДЕРЖАНИЕ
| 1 | Паспорт контрольно-измерительных материалов учебной дисциплины |
|
| 2 | Комплект контрольно-измерительных материалов для входного контроля знаний |
|
| 3 | Комплект контрольно-измерительных материалов для проведения текущей оценки освоения учебной дисциплины |
|
| 4 | Комплект контрольно-измерительных материалов для проведения промежуточной аттестации по учебной дисциплине |
|
1. Паспорт контрольно-измерительных материалов учебной дисциплины «Химия»
Контрольно-измерительные материалы предназначены для проверки результатов освоения учебной дисциплины «Химия».
в рамках программы подготовки специалистов среднего звена (ППССЗ)
по специальности
35.02.03 «Технология деревообработки»
22.02.06 «Сварочное производство»
08.02.01 «Строительство и эксплуатация зданий и сооружений»
и в рамках программы подготовки квалифицированных рабочих служащих (ППКРС) по профессиям:
- 23.01.07«Машинист крана (крановщик)»
-15.01.05»Сварщик ( электросварщик ручной и частично механизированной сварки ( наплавки)).
Освоение содержания учебной дисциплины «Химия» должно обеспечить достижение обучающимися следующих результатов:
личностные результаты:
- чувство гордости уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
- готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
- умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности
метапредметные результаты:
- использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться а профессиональной сфере;
- использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
предметные результаты:
-сформированностьпредставлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозораи функциональной грамотности человека для решения практических задач;
- владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
- владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
-сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
-владение правилами техники безопасности при использовании химических веществ;
- сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Освоение содержания учебной дисциплины «Химия» обеспечивает формирование и развитие универсальных учебных действий в контексте преемственности формирования общих компетенций.
| Виды универсальных учебных действий | Общие компетенции (в соответствии с ФГОС СПО по специальности) |
| Личностные (обеспечивают ценностно-смысловую ориентацию обучающихся и ориентацию в социальных ролях и межличностных отношениях) | ОК1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес, ОК3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность. |
| Регулятивные: целеполагание, планирование, прогнозирование, контроль (коррекция), саморегуляция, оценка (обеспечивают организацию обучающимися своей учебной деятельности) | ОК2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество, ОК3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность. |
| Познавательные (обеспечивают исследовательскую компетентность, умение работать с информацией) | ОК4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
|
| Коммуникативные (обеспечивают социальную компетентность и учет позиции других людей, умение слушать и вступать в диалог, участвовать в коллективном обсуждении проблем, взаимодействовать и сотрудничать со сверстниками и взрослыми) | ОК6. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
|
КИМ включают материалы для проведения входного контроля знаний, текущего контроля знаний (контрольные, практические работы, самостоятельная работа), промежуточной аттестации.
Формой проведения промежуточной аттестации по учебной дисциплине «Химия » является дифференцирующий зачёт
2. Результаты освоения учебной дисциплины, подлежащие проверке (входной контроль)
| Освоенные умения | Усвоенные знания |
| освоение важнейших знаний об основных понятиях и законах химии, химической символике; | Знание об основных понятиях химии как науки |
| производить расчеты на основе химических формул веществ и уравнений химических реакций | Знание о способах химических экспериментов |
| развитие познавательных интересов и самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями | Знание о практической направленности химии |
3. Результаты освоения учебной дисциплины, подлежащие проверке (текущий контроль)
| Результаты обучения: умения. Знания и общие компетенции | Показатели оценки результата | Форма контроля и оценивания |
| Уметь: | | |
| У1 проводит расчеты по химическим формулам и уравнениям реакции; | 1. Находит массовые доли и массы элементов в веществе 2. Выводит формулу вещества по массовым долям элементов 3. Выводит формулу вещества по продуктам горения 4. Рассчитывает массу (объем) продукта реакции по известным исходным веществам) 5. Рассчитывает массу (объем) продукта реакции по известным исходным веществам, взятым в избытке или недостатке 6. Находит практический выход продуктов реакции | Практическая работа №1 |
| У2 использует свойства неорганических веществ, дисперсных систем для оптимизации технологического процесса; | Предлагает пути оптимизации технологических процессов, опираясь на свойства неорганических соединений | Устный опрос, тестирование |
| У3 описывает уравнениями химических реакций процессы, лежащие в основе химических производств; | Записывает уравнения реакций, протекающих при производстве серной, азотной кислот, аммиака, пластмасс | Самостоятельная работа, химический диктант. Практическая работа №4 |
| У4 проводит расчеты по химическим формулам и уравнениям реакции; | Рассчитывает скорость химических реакций на основе законов химической кинетики, решает задачи на смещение химического равновесия, рассчитывает энтальпию, энтропию и энергию Гиббса термохимических процессов | Тестирование ,устный опрос |
| У5 правильно использует лабораторную посуду и оборудование при выполнении эксперимента | Демонстрирует правильные приемы нагревания, прокаливания, фильтрования, взвешивания на аналитических весах, по назначению использует различные виды химической посуды | Практическая работа №2 |
| У6 определяет методику и ход химического анализа, подбирает соответствующие реактивы и аппаратуру; | Составляет схемы анализа неизвестного вещества на основе частных реакций на катионы и анионы | Практическая работа№5 |
| У7 проводит качественные реакции на ионы, белки и углеводы, спирты, карбоновые кислоты; | Проводит химические опыты, подтверждающие цветные реакции белков, качественные реакции на глюкозу, многоатомные спирты, карбоновые кислоты | Практическая работа №8 |
| У8 выполняет количественные расчеты состава вещества по результатам измерений; | Рассчитывает водородный показатель среды на основе результатов эксперимента | Практическая работа№7 |
| Знать: |
|
|
| З1 основные понятия и законы химии; | Воспроизводит формулировки основных законов химии Дает определения терминам и понятиям | Устный опрос, химический диктант, самостоятельная работа |
| З2 теоретические основы органической, неорганической, общей химии; | Озвучивает задачи органической, неорганической, общей химии и их основополагающие законы | Тестирование |
| З3 понятие химической кинетики и катализа; | Дает определение химической кинетики, скорости химической реакции, записывает и использует для вычисления формулы химической кинетики, дает определения катализаторов, описывает их влияние на скорость химической реакции | Устный опрос |
| З4 классификацию химических реакций и закономерности их протекания; | Называет типы, виды химических реакций, дает им определения, приводит примеры | Устный опрос Самостоятельная работа Практическая работа №3 Тестирование |
| З5 обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов; | Дает определение химического равновесия, называет факторы смещения химического равновесия, рассказывает о закономерностях смещения химического равновесия | Устный опрос Самостоятельная работа Химический диктант |
| З6 окислительно-восстановительные реакции, реакции ионного обмена; | Дает определение терминам: ион, катион, анион, ионное уравнение, окислитель, восстановитель, окислительно-восстановительная реакция, метод электронного баланса Окисление , восстановление | Устный опрос Самостоятельная работа Тестирование |
| З7 гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; | Дает определение гидролиза, приводит примеры гидролиза солей, кислот, оснований, дает определение электролитам и их классификацию | Устный опрос Самостоятельная работа Тестирование |
| З8 тепловой эффект химических реакций, термохимические уравнения; | Дает определение тепловому эффекту химической реакции и соотносит его с понятием энтальпии, записывает уравнения термохимических процессов | Устный опрос Самостоятельная работа Устный опрос Самостоятельная работа Тестирование |
| З9 характеристики различных классов органических и неорганических соединений; | Воспроизводит классификацию органических веществ по строению, функциональным группа. Дает определение белков, углеводов и жиров, рассказывает об их классификации и отличительных признаках | Устный опрос Самостоятельная работа Практическая работа №3,№6 Тестирование Контрольная работа№1,2,3 |
| З10 свойства растворов и коллоидных систем высокомолекулярных соединений; | Дает определение ВМС, рассказывает о коллоидных растворах ВМС, называет их особенности | Составление опорного конспекта |
| З11 основы аналитической химии; | Рассказывает о предмете аналитической химии и её задачах | Составление опорного конспекта, |
| З12 основные методы классического количественного анализа; | Перечисляет методы количественного анализа, приводит классификацию методов физико-химического анализа | Устный опрос Самостоятельная работа
Тестирование
|
| З13 назначение и правила использования лабораторного оборудования и аппаратуры; | Называет различные виды посуды и оборудования, описывает их назначения и правила пользования | Составление опорного конспекта |
| З14 методы и технику выполнения химических анализов; | Описывает правила проведения химического эксперимента, | Устный опрос Самостоятельная работа Практическая работа №6 Тестирование |
| З15 приемы безопасной работы в химической лаборатории | Перечисляет правила ТБ и охраны труда при проведении работ в лаборатории химии | Устный опрос |
- Измерительные материалы для оценивания результатов освоения учебной дисциплины
Форма дифференцированного зачета: тестовые задания
Условия выполнения задания
1. Место (время) выполнения задания: учебная аудитория БПОУ «ОТСЛХ».
2. Максимальное время выполнения задания: 60 минут.
3. Источники информации, разрешенные к использованию на экзамене, оборудование: Таблицы «Периодическая система химических элементов Д.И. Менделеева», «Электрохимический ряд напряжений металлов», «Растворимость солей, кислот и оснований»
Задания для входного контроля:
Тематика вопросов теста:
1. Строение вещества (13 вопросов)
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 Электронная формула внешнего энергетического уровня атома кремния
А. 3s23p2 Б. 3s23p4 В. 4s24p2 Г. 4s24p4
2 . Порядковый номер элемента в Периодической системе определяется:
A. Зарядом ядра атома.
Б. Числом электронов в наружном слое атома.
B. Числом электронных слоев в атоме.
Г. Числом нейтронов в атоме.
3 Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. Si и SiH4 Г. S и H2S
4 Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и Se. В. К и Са. Г. Мn и Fe.
5 s-Элементом является:
А. Барий. Б. Галлий. В. Америций. Г. Ванадий.
6 Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Sr—Rb—К. Б. Na—К—Са. В. Be—Li—К. Г. А1—Mg—Be.
7 Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А. Э2О. Б. Э2О3. В. ЭО2. Г. Э2О5.
8 Электронная формула атома фосфора
А. 1s22s2 2p3 Б. 1s22s22p63s23p3 В. 1s22s22p5 Г. 1s22s22p63s23p5
9 Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А. алюминия Б. азота В. фосфора Г. хлора
10 Электронная формула атома 1s22s22p63s23p3. Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. P и PH3 Г. S и H2S
11. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и P. В. К и Nа. Г. Мn и Fe.
12. s-Элементом является:
А. натрий. Б. фосфор. В. уран. Г. ванадий.
13. Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Mg—Ca—Zn. Б. Sr—Rb—К. В. А1—Mg—Са. Г. Ge—Si—Sb.
Ответы: А,А,В,Б,А,В,Г,Б,В,В,В,А,В.
2. Классификация неорганических соединений и их свойства (12 вопросов)
1. К амфотерным оксидам относится
1. CuO
2. P2O3
3. Cr2O3
4. CrO3
2. Среди перечисленных веществ кислой солью является
1. гидрид магния;
2. гидрокарбонат натрия;
3. гидроксид кальция;
4. гидроксокарбонат меди.
3. Какой из элементов может образовать кислотный оксид?
1. стронций
2. марганец
3. кальций
4. магний.
4. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1. водой и соляной кислотой;
2. кислородом и оксидом магния;
3. оксидом кальция и гидроксидом натрия;
4. водой и медью.
5. Гидроксид железа (III) образуется при действии растворов щелочей на:
1. оксид железа (II);
2. оксид железа (III);
3. растворы солей железа (II);
4. растворы солей железа (III).
6. Хлорид железа (II) реагирует с каждым из двух веществ:
1. MgO , HCl
2. Zn , AgNO3
3. HNO3, CO2
4. CaO, CO2.
7. В схеме превращений CaCO3 ? X1 ? X2 + NaCl веществом Х2 является
1. CaCO3
2. CaCl2
3. CaO
4. Ca(OH)2.
8. В схеме превращений FeCl3 ? X1 ? X2 ? Fe(OH)3 веществами Х1 и Х2 могут быть соответственно
1. Fe2(SO4)3, Fe2O3
2. FePO4, Fe3O4
3. Fe(NO3)3, Fe2O3
4. Fe(OH)3, Fe2(SO4)3.
9. Установите соответствие между формулой вещества и его принадлежностью к определенному классу
Формула вещества Класс неорганических соединений
A) H3AsO4
Б) BeO
В) Ca(OH)Cl
Г) SO3
1) кислота
2) основание
3) основный оксид
4) амфотерный оксид
5) кислотный оксид
6) соль
10. Формулы только основных солей указаны в ряду
1. KHCO3, Na2Cr2O7, (CuOH)2SO4;
2. CuCl2, NaHSO3, (AlOH) Cl2;
3. Ca(HCO3)2, ZnS, (FeOH)Cl;
4. (FeOH)NO3, (CuOH)2CO3, MgOHCl.
11. Оксид углерода (IV) реагирует с каждым из двух веществ:
1. водой и оксидом кальция;
2. кислородом и оксидом серы (IV);
3. сульфатом калия и гидроксидом натрия;
4. фосфорной кислотой и водородом.
12. При прокаливании Cr(OH)3 образуется вода и
1. оксид хрома (II);
2. оксид хрома (III);
3. оксид хрома (VI);
4. хром.
Ответы: 3,2,2,3,4,2,1,4,1465,4,1,2
3. Химические реакции (12 вопросов)
1. Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Концентрации реагирующих веществ.
Г. Форма сосуда, в котором протекает реакция.
2. Фактор, влияющий на смещение химического равновесия:
A. Вид химической связи.
Б. Катализатор.
B. Природа реагирующих веществ.
Г. Температура.
3. При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза. В. В 8 раз.
Б. В 4 раза. Г. В 16 раз.
4. С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(г) + Н2О(г) ↔ С2Н5ОН(г)
A.He изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
5. Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + 02 ↔ 2SO3 + Q,в сторону исходных веществ необходимо:
A. Увеличить давление.
Б. Повысить температуру.
B. Понизить температуру.
Г. Применить катализатор.
6. Повышение температуры смещает химическое равновесие вправо (→) в обратимой реакции, уравнение которой:
А. 2Н2 + О2 ↔ 2Н 2О + Q
Б. SO2 + H2O ↔ H2SO3 + Q
В. 2NO + O2 ↔ 2NO2 + Q
Г. C4Н10 ↔ С4Н8 + Н2 – Q
7 Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Способ получения реагентов.
Г. Температура.
8 Фактор, не влияющий на смещение химического равновесия:
A. Давление.
Б. Концентрация реагирующих веществ.
B. Температура.
Г. Природа реагирующих веществ.
9.Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ =2) надо повысить температуру:
А. НаЗ0°С. В.На50°С.
Б. На 40 °С. Г. На 60 °С.
10 С увеличением концентрации SO2 равновесие обратимой химической реакции,
уравнение которой 2SO2 + О2 ↔2SO3 + Q:
A. Не изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
Ответы: Г,Г,А,Б,Б,Г,В,Г,В,Б.
Критерии оценивания заданий
«5»: 86%-100% от максимальной суммы баллов
«4»: 71-85% от максимальной суммы баллов
«3»: 60-70% от максимальной суммы баллов
«2»: 0-59% от максимальной суммы баллов
3. Комплект контрольно-измерительных материалов для проведения текущей оценки освоения учебной дисциплины
- Измерительные материалы для оценивания результатов освоения учебной дисциплины
Формы текущего контроля (письменный – практическая работа, самостоятельная и контрольная работа, тематическое тестирование)
Условия выполнения задания
1.Место (время) выполнения задания: кабинет химии и биологии
2. Максимальное время выполнения задания: 2часа 40 минут
3. Оборудование: карандаш, линейка, авторучка, комплект приборов (по теме практической работы).
Критерии оценивания выполнения практической работы:
Оценка «5» ставится в том случае, если студент:
а) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;
б) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
в) в представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы;
г) правильно выполнил анализ погрешностей, если требуются в данной работе;
д) соблюдал требования безопасности труда.
Оценка «4» ставится в том случае, если выполнены требования к оценке «5», но:
а) опыт проводился в условиях, не обеспечивающих достаточной точности измерении,
б) или было допущено два-три недочета, или не более одной негрубой ошибки и одного недочета.
Оценка «3» ставится, если работа выполнена не полностью, но объем выполненной части таков, что позволяет получить правильные результаты и выводы, или если в ходе проведения опыта и измерений были допущены следующие ошибки:
а) опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью,
б) или в отчете были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, анализе погрешностей и т. д.), не принципиального для данной работы характера, но повлиявших на результат выполнения,
в) или не выполнен совсем или выполнен неверно анализ погрешностей;
г) или работа выполнена не полностью, однако объем выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы.
Оценка «2» ставится в том случае, если:
а) работа выполнена не полностью, и объем выполненной части работы не позволяет сделать правильных выводов,
б) или опыты, измерения, вычисления, наблюдения производились неправильно,
в) или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке «3».
Контрольная работа №1
Углеводороды
Вариант 1
1. Для вещества, формула которого С 6 Н 12 составьте структурные формулы двух гомологов и двух изомеров. Назовите все вещества по международной номенклатуре.
2. Осуществите цепочку химических превращений, приведите уравнения реакций:
А) Пропан--- пропен---2-хлорпропан.
Б) этан--- этилен---этиловый спирт
3. Приведите пример межклассовой изомерии, изомер этого вещества соответствует циклопентану.
4. Предложите схему получения полипропилена из природного газа и напишите уравнения реакций.
5. Найдите объем этилена (н.у.), полученного реакцией дегидратации 230 мл. 95%-го этилового спирта (плотность 0,8г/мл)
6. Этилен горит светящимся пламенем в отличии от бесцветного пламени этана. Почему? Ответ подтвердите расчетом массовой доли углерода в молекулах этих веществ. Составьте уравнение реакции горения этилена.
Вариант 2
1. Для вещества, формула которого С 8 Н 16 составьте структурные формулы двух гомологов и двух изомеров. Назовите все вещества по международной номенклатуре.
2. Осуществите цепочку химических превращений, приведите уравнения реакций:
А) метан--- ацетилен---уксусный альдегид
Б ) этилен--- этан---1,2-дихлорэтан
3. Приведите пример межклассовой изомерии, изомер этого вещества соответствует циклогексану.
4. Предложите схему получения бутадиенового каучука из бутана и напишите уравнения реакций.
5. Рассчитайте объем ацетилена, который может быть получен из 128 г. карбида кальция, содержащего 5%примесей, если выход ацетилена составляет 80% от теоретически возможного.
6. Каков характер пламени при горении этилена и ацетилена? Ответ подтвердите расчетом массовой доли углерода в молекулах этих веществ.
Контрольная работа № 2
Спирты. Фенолы. Альдегиды. Кетоны. Карбоновые кислоты.
1. Какие соединения относятся к альдегидам и кетонам? Приведите общие формулы альдегидов и кетонов.
2. Сравните строение альдегидов и кетонов. На основании сравнения сделайте вывод о том, какие общие свойства они имеют и какими свойствами они отличаются.
3. Расположите приведенные ниже карбонильные соединения в ряд по убыванию активности в реакциях с нуклеофильными реагентами: а) СН3СН2СНО; б) С6Н5СНО; в) С6Н5СОС6Н5; г) СН3СОС6Н5; д) СН3СОСН3.
4. Как осуществить следующие превращения:
? СН3СН2ОН




 1 2 О 5 8
1 2 О 5 8
С2Н4 СН3С ?




 Н 6 О 7
Н 6 О 7
3 ? 4 СН3С
ОН
5. Вычислите массу карбида кальция, содержащего 20 % примесей, необходимую для двухстадийного синтеза ацетальдегида (выход продукта на каждом этапе равен 80 %). Требуется получить 20 кг 20 % раствора альдегида.
6. Напишите химические уравнения, соответствующие следующей схеме:
Н2О Н2О [Ag(NH3)2]OH HCl C2H5OH
СаС2 А Б
Контрольная работа №3
Азотсодержащие органические вещества
Вариант 1
Составьте структурные формулы всех веществ, имеющих состав С4Н11N. Назовите вещества.
Как можно получить анилин, исходя из метана? Составьте цепочку превращений и напишите уравнения реакций.
Напишите уравнения реакций, подтверждающих амфотерный характер
β-аминовалериановой кислоты.
При сжигания органического вещества массой 9 г образовалось 17,6 г углекислого газа, 12,6 г воды и азот. Относительная плотность вещества по водороду равна 22,5. Найдите молекулярную формулу вещества и напишите структурные формулы изомеров, отвечающих этой молекулярной формуле.
Вариант 2
Напишите структурные формулы изомерных аминокислот состава С4Н9О2N. Назовите их.
Как можно получить аминоуксусную кислоту, исходя из метана? Составьте цепочку превращений и напишите уравнения реакций.
Напишите уравнения реакций, характерных для анилина. В какой реакции проявляется влияние аминогруппы на бензольное кольцо молекулы? Как эта реакция протекает у бензола?
Определите молекулярную формулу аминокислоты, массовые доли углерода, водорода, кислорода и азота в которой составляют 32, 6,66, 42,67 и 18,67% соответственно. Напишите структурную формулу этой аминокислоты и назовите ее.
Практическая работа №1
Вычисление массы продукта реакции, если известна масса исходного вещества, содержащего определенную массу исходного вещества.
Задача 1
Какой объем водорода (н.у.) образуется при взаимодействии 101, 25 кг. алюминия, содержащего 20 % примесей с соляной кислотой?
Задача 2
Какова масса железа, полученного при взаимодействии 400 т. оксида железа (III), содержащего 20% примесей с водородом?
Задача 3
Какой объем и количество вещества углекислого газа (н.у.) образуется при взаимодействии с избытком соляной кислоты 250 г. известняка, содержащего 30% примесей?
Задача 4
В медицине часто применяется физиологический раствор – 0,9 % раствор хлорида натрия. Какова масса соли вводится при введении в организм 500 г. такого раствора
Практическая работа №2
Свойства кислот
Задание 1
Цель: изучить на практике реакции, характеризующие свойства кислот.
Оборудование: пять пробирок, штатив для пробирок, пробиркодержатель, нагревательный прибор, спички, шпатель.
Реактивы: соляная кислота, растворы серной кислоты, гидроксида натрия, нитрата серебра, хлорида бария, карбоната натрия, фенолфталеина, цинк, медь, оксид меди (II), универсальная индикаторная бумага (или раствор лакмуса, метилового оранжевого)
Порядок выполнения работы
Опыт №1
Определение среды растворов кислот
Нальем в пробирку соляную кислоту (или раствор серной кислоты).
Добавим 2-3 капли раствора лакмуса (или воспользуемся универсальной индикаторной бумагой, или раствором метилового оранжевого).
Наблюдаемые явления: раствор лакмуса становится красным (универсальная индикаторная бумага приобретает малиновый цвет, метиловый оранжевый - розовеет).
Уравнения реакций:
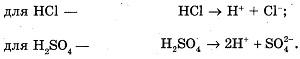
Вывод: растворы кислот изменяют окраску индикаторов, т.е. в растворе присутствуют ионы водорода Н+ .
Опыт №2
Взаимодействие кислот с металлами
В две пробирки нальем соляную кислоту (раствор серной кислоты). В одну добавим стружки цинка, а в другую - кусочки медной проволоки.
Наблюдаемые явления: в пробирке с цинком наблюдается выделение бесцветного газа водорода, в пробирке с медью - без изменений.
Уравнения реакций:
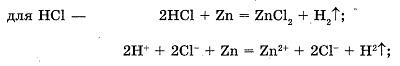

Вывод: кислоты реагируют с металлами, стоящими в ряду напряжений металлов до водорода, с образованием соли и водорода (кроме HNO3 и концентрированной H2SO4).
Опыт №3
Взаимодействие кислот с оксидами металлов
В пробирку с соляной кислотой (раствором серной кислоты) насыпаем на кончике шпателя черный порошок оксида меди (II).
Укрепляем пробирку в пробиркодержатель и аккуратно нагреваем.
Наблюдаемые явления: порошок оксида меди (II) постепенно растворяется, раствор приобретает сине-зеленый цвет.
Уравнения реакций:
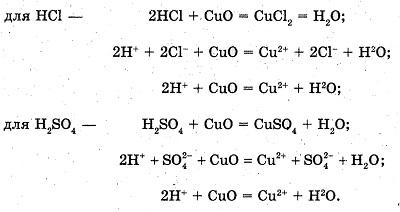
Вывод: кислоты реагируют с оксидами металлов с образованием соли и воды.
Опыт №4
Взаимодействие кислот с основаниями
В пробирку наливаем 2-3 мл раствора гидроксида натрия.
Добавляем 1-2 капли раствора фенолфталеина.
Наблюдаемые явления: раствор окрашивается в малиновый цвет.
Доливаем в пробирку соляную кислоту (раствор серной кислоты) до обесцвечивания раствора.
Наблюдаемые явления: раствор обесцвечивается.
Уравнения реакций:
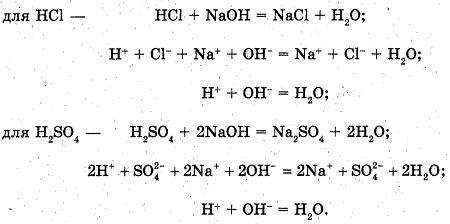
Вывод: кислоты вступают в реакцию нейтрализации с основаниями с образованием соли и воды.
Опыт №5
Взаимодействие кислот с солями
1. В пробирку наливаем раствор карбоната натрия.
Добавляем соляную кислоту (раствор серной кислоты).
Наблюдаемые явления: Происходит бурное выделение бесцветного газа, "Вскипание" раствора.
Уравнения реакций:
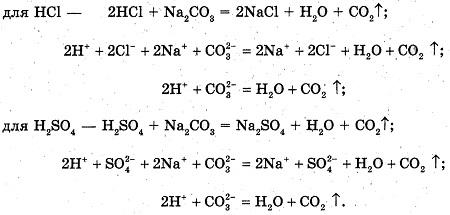
2. В пробирку наливаем соляную кислоту и добавляем 1-2 капли нитрата серебра.
Наблюдаемые явления: выпадает творожистый осадок белого цвета.
Уравнения реакций:
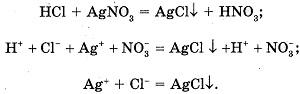
или
В пробирку наливаем раствор серной кислоты и добавляем немного раствора хлорида бария.
Наблюдаемые явления: выпадает осадок белого цвета.
Уравнения реакций:
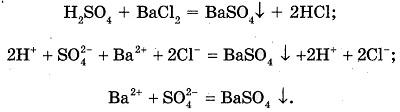
Вывод: растворы кислот реагируют с солями с образованием новой соли и новой кислоты, если в процессе реакции выделяется газ или выпадает осадок.
Практическая работа №3
Генетическая связь между основными классами неорганических соединений
| Ход работы Фронтальная беседа по вопросам: - Что такое генетическая связь? Генетические связи - это связи между разными классами, основанные на их взаимопревращениях. - Что такое генетический ряд? Генетический ряд – ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих превращения данных веществ. В основу этих рядов положен один и тот же элемент. - Какие виды генетических рядов принято выделять? Среди металлов можно выделить две разновидности рядов: а) Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений: металл →основный оксид → щёлочь → соль например, генетический ряд калия K → K2O → KOH→ KCl б) Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений: металл → основный оксид → соль→ нерастворимое основание →основный оксид → металл например: Cu→ CuO → CuCl2 → Cu(OH)2 → CuO → Cu Среди неметаллов также можно выделить две разновидности рядов: а) Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл → кислотный оксид → растворимая кислота → соль. Например: P→ P2O5 → H3PO4 →Na3PO4 б) Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота: неметалл → кислотный оксид → соль→ кислота → кислотный оксид → неметалл Например: Si→ SiO2 → Na2SiO3 → H2SiO3→ SiO2 → Si Выполнение заданий по вариантам: 1. Выберите в вашем варианте формулы оксидов, объясните свой выбор, опираясь на знание признаков состава данного класса соединений. Назовите их. 2. В столбце формул вашего варианта найдите формулы кислот и объясните свой выбор на основании анализа состава этих соединений. 3. Определите валентности кислотных остатков в составе кислот. 4. Выберите формулы солей и назовите их. 5. Составьте формулы солей, которые могут быть образованы магнием и кислотами вашего варианта. Запишите их, назовите. 6. В столбце формул вашего варианта найдите формулы оснований и объясните свой выбор на основании анализа состава этих соединений. 7. В вашем варианте выберите формулы веществ, с которыми может реагировать раствор ортофосфорной кислоты (соляной, серной). Составьте соответствующие уравнения реакций. 9. Среди формул своего варианта выберите формулы веществ, способных взаимодействовать между собой. Составьте соответствующие уравнения реакций. 10. Составьте цепочку генетических связей неорганических соединений, в состав которой войдет вещество, формула которого дана в вашем варианте под номером один.
11. Из данных веществ составьте генетический ряд, используя все формулы. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений: I вариант: ZnSO4, Zn, ZnO, Zn, Zn(OH)2 II вариант: Na2SO4, NaOH, Na, Na 2O2, Na2O |
Практическая работа №4
Металлы и неметаллы
Цель: сравнить свойства металлов и неметаллов
Вариант №1.
1. Напишите электронную и графическую формулу элемента № 17 и формулы его водородного соединения, высшего оксида и соединения с кальцием. Укажите тип связи в этих соединениях.
2. Как изменяются неметаллические свойства элементов в ряду:
Si → P → S → Cl
- у какого элемента радиус атома наименьший?
- какой элемент имеет наименьшую электроотрицательность?
3. Даны вещества:
MgCl2 Fe(OH) 3 Ca(OH) 2 SO3 BaCO3 H2SO4 Al(OH) 3 Zn(OH) 2 HNO3 FeO SiO2 CaO
Выпишите формулы:
а) амфотерных гидроксидов,
б) основных оксидов,
в) кислот,
г) солей.
4. Осуществите превращения и определите тип каждой реакции:
AgCl ← MgCL2 → Mg → MgO → MgSO4 → Mg(OH) 2
5. Какова масса и количество вещества оксида магния, который образуется при взаимодействии 2, 4 г магния с кислородом?
Практическая работа № 5
Классификация органических соединений. Основы номенклатуры.
Цель работы: Определить, используя характерные реакции, какое вещество находится в каждой пробирке.
Оборудование и реактивы: пробирки, водяная баня, растворы уксусной кислоты, фенола, глицерина, формальдегида, лакмус, стружки магния, бромная вода, раствор хлорида железа (III), раствор сульфата меди (II), раствор гидроксида натрия, аммиачный раствор оксида серебра (I).
Выполнение работы.
В четырех пробирках даны растворы уксусной кислоты, фенола, глицерина и формальдегида.
Используя характерные реакции, определите, какое вещество находится в каждой пробирке. Составьте в тетради план решения задачи в виде таблицы, куда запишите свои наблюдения.
| Н Реактив |
|
|
|
|
| Формула исследуемого вещества |
|
|
|
|
Под таблицей напишите уравнения реакций. Назовите все полученные органические вещества. Сделайте вывод о том, в какой пробирке находится каждое из предложенных веществ.
1. Приведите уравнения характерных реакций на фенол, глицерин и альдегид. Укажите условия протекания реакций.
2. В четырех пробирках находятся: глицерин, формальдегид, муравьиная и уксусная кислоты. Распознайте данные вещества, приведите уравнения соответствующих реакций.
3. Как можно доказать присутствие муравьиной кислоты в уксусной кислоте?
4. Предложите химический способ очистки этанола от примеси уксусной кислоты. Приведите уравнение реакции.
5. Как можно отличить этиловый спирт от глицерина? Ответ подтвердите уравнением реакции.
6. Вещество «А» представляет собой бесцветную жидкость со своеобразным запахом, легче воды и хорошо в ней растворяющуюся. При нагревании этого вещества в присутствии концентрированной серной кислоты образуется газ «В» легче воздуха. Взаимодействуя с бромоводородом, «В» образует тяжелую жидкость «С». Приведите формулы веществ «А», «В» и «С». Напишите уравнения реакций.
Практическая работа № 6
Свойства спиртов. Физиологическое действие спиртов на организм человека.
Цель работы: 1. Изучить некоторые физические и химические свойства предельных одноатомных спиртов и объяснить, чем они обусловлены.
Оборудование и реактивы: спиртовка, пробирки, дистиллированная вода, этиловый спирт, изоамиловый спирт, лакмус, фенолфталеин, концентрированная серная кислота, натрий металлический.
ОПЫТ 1. Растворимость спиртов в воде.
В две пробирки налейте по 2-3 мл. воды и добавьте в первую 1 мл. этилового, а во вторую – 1 мл. изоамилового спирта. Полученные смеси в пробирках встряхните и дайте постоять. Полученные растворы спиртов используйте в опыте № 2.
Задания:
1. Занесите в тетрадь результаты эксперимента.
2. Сделайте вывод о растворимости спиртов.
ОПЫТ 2. Отношение спиртов к индикаторам.
Каждый из спиртовых растворов, приготовленных в опыте № 1, разделите на две части. Испытайте полученные растворы спиртов на лакмус и фенолфталеин.
Задания:
1. Результаты эксперимента запишите в тетрадь в виде таблицы.
2. Сделайте вывод о степени кислотности или щелочности спиртов.
ОПЫТ 3. Образование и гидролиз алкоголята.
В обезвоженный этиловый спирт бросьте свежеотрезанный, очищенный от корочек и высушенный фильтровальной бумагой кусочек натрия величиной с небольшую горошину. Для предотвращения выкипания спирта в случае бурного протекания реакции охлаждайте пробирку в стакане с холодной водой. Когда выделение газа станет спокойным, подожгите его. Что наблюдаете? Если выделение газа почти прекратилось, а натрий полностью не растворился, осторожно нагрейте загустевшую смесь и удалите оставшийся кусочек натрия при помощи изогнутой проволочки. Затем к содержимому пробирки добавьте 5-6 мл. воды и каплю фенолфталеина. Как изменяется окраска индикатора? Почему этиловый спирт предварительно подвергали обезвоживанию?
Задания:
1. Составьте уравнения реакций образования и гидролиза алкоголята натрия.
2. Запишите наблюдения.
3. Ответьте на вопросы, поставленные в тексте эксперимента.
Сделайте вывод о том, какие свойства характерны для спиртов и как эти свойства связаны с их строением.
Практическая работа №7.
Решение экспериментальных задач по теме: «Классы неорганических соединений»
Цель работы: Научиться опытным путем получать и распознавать неорганические вещества.
Оборудование и реактивы: штатив с кольцом, пробирки-6 штук, спиртовка,
фарфоровая чашечка, спички, металлическая ложечка для сжигания, реактивы – индикаторы фенолфталеин, лакмус, гидроксид натрия, соляная кислота, оксид кальция, магний стружка, сульфат меди (II), хлорид железа (III)
Задача 1
В двух пробирках находится прозрачный раствор. Как при помощи индикаторов: а) фенолфталеина, б) лакмуса определить в какой из пробирок находится гидроксид натрия, а в какой соляная кислота
Задача 2
Осуществить превращение: оксид кальция → гидроксид кальция В пробирке №3 дан оксид кальция. Получить гидроксид кальция. Доказать, что полученное вещество-щелочь. Записать уравнение химической реакции
Задача 3
Осуществить превращения:
Как получить гидроксид магния, исходя из металлического магния?
Магний → оксид магния → хлорид магния → гидроксид магния
Запишите уравнения химических реакций:
А) горения магния в кислороде
Б) взаимодействия оксида магния с соляной кислотой
В) взаимодействия хлорида магния с гидроксидом натрия
Задача 4
Осуществить превращения:
Сульфат меди (II) → гидроксид меди (II) → оксид меди (II)
Даны гидроксид натрия и сульфат меди (II), получить гидроксид меди (II).
Как из гидроксида меди (II)получить оксид меди (II)?
Запишите уравнения химических реакций.
Задача 5
Как из хлорида железа (III)получить оксид железа (III) (косвенным путем, т.е. в два этапа)? Осуществить превращение: хлорида железа (III) → оксид железа (III). Запишите уравнения химических реакций.
Практическая работа №8.
«Генетическая связь между классами органических и неорганических соединений»
Цель работы: Систематизировать знания по неорганической и органической химии, выполнить одну из задач на распознавание неорганических и органических веществ.
Оборудование и реактивы: пробирки, спиртовка, держатель для пробирок, набор необходимых реактивов для распознавания неорганических и органических веществ, исследуемые неорганические и органические вещества.
В данной практической работе необходимо выполнить одну из экспериментальных задач.
Задача 1. В шести пронумерованных пробирках содержатся водные растворы веществ: FeSO4, Pb(NO3)2, Mn(NO3)2, H2O2, H2SO4, NaOH. Определите содержимое каждой пробирки с помощью только растворов указанных веществ, не пользуясь другими реактивами. Напишите уравнения реакций, которые могут быть использованы для идентификации этих веществ. Ответ оформите в виде таблиц (см. табл. 1 и табл. 4). В графах этих таблиц укажите характерные признаки продукта реакции, образующегося при взаимодействии каждого из шести предложенных веществ с каждым другим веществом.
Таблица 1 – Форма записи результатов по идентификации веществ в задаче 1
Мысленный эксперимент
| Вещество | FeSO4 | Pb(NO3)2 | Mn(NO3)2 | H2O2 | H2SO4 | NaOH |
| FeSO4 | х |
|
|
|
|
|
| Pb(NO3)2 |
| х |
|
|
|
|
| Mn(NO3)2 |
|
| х |
|
|
|
| H2O2 |
|
|
| х |
|
|
| H2SO4 |
|
|
|
| х |
|
| NaOH |
|
|
|
|
| х |
Таблица 2 – Форма записи результатов по идентификации веществ в задаче 1
Реальный эксперимент
| Номер пробирки | 1 | 2 | 3 | 4 | 5 | 6 | Вывод |
| 1 | х |
|
|
|
|
|
|
| 2 |
| х |
|
|
|
|
|
| 3 |
|
| х |
|
|
|
|
| 4 |
|
|
| х |
|
|
|
| 5 |
|
|
|
| х |
|
|
| 6 |
|
|
|
|
| х |
|
Задача 2. В семи пронумерованных пробирках находятся растворы следующих веществ: AlCl3, Na2CO3, H2SO4, K2SO4, BaCl2, NaOH и лакмуса. Используя в качестве реактивов только эти растворы, определите, под каким номером находится каждое из названных веществ. Предложите план анализа и напишите уравнения проводимых реакций.
Задача 3. В пробирках № 1 и № 2 содержатся по одному из следующих веществ: глюкоза, сахароза, карбамид (мочевина), ацетат натрия, щавелевая кислота. Определите содержимое каждой пробирки с помощью следующих реактивов: H2SO4 (конц.), NaOH (2 М), CuSO4 (1 М), фенолфталеин, метиловый оранжевый. Напишите уравнения соответствующих реакций. Сделайте вывод.
Самостоятельная работа
Тема 1.1. Основные понятия и законы
- Составить схему классификации неорганических веществ по лекции.
- Составить формулы оксида натрия, гидроксида меди (II), сульфата натрия.
- Рассчитать массовую долю фосфора в фосфорной кислоте.
- Определить относительно-молекулярную массу фосфата алюминия, нитрата натрия
Тема 1.2 Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома
- Подготовить презентации «Радиоактивность. Использование радиоактивных изотопов в технических целях. Рентгеновское излучение и его использование в технике и медицине. Моделирование как метод прогнозирования ситуации на производстве».
Тема 1.3. Строение вещества
- Определить вид связи в соединениях хлороводород, оксид натрия, серная кислота, нитрат натрия, метан.
- Подготовить презентацию для сообщения «Виды связи».
- Осуществить поиск фотографий в Интернет-ресурсах для создания атласа «Виды связи».
Тема 1.4. Вода Растворы. Электролитическая диссоциация
Подготовить презентации для сообщений «Растворение как физико-химический процесс. Тепловые эффекты при растворении. Кристаллогидраты. Решение задач на массовую долю растворенного вещества. Применение воды в технических целях. Жесткость воды и способы ее устранения. Минеральные воды».
Тема 1.5. Классификация неорганических соединений и их свойства
Подготовить презентации для сообщений «Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований. Взаимодействие солей с металлами. Взаимодействие солей друг с другом. Гидролиз солей различного типа»
Тема 1.6. Химические реакции
Подготовить сообщения «Понятие об электролизе. Электролиз расплавов. Электролиз растворов. Электролитическое получение алюминия. Практическое применение электролиза. Гальванопластика. Гальваностегия. Рафинирование цветных металлов. Катализ. Гомогенные и гетерогенные катализаторы. Промоторы. Каталитические яды. Ингибиторы. Производство аммиака: сырье, аппаратура, научные принципы».
Тема 1.7. Металлы и неметаллы
Подготовить презентации Взаимодействие металлов с неметаллами (железа, цинка и алюминия с серой, алюминия с йодом, сурьмы с хлором, горение железа в хлоре). Горение металлов. Алюминотермия. Горение неметаллов (серы, фосфора, угля). Вытеснение менее активных галогенов из растворов их солей более активными галогенами. Модель промышленной установки для производства серной кислоты. Модель печи для обжига известняка. Коллекции продукций силикатной промышленности (стекла, фарфора, фаянса, цемента различных марок и др.)».
Тема 2.1. Основные понятия органической химии и теория строения органических соединений
- Охарактеризовать научное и практическое значение теории строения А.М. Бутлерова.
- Написать все изомеры пентана, гептана, октана, нонана
Тема 2.2. Углеводороды и их природные источники
- Изготовить модели молекул алканов.
- Составить сокращённые структурные формулы и дать названия всех возможных изомеров гексана.
- Сравнить свойства метана и этана.
- Определить какой объём и какая масса хлора потребуются для получения 202 г. хлорметана.
- Используя интернет-источники, подготовить сообщение: «Научная биография В.В. Марковникова».
- Сравнить свойства пропана и циклопропана.
- Установить генетическую связь циклопарафинов с другими классами органических соединений.
- Подготовить сообщение «ОАО «Сибнефть – Омский НПЗ» - получение циклопарафинов из нефти.
Тема 2.3. Кислородсодержащие органические соединения
- Показать генетическую связь фенолов с ароматическими углеводородами и циклопарафинами.
- Привести уравнения реакций, при помощи которых можно получить фенол.
- Составить схему классификации пластмасс.
4. Комплект контрольно-измерительных материалов для проведения промежуточной аттестации по учебной дисциплине
Контрольно-измерительные материалы предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины «Химия».
КИМ включают контрольные материалы для проведения итогового контроля промежуточной аттестации в форме дифференцированного зачёта.
4.1. Результаты освоения дисциплины, подлежащие проверке
| Освоенные умения | Усвоенные знания |
| Знать понятия, широко используемые на практике: основные металлы и сплавы, серная, соляная, азотная и уксусная кислоты, щелочи, аммиак, метан, этилен, ацетилен, бензол, стекло, цемент, минеральные удобрения, бензин, жиры, мыла, глюкоза, сахароза, крахмал, полимеры, клетчатка, искусственные волокна, каучуки, пластмассы; | Знание об основных понятиях химии как науки |
| Знать и применять основные теории химии: строения атома, химической связи, электролитической диссоциации. | Знание основных теорий органической и неорганической химии |
| Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: объяснения химических явлений происходящих в природе, быту, и на производстве; глобальных проблем, стоящих перед человечеством (сохранение озонового слоя, парниковый эффект, энергетические и сырьевые проблемы) | Знание о практической направленности химии |
| Выполнять химические эксперименты по получению и распознаванию важнейших неорганических и органических веществ | Знание о способах химических экспериментов |
| Характеризовать: s- и p-элементы по их положению в периодической системе элементов; общие химические свойства металлов и неметаллов и их важнейших соединений | Знание о методах научного познания. |
| | |
Форма дифференцированного зачета: тестовые задания
Условия выполнения задания
1. Место (время) выполнения задания: учебная аудитория БОУ СПО «ОТСЛХ».
2. Максимальное время выполнения задания: 180 минут.
3. Источники информации, разрешенные к использованию на экзамене, оборудование: Таблицы «Периодическая система химических элементов Д.И. Менделеева», «Электрохимический ряд напряжений металлов», «Растворимость солей, кислот и оснований
Задания для дифференцированного зачета
Тематика вопросов теста:
1. Периодический закон и Периодическая система химических элементов Д.И. Менделеева (6 вопросов)
1. Атомы химических элементов четвертого периода
имеют одинаковое число:
1) электронов на внешнем энергетическом уровне;
2) нейтронов;
3) энергетических уровней;
4) протонов.
2. Строение атомов элементов IIа группы сходно по:
1) числу электронов в атоме;
2) числу электронов на внешнем слое;
3) числу энергетических уровней на электронной оболочке;
4) радиусам атомов.
3. Наименьший радиус имеет атом:
1)фтора; 2) бериллия; 3) бария; 4) кремния
4. Атому с наибольшим радиусом соответствует лектронная конфигурация
1) 1s22s 22p63s23p1;
2) 1s22s22p4;
3) 1s22s22p63s23p5;
4) 1s22s22p2.
5.Элемент, имеющий электронную конфигурацию 1s22s22p63s23p64s2, в периодической системе находится в:
1) 3-м периоде, VIIIб группе;
2) 4-м периоде, IIа группе;
3) 4-м периоде, IIв группе;
4) 3-м периоде, VIIIа группе.
6. Атом хрома имеет электронную конфигурацию:
1) 1s22s22p4;
2) 1s22s22p63s23p63d 54s1;
3) 1s22s22p63s23p6;
4) 1s22s22p63s23p4.
Ответы: 3,2,1,1,2,2.
2. Вода. Растворы. Электролитическая диссоциация (12 вопросов)
1. Вещества, которые при диссоциации образуют в качестве анионов только гидроксид-ионы, являются
А. кислотами Б. средними солями В. щелочами Г. кислыми солями
2 Формула сильного электролита
А. H2SO3 Б. CaCO3 В. HNO3 Г. Cu(OH)2
3 Сокращенное ионное уравнение реакции Al3+ + 3OH– = Al(OH)3
соответствует взаимодействию
А. хлорида алюминия с водой
Б. алюминия с водой
В. хлорида алюминия со щелочью
Г. алюминия со щелочью.
4 Сумма коэффициентов перед формулами неэлектролитов в уравнении реакции Fe + 2HCl(р-р) = FeCl2 + H2↑
А. 2 Б. 3 В. 4 Г. 5
5 Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между растворами сульфата натрия и хлорида бария равны
А. 11 и 3 Б. 11 и 5 В. 9 и 3 Г. 9 и 5
6 Реакция ионного обмена идет до конца в результате выделения газа при взаимодействии:
А. Cu(OH)2 c H2SO4 Б. KOH c Zn(NO3)2
В. CaCO3 c HCl Г. Na2CO3 c CaCl2
7 С каким веществом реагирует нитрат меди согласно сокращенному уравнению реакции Cu2+ + S2- = CuS:
А.сероводородом; Б.сульфатом натрия; В.сульфитом натрия; Г.сульфидом натрия;
8 . К реакциям ионного обмена не относится реакция
А. Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3;
Б. KOH + HCl = KCl + H2O;
В. 2KMnO4 = K2MnO4 + MnO2 + O2 ;
Г. Li2SO3 + 2HNO3 = 2LiNO3 + H2O + SO2
9 Вещества, которые при диссоциации образуют в качестве катионов ионы водорода и металла, являются
А. кислотами Б. средними солями В. щелочами Г. кислыми солями
10 . Формула слабого электролита
А. H2SO3 Б. NaOH В. HNO3 Г. Ba(OH)2
11 Сокращенное ионное уравнение Ca2+ + CO32– CaCO3
соответствует взаимодействию
А. хлорида кальция и карбоната натрия
Б. сульфида кальция и углекислого газа
В. гидроксида кальция и углекислого газа
Г.фосфата кальция и карбоната калия
12 Лампочка прибора для испытания веществ на электропроводность загорится при погружении электродов в
А. сахар (крист.) Б. сахар (водн. р-р)
В. хлорид натрия (крист.) Г. хлорид натрия (водн. р-р)
Ответы: В,В,В,А,В,В,Г,В,Г,А,А,Г.
3. Классификация неорганических соединений и их свойства (12 вопросов)
1. К амфотерным оксидам относится
1. CuO
2. P2O5
3. Cr2O3
4. CrO3
2. Среди перечисленных веществ кислой солью является
1. гидрид магния;
2. гидрокарбонат натрия;
3. гидроксид кальция;
4. гидроксокарбонат меди.
3. Какой из элементов может образовать кислотный оксид?
1. Стронций
2. марганец
3. кальций
4. магний.
4. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1. водой и соляной кислотой;
2. кислородом и оксидом магния;
3. оксидом кальция и гидроксидом натрия;
4. водой и медью.
5. Гидроксид железа (III) образуется при действии растворов щелочей на:
1. оксид железа (II);
2. оксид железа (III);
3. растворы солей железа (II);
4. растворы солей железа (III).
6. Хлорид железа (II) реагирует с каждым из двух веществ:
1. MgO , HCl
2. Zn , AgNO3
3. HNO3, CO2
4. CaO, CO2.
7. В схеме превращений CaCO3 ? X1 ? X2 + NaCl веществом Х2 является
1. CaCO3
2. CaCl2
3. CaO
4. Ca(OH)2.
8. В схеме превращений FeCl3 ? X1 ? X2 ? Fe(OH)3 веществами Х1 и Х2 могут быть соответственно
1. Fe2(SO4)3, Fe2O3
2. FePO4, Fe3O4
3. Fe(NO3)3, Fe2O3
4. Fe(OH)3, Fe2(SO4)3.
9. Установите соответствие между формулой вещества и его принад¬лежностью к определенному классу
Формула вещества Класс неорганических соединений
A) H3AsO4
Б) BeO
В) Ca(OH)Cl
Г) SO3
1) кислота
2) основание
3) основный оксид
4) амфотерный оксид
5) кислотный оксид
6) соль
10 Формулы только основных солей указаны в ряду
1. KHCO3, Na2Cr2O7, (CuOH)2SO4;
2. CuCl2, NaHSO3, (AlOH)Cl2;
3. Ca(HCO3)2, ZnS, (FeOH)Cl;
4. (FeOH)NO3, (CuOH)2CO3, MgOHCl.
11. Оксид углерода (IV) реагирует с каждым из двух веществ:
1. водой и оксидом кальция;
2. кислородом и оксидом серы (IV);
3. сульфатом калия и гидроксидом натрия;
4. фосфорной кислотой и водородом.
12. При прокаливании Cr(OH)3 образуется вода и
1. оксид хрома (II);
2. оксид хрома (III);
3. оксид хрома (VI);
4. хром.
Ответы: 3,2,2,3,4,2,1,4,1465,4,1,2
4. Химические реакции (12 вопросов)
1. Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Концентрации реагирующих веществ.
Г. Форма сосуда, в котором протекает реакция.
2. Фактор, влияющий на смещение химического равновесия:
A. Вид химической связи.
Б. Катализатор.
B. Природа реагирующих веществ.
Г. Температура.
3. При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза. В. В 8 раз.
Б. В 4 раза. Г. В 16 раз.
4. С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(г) + Н2О(г) ↔ С2Н5ОН(г)
A.He изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
5.(4 балла) Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + 02 ↔ 2SO3 + Q,в сторону исходных веществ необходимо:
A. Увеличить давление.
Б. Повысить температуру.
B. Понизить температуру.
Г. Применить катализатор.
6. Повышение температуры смещает химическое равновесие вправо (→) в обратимой реакции, уравнение которой:
А. 2Н2 + О2 ↔ 2Н 2О + Q
Б. SO2 + H2O ↔ H2SO3 + Q
В. 2NO + O2 ↔ 2NO2 + Q
Г. C4Н10 ↔ С4Н8 + Н2 – Q
7. Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Способ получения реагентов.
Г. Температура.
8. Фактор, не влияющий на смещение химического равновесия:
A. Давление.
Б. Концентрация реагирующих веществ.
B. Температура.
Г. Природа реагирующих веществ.
9. Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ =2) надо повысить температуру:
А. На З0°С. В.На 50°С.
Б. На 40 °С. Г. На 60 °С.
10. С увеличением концентрации SO2 равновесие обратимой химической реакции,
уравнение которой 2SO2 + О2 ↔2SO3 + Q:
A. Не изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
11. Для смещения химического равновесия обратимой реакции, уравнение которой
N2 + ЗН2 ↔ 2NH3 + Q,в сторону продуктов реакции необходимо:
A. Увеличить концентрацию NH3.
Б. Понизить температуру.
B. Применить катализатор.
12. Понижение давления смещает химическое равновесие вправо (→) в реакции, уравнение которой:
А. СН4 + Н2О ↔ 3Н2 + СО,
Б. СО2 + Н2О ↔ Н2СО3,
В. 3Н2 + N2 ↔ 2NH3 ,
Г. 2СО + О2 ↔ СО2.
Ответы: Г,Г,А,Б,Б,Г,В,Г,В,Б,Б,А.
5. Металлы и неметаллы (11 вопросов).
1. Среди галогенов – простых веществ - твердым является
1. фтор
2. хлор
3. бром
4. иод.
2. О фторе нельзя сказать, что он
1. самый активный;
2. самый электроотрицательный;
3. самый агрессивный;
4. самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
1. фтора
2. хлора
3. брома
4. иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
1. фтор
2. хлор
3. бром
4. иод.
5. Степень окисления хлора в соединении Са (ОСl)2
1. -1
2. +1
3. +3
4. +5
6. Сила галогеноводородных кислот возрастает в ряду
1. НСl, НВr, НI;
2. НI, НВr, НСl;
3. НВr, НI, НСl;
4. НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
1. белого цвета;
2. желтоватого цвета;
3. желтого цвета;
4. оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
1. 16,8 г
2. 33,6 г
3. 48,8 г
4. 97,7 г
9. Среди галогенов – простых веществ - жидким является
1. фтор
2. хлор
3. бром
4. иод.
10. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде
1. ns2np2
2. ns2np3
3. ns2np4
4. ns2np5.
11. Наиболее ярко выражены окислительные свойства у
1. фтора
2. хлора
3. брома
4. иода.
Ответы: 4,4,4,2,2,1,2,1,3,4,1.
6.Основные понятия органической химии и теория строения органических соединений (7 вопросов).
1. Вещества, имеющие формулы СН3 – О – СН3 и СН3 – СН2 – ОН, являются
1) гомологами; 2) изомерами;
3) полимерами; 4) пептидами.
2. Углеводород, в молекуле которого атомы углерода имеют sp3 гибридизацию
1) бутен-1; 2) бутан; 3) бутадиен-1,2; 4) бутин-1.
3. Продуктом гидратации этилена является: 1 спирт; 2 кислота;
3 альдегид; 4.алкан.
4. Только в одну стадию может протекать гидрирование этого углеводорода:
1) бутадиен-1,3; 2) бутен-1; 3) бензол; 4) бутин-2.
5. Количество атомов водорода в циклогексане:
1) 12; 2) 8; 3) 10; 4) 14.
6. Реакция среды в водном растворе глицина: 1 нейтральная; 2 кислая; 3 соленая; 4 щелочная.
7. В промышленности ароматические углеводороды получают из… 1) природного газа; 2) нефти; 3) остатков горных пород; 4) торфа.
Ответы: 2,2,1,2,1,1,2.
7. Кислородсодержащие органические соединения (22 вопроса).
1. К классу предельных альдегидов принадлежит вещество состава
1) СnH2n-2O 2) СnH2n+2O 3) СnH2nO 4) СnH2nO2
2. Вещество состава С2Н4О может быть
1) спиртом 2) альдегидом
3) кетоном 4) простым эфиром
3. Вещество, структура которого СН3─С═СН─СН2─СН═О, называется
│
СН3
1) 2-метил-5-оксопентен-2
2) 2-метилпентен-2-аль-5
3) 5-метилгексен-4-аль
4) 4-метилпентен-3-аль
4. Гомологом бутаналя является
1) пропаналь 2) бутанон 3) бутанол-1 4) бутан
5. Изомером бутаналя не является
1) бутен-2-ол-1 2) бутанон
3) циклобутанол 4) диэтиловый эфир
6. Для пропаналя характерна изомерия
1) углеродного скелета 2) геометрическая
3) межклассовая 4) оптическая
7. Среди утверждений:
А. В карбонильной группе альдегидов электронная плотность связи смещена к атому углерода.
Б. В молекулах альдегидов есть непрочная π-связь, ¬−
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
8. Температура кипения этаналя ниже, чем у этанола, потому что
1) у этанола выше молекулярная масса
2) в молекуле этанола нет непрочной π-связи
3) в молекуле этаналя меньше атомов водорода
4) между молекулами этаналя не образуются водородные связи
9. Число σ-связей в молекуле ацетальдегида равно
1) 2 2) 3 3) 5 4) 6
10. Для формальдегида не характерны реакции
1) присоединения 2) замещения
3) окисления 4) восстановления
11. При нагревании ацетальдегида со свежеосаждённым гидроксидом меди(II) наблюдается
1) появление жёлтого, а затем красного осадка
2) превращение голубого осадка гидроксида меди(II) в чёрный
3) растворение осадка и образование голубого раствора
4) растворение осадка и образование васильково-синего раствора
12. Образование «серебряного зеркала» в реакции с аммиачным раствором оксида серебра доказывает, что в молекуле вещества содержится
1) карбоксильная группа
2) двойная связь между атомами С и О
3) карбонильная группа на конце молекулы
4) атом углерода в sp2-гибридном состоянии
13. При окислении пропаналя образуется
1) пропан 2) пропанол-1
3) пропановая кислота 4) пропанол-2
14. С помощью аммиачного раствора оксида серебра можно различить растворы
1) метанола и этанола
2) этанола и этаналя
3) ацетальдегида и формальдегида
4) глицерина и этиленгликоля
15. С гидроксидом меди(II) реагируют оба вещества
1) глицерин и пропаналь
2) ацетальдегид и этанол
3) этанол и фенол
4) фенол и формальдегид
16. При восстановлении бутаналя получается
1) бутанол-1 2) бутановая кислота
3) бутанол-2 4) дибутиловый эфир
17. Среди утверждений:
А. Альдегиды проявляют слабые кислотные свойства.
Б. Альдегиды, в отличие от кетонов, легко окисляются, −
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
18. В цепи превращений СН3─СН2─ОН →Х → СН3─СООН веществом Х является
1) СН≡СН 2) СН2═СН2
3) СН3─СН2Cl 4) СН3─СН═О
19. В цепи превращений Х - СН3─СН═О - Y
веществами Х и Y соответственно являются
1) этилен и этанол 2) этанол и уксусная кислота
3) ацетилен и этанол 3) ацетилен и уксусная кислота
20. Формальдегид можно получить
1) крекингом метана 2) гидратацией ацетилена
3) окислением метанола 4) гидролизом хлорметана
21. Ацетальдегид не образуется при
1) гидратации ацетилена
2) дегидрировании уксусной кислоты
3) каталитическом окислении этилена
4) каталитическом дегидрировании этанола
22. Гидратацией алкина может быть получен
1) формальдегид 2) ацетальдегид
3) пропионовый альдегид 4) масляный альдегид
Ответы:3,2,4,1,4,3,2,4,4,2,1,3,3,2,1,1,2,4,3,3,2,2
10. Азотсодержащие органические соединения. Полимеры (7 вопросов).
1. Аминокислоты могут взаимодействовать с
кислотами;
щелочами;
кислотами и щелочами;
ни с кислотами, ни с щелочами.
2. Белковые молекулы из аминокислот образуются по реакции
полимеризации;
сополимеризации;
поликонденсации;
сополиконденсации.
3. Раствор аминокислоты глицин NH2-CH2-COOH имеет реакцию среды
кислую;
слабокислую;
щелочную;
нейтральную.
4. При гидролизе белков нарушается структура белка
первичная;
вторичная;
третичная;
все структуры.
5. Реакция среды водного раствора метиламина
кислая;
слабокислая;
нейтральная;
щелочная.
6. С метиламином не взаимодействует
вода;
гидроксид калия;
серная кислота;
кислород.
7. Сколько различных дипептидов может быть получено из глицина и аланина?
один;
два;
три;
четыре.
Ответы: 3,4,4,4,4,2,,4,
Критерии оценивания заданий
«5»: 80%-100% от максимальной суммы баллов
«4»: 60-80% от максимальной суммы баллов
«3»: 40-60% от максимальной суммы баллов
«2»: 0-40% от максимальной суммы баллов
За каждое правильно выполненное задание – 1 балл.
Министерство образования Омской области
бюджетное профессиональное образовательное учреждение Омской области
«Омский техникум строительства и лесного хозяйства»
Утверждаю
зам.директора БПОУ «ОТСЛХ»
______________ С.Г. Бурлачёнок
«___»_______2018 г.
Комплект
контрольно-измерительных материалов
по учебной дисциплине «Химия»
для проведения промежуточной аттестации
в рамках программы подготовки квалифицированных рабочих служащих (ППКРС)
по профессиям:
08.01.24 «Мастер столярно-плотничных, паркетных и стекольных работ»
23.01.07 «Машинист крана (крановщик)»
15.01.05 «Сварщик (электросварщик ручной и частично механизированной сварки (наплавки))»
Омск 2018
Организация –разработчик : бюджетное профессиональное образовательное учреждение Омской области «Омский техникум строительства и лесного хозяйства» (БПОУ «ОТСЛХ»)
Разработчики:
преподаватель химии и биологии Ваганова Н.М.
Рассмотрено и рекомендовано Методическим объединением преподавателей
_________________________________________________________________________
Протокол № __ от « » августа 2018 г.
Председатель МО _____________/ Рыбель Л.А./
1. Паспорт контрольно-измерительных материалов учебной дисциплины «Химия»
Контрольно-измерительные материалы предназначены для проверки результатов освоения учебной дисциплины «Химия»
в рамках программы подготовки квалифицированных рабочих служащих (ППКРС)
по профессиям:
08.01.24 «Мастер столярно-плотничных, паркетных и стекольных работ»
23.01.07 «Машинист крана (крановщик)»
15.01.05 «Сварщик (электросварщик ручной и частично механизированной сварки (наплавки))»
Освоение содержания учебной дисциплины «Химия» должно обеспечить достижение обучающимися следующих результатов:
личностные результаты:
- чувство гордости уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
- готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
- умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности
метапредметные результаты:
- использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться а профессиональной сфере;
- использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
предметные результаты:
-сформированностьпредставлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозораи функциональной грамотности человека для решения практических задач;
- владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
- владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
-сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
-владение правилами техники безопасности при использовании химических веществ;
- сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Формой проведения промежуточной аттестации по учебной дисциплине «Химия » является дифференцирующий зачёт
Комплект контрольно-измерительных материалов для проведения промежуточной аттестации по учебной дисциплине
Контрольно-измерительные материалы предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины «Химия».
Результаты освоения дисциплины, подлежащие проверке
| Освоенные умения | Усвоенные знания |
| Знать понятия, широко используемые на практике: основные металлы и сплавы, серная, соляная, азотная и уксусная кислоты, щелочи, аммиак, метан, этилен, ацетилен, бензол, стекло, цемент, минеральные удобрения, бензин, жиры, мыла, глюкоза, сахароза, крахмал, полимеры, клетчатка, искусственные волокна, каучуки, пластмассы; | Знание об основных понятиях химии как науки |
| Знать и применять основные теории химии: строения атома, химической связи, электролитической диссоциации. | Знание основных теорий органической и неорганической химии |
| Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: объяснения химических явлений происходящих в природе, быту, и на производстве; глобальных проблем, стоящих перед человечеством (сохранение озонового слоя, парниковый эффект, энергетические и сырьевые проблемы) | Знание о практической направленности химии |
| Выполнять химические эксперименты по получению и распознаванию важнейших неорганических и органических веществ | Знание о способах химических экспериментов |
| Характеризовать: s- и p-элементы по их положению в периодической системе элементов; общие химические свойства металлов и неметаллов и их важнейших соединений | Знание о методах научного познания. |
| | |
Форма дифференцированного зачета: тестовые задания
Условия выполнения задания
1. Место (время) выполнения задания: учебная аудитория БОУ СПО «ОТСЛХ».
2. Максимальное время выполнения задания: 160 минут.
3. Источники информации, разрешенные к использованию на экзамене, оборудование: Таблицы «Периодическая система химических элементов Д.И. Менделеева», «Электрохимический ряд напряжений металлов», «Растворимость солей, кислот и оснований.
Задания для дифференцированного зачета
Тематика вопросов теста:
1. Периодический закон и Периодическая система химических элементов Д.И. Менделеева (6 вопросов)
1. Атомы химических элементов четвертого периода
имеют одинаковое число:
1) электронов на внешнем энергетическом уровне;
2) нейтронов;
3) энергетических уровней;
4) протонов.
2. Строение атомов элементов IIа группы сходно по:
1) числу электронов в атоме;
2) числу электронов на внешнем слое;
3) числу энергетических уровней на электронной оболочке;
4) радиусам атомов.
3. Наименьший радиус имеет атом:
1)фтора; 2) бериллия; 3) бария; 4) кремния
4. Атому с наибольшим радиусом соответствует лектронная конфигурация
1) 1s22s 22p63s23p1;
2) 1s22s22p4;
3) 1s22s22p63s23p5;
4) 1s22s22p2.
5.Элемент, имеющий электронную конфигурацию 1s22s22p63s23p64s2, в периодической системе находится в:
1) 3-м периоде, VIIIб группе;
2) 4-м периоде, IIа группе;
3) 4-м периоде, IIв группе;
4) 3-м периоде, VIIIа группе.
6. Атом хрома имеет электронную конфигурацию:
1) 1s22s22p4;
2) 1s22s22p63s23p63d 54s1;
3) 1s22s22p63s23p6;
4) 1s22s22p63s23p4.
Ответы: 3,2,1,1,2,2.
2. Вода. Растворы. Электролитическая диссоциация (12 вопросов)
1. Вещества, которые при диссоциации образуют в качестве анионов только гидроксид-ионы, являются
А. кислотами Б. средними солями В. щелочами Г. кислыми солями
2 Формула сильного электролита
А. H2SO3 Б. CaCO3 В. HNO3 Г. Cu(OH)2
3 Сокращенное ионное уравнение реакции Al3+ + 3OH– = Al(OH)3
соответствует взаимодействию
А. хлорида алюминия с водой
Б. алюминия с водой
В. хлорида алюминия со щелочью
Г. алюминия со щелочью.
4 Сумма коэффициентов перед формулами неэлектролитов в уравнении реакции Fe + 2HCl(р-р) = FeCl2 + H2↑
А. 2 Б. 3 В. 4 Г. 5
5 Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между растворами сульфата натрия и хлорида бария равны
А. 11 и 3 Б. 11 и 5 В. 9 и 3 Г. 9 и 5
6 Реакция ионного обмена идет до конца в результате выделения газа при взаимодействии:
А. Cu(OH)2 c H2SO4 Б. KOH c Zn(NO3)2
В. CaCO3 c HCl Г. Na2CO3 c CaCl2
7 С каким веществом реагирует нитрат меди согласно сокращенному уравнению реакции Cu2+ + S2- = CuS:
А.сероводородом; Б.сульфатом натрия; В.сульфитом натрия; Г.сульфидом натрия;
8 . К реакциям ионного обмена не относится реакция
А. Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3;
Б. KOH + HCl = KCl + H2O;
В. 2KMnO4 = K2MnO4 + MnO2 + O2 ;
Г. Li2SO3 + 2HNO3 = 2LiNO3 + H2O + SO2
9 Вещества, которые при диссоциации образуют в качестве катионов ионы водорода и металла, являются
А. кислотами Б. средними солями В. щелочами Г. кислыми солями
10 . Формула слабого электролита
А. H2SO3 Б. NaOH В. HNO3 Г. Ba(OH)2
11 Сокращенное ионное уравнение Ca2+ + CO32– CaCO3
соответствует взаимодействию
А. хлорида кальция и карбоната натрия
Б. сульфида кальция и углекислого газа
В. гидроксида кальция и углекислого газа
Г.фосфата кальция и карбоната калия
12 Лампочка прибора для испытания веществ на электропроводность загорится при погружении электродов в
А. сахар (крист.) Б. сахар (водн. р-р)
В. хлорид натрия (крист.) Г. хлорид натрия (водн. р-р)
Ответы: В,В,В,А,В,В,Г,В,Г,А,А,Г.
3. Классификация неорганических соединений и их свойства (12 вопросов)
1. К амфотерным оксидам относится
1. CuO
2. P2O5
3. Cr2O3
4. CrO3
2. Среди перечисленных веществ кислой солью является
1. гидрид магния;
2. гидрокарбонат натрия;
3. гидроксид кальция;
4. гидроксокарбонат меди.
3. Какой из элементов может образовать кислотный оксид?
1. Стронций
2. марганец
3. кальций
4. магний.
4. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1. водой и соляной кислотой;
2. кислородом и оксидом магния;
3. оксидом кальция и гидроксидом натрия;
4. водой и медью.
5. Гидроксид железа (III) образуется при действии растворов щелочей на:
1. оксид железа (II);
2. оксид железа (III);
3. растворы солей железа (II);
4. растворы солей железа (III).
6. Хлорид железа (II) реагирует с каждым из двух веществ:
1. MgO , HCl
2. Zn , AgNO3
3. HNO3, CO2
4. CaO, CO2.
7. В схеме превращений CaCO3 ? X1 ? X2 + NaCl веществом Х2 является
1. CaCO3
2. CaCl2
3. CaO
4. Ca(OH)2.
8. В схеме превращений FeCl3 ? X1 ? X2 ? Fe(OH)3 веществами Х1 и Х2 могут быть соответственно
1. Fe2(SO4)3, Fe2O3
2. FePO4, Fe3O4
3. Fe(NO3)3, Fe2O3
4. Fe(OH)3, Fe2(SO4)3.
9. Установите соответствие между формулой вещества и его принадлежностью к определенному классу
Формула вещества Класс неорганических соединений
A) H3AsO4
Б) BeO
В) Ca(OH)Cl
Г) SO3
1) кислота
2) основание
3) основный оксид
4) амфотерный оксид
5) кислотный оксид
6) соль
10 Формулы только основных солей указаны в ряду
1. KHCO3, Na2Cr2O7, (CuOH)2SO4;
2. CuCl2, NaHSO3, (AlOH)Cl2;
3. Ca(HCO3)2, ZnS, (FeOH)Cl;
4. (FeOH)NO3, (CuOH)2CO3, MgOHCl.
11. Оксид углерода (IV) реагирует с каждым из двух веществ:
1. водой и оксидом кальция;
2. кислородом и оксидом серы (IV);
3. сульфатом калия и гидроксидом натрия;
4. фосфорной кислотой и водородом.
12. При прокаливании Cr(OH)3 образуется вода и
1. оксид хрома (II);
2. оксид хрома (III);
3. оксид хрома (VI);
4. хром.
Ответы: 3,2,2,3,4,2,1,4,1465,4,1,2
4. Химические реакции (12 вопросов)
1. Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Концентрации реагирующих веществ.
Г. Форма сосуда, в котором протекает реакция.
2. Фактор, влияющий на смещение химического равновесия:
A. Вид химической связи.
Б. Катализатор.
B. Природа реагирующих веществ.
Г. Температура.
3. При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза. В. В 8 раз.
Б. В 4 раза. Г. В 16 раз.
4. С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(г) + Н2О(г) ↔ С2Н5ОН(г)
A.He изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
5.(4 балла) Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + 02 ↔ 2SO3 + Q,в сторону исходных веществ необходимо:
A. Увеличить давление.
Б. Повысить температуру.
B. Понизить температуру.
Г. Применить катализатор.
6. Повышение температуры смещает химическое равновесие вправо (→) в обратимой реакции, уравнение которой:
А. 2Н2 + О2 ↔ 2Н 2О + Q
Б. SO2 + H2O ↔ H2SO3 + Q
В. 2NO + O2 ↔ 2NO2 + Q
Г. C4Н10 ↔ С4Н8 + Н2 – Q
7. Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Способ получения реагентов.
Г. Температура.
8. Фактор, не влияющий на смещение химического равновесия:
A. Давление.
Б. Концентрация реагирующих веществ.
B. Температура.
Г. Природа реагирующих веществ.
9. Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ =2) надо повысить температуру:
А. На З0°С. В.На 50°С.
Б. На 40 °С. Г. На 60 °С.
10. С увеличением концентрации SO2 равновесие обратимой химической реакции,
уравнение которой 2SO2 + О2 ↔2SO3 + Q:
A. Не изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
11. Для смещения химического равновесия обратимой реакции, уравнение которой
N2 + ЗН2 ↔ 2NH3 + Q,в сторону продуктов реакции необходимо:
A. Увеличить концентрацию NH3.
Б. Понизить температуру.
B. Применить катализатор.
12. Понижение давления смещает химическое равновесие вправо (→) в реакции, уравнение которой:
А. СН4 + Н2О ↔ 3Н2 + СО,
Б. СО2 + Н2О ↔ Н2СО3,
В. 3Н2 + N2 ↔ 2NH3 ,
Г. 2СО + О2 ↔ СО2.
Ответы: Г,Г,А,Б,Б,Г,В,Г,В,Б,Б,А.
5. Металлы и неметаллы (11 вопросов).
1. Среди галогенов – простых веществ - твердым является
1. фтор
2. хлор
3. бром
4. иод.
2. О фторе нельзя сказать, что он
1. самый активный;
2. самый электроотрицательный;
3. самый агрессивный;
4. самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
1. фтора
2. хлора
3. брома
4. иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
1. фтор
2. хлор
3. бром
4. иод.
5. Степень окисления хлора в соединении Са (ОСl)2
1. -1
2. +1
3. +3
4. +5
6. Сила галогеноводородных кислот возрастает в ряду
1. НСl, НВr, НI;
2. НI, НВr, НСl;
3. НВr, НI, НСl;
4. НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
1. белого цвета;
2. желтоватого цвета;
3. желтого цвета;
4. оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
1. 16,8 г
2. 33,6 г
3. 48,8 г
4. 97,7 г
9. Среди галогенов – простых веществ - жидким является
1. фтор
2. хлор
3. бром
4. иод.
10. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде
1. ns2np2
2. ns2np3
3. ns2np4
4. ns2np5.
11. Наиболее ярко выражены окислительные свойства у
1. фтора
2. хлора
3. брома
4. иода.
Ответы: 4,4,4,2,2,1,2,1,3,4,1.
6.Основные понятия органической химии и теория строения органических соединений (7 вопросов).
1. Вещества, имеющие формулы СН3 – О – СН3 и СН3 – СН2 – ОН, являются
1) гомологами; 2) изомерами;
3) полимерами; 4) пептидами.
2. Углеводород, в молекуле которого атомы углерода имеют sp3 гибридизацию
1) бутен-1; 2) бутан; 3) бутадиен-1,2; 4) бутин-1.
3. Продуктом гидратации этилена является: 1 спирт; 2 кислота;
3 альдегид; 4.алкан.
4. Только в одну стадию может протекать гидрирование этого углеводорода:
1) бутадиен-1,3; 2) бутен-1; 3) бензол; 4) бутин-2.
5. Количество атомов водорода в циклогексане:
1) 12; 2) 8; 3) 10; 4) 14.
6. Реакция среды в водном растворе глицина: 1 нейтральная; 2 кислая; 3 соленая; 4 щелочная.
7. В промышленности ароматические углеводороды получают из… 1) природного газа; 2) нефти; 3) остатков горных пород; 4) торфа.
Ответы: 2,2,1,2,1,1,2.
7. Кислородсодержащие органические соединения (22 вопроса).
1. К классу предельных альдегидов принадлежит вещество состава
1) СnH2n-2O 2) СnH2n+2O 3) СnH2nO 4) СnH2nO2
2. Вещество состава С2Н4О может быть
1) спиртом 2) альдегидом
3) кетоном 4) простым эфиром
3. Вещество, структура которого СН3─С═СН─СН2─СН═О, называется
│
СН3
1) 2-метил-5-оксопентен-2
2) 2-метилпентен-2-аль-5
3) 5-метилгексен-4-аль
4) 4-метилпентен-3-аль
4. Гомологом бутаналя является
1) пропаналь 2) бутанон 3) бутанол-1 4) бутан
5. Изомером бутаналя не является
1) бутен-2-ол-1 2) бутанон
3) циклобутанол 4) диэтиловый эфир
6. Для пропаналя характерна изомерия
1) углеродного скелета 2) геометрическая
3) межклассовая 4) оптическая
7. Среди утверждений:
А. В карбонильной группе альдегидов электронная плотность связи смещена к атому углерода.
Б. В молекулах альдегидов есть непрочная π-связь, ¬−
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
8. Температура кипения этаналя ниже, чем у этанола, потому что
1) у этанола выше молекулярная масса
2) в молекуле этанола нет непрочной π-связи
3) в молекуле этаналя меньше атомов водорода
4) между молекулами этаналя не образуются водородные связи
9. Число σ-связей в молекуле ацетальдегида равно
1) 2 2) 3 3) 5 4) 6
10. Для формальдегида не характерны реакции
1) присоединения 2) замещения
3) окисления 4) восстановления
11. При нагревании ацетальдегида со свежеосаждённым гидроксидом меди(II) наблюдается
1) появление жёлтого, а затем красного осадка
2) превращение голубого осадка гидроксида меди(II) в чёрный
3) растворение осадка и образование голубого раствора
4) растворение осадка и образование васильково-синего раствора
12. Образование «серебряного зеркала» в реакции с аммиачным раствором оксида серебра доказывает, что в молекуле вещества содержится
1) карбоксильная группа
2) двойная связь между атомами С и О
3) карбонильная группа на конце молекулы
4) атом углерода в sp2-гибридном состоянии
13. При окислении пропаналя образуется
1) пропан 2) пропанол-1
3) пропановая кислота 4) пропанол-2
14. С помощью аммиачного раствора оксида серебра можно различить растворы
1) метанола и этанола
2) этанола и этаналя
3) ацетальдегида и формальдегида
4) глицерина и этиленгликоля
15. С гидроксидом меди(II) реагируют оба вещества
1) глицерин и пропаналь
2) ацетальдегид и этанол
3) этанол и фенол
4) фенол и формальдегид
16. При восстановлении бутаналя получается
1) бутанол-1 2) бутановая кислота
3) бутанол-2 4) дибутиловый эфир
17. Среди утверждений:
А. Альдегиды проявляют слабые кислотные свойства.
Б. Альдегиды, в отличие от кетонов, легко окисляются, −
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
18. В цепи превращений СН3─СН2─ОН →Х → СН3─СООН веществом Х является
1) СН≡СН 2) СН2═СН2
3) СН3─СН2Cl 4) СН3─СН═О
19. В цепи превращений Х - СН3─СН═О - Y
веществами Х и Y соответственно являются
1) этилен и этанол 2) этанол и уксусная кислота
3) ацетилен и этанол 3) ацетилен и уксусная кислота
20. Формальдегид можно получить
1) крекингом метана 2) гидратацией ацетилена
3) окислением метанола 4) гидролизом хлорметана
21. Ацетальдегид не образуется при
1) гидратации ацетилена
2) дегидрировании уксусной кислоты
3) каталитическом окислении этилена
4) каталитическом дегидрировании этанола
22. Гидратацией алкина может быть получен
1) формальдегид 2) ацетальдегид
3) пропионовый альдегид 4) масляный альдегид
Ответы:3,2,4,1,4,3,2,4,4,2,1,3,3,2,1,1,2,4,3,3,2,2
10. Азотсодержащие органические соединения. Полимеры (7 вопросов).
1. Аминокислоты могут взаимодействовать с
кислотами;
щелочами;
кислотами и щелочами;
ни с кислотами, ни с щелочами.
2. Белковые молекулы из аминокислот образуются по реакции
полимеризации;
сополимеризации;
поликонденсации;
сополиконденсации.
3. Раствор аминокислоты глицин NH2-CH2-COOH имеет реакцию среды
кислую;
слабокислую;
щелочную;
нейтральную.
4. При гидролизе белков нарушается структура белка
первичная;
вторичная;
третичная;
все структуры.
5. Реакция среды водного раствора метиламина
кислая;
слабокислая;
нейтральная;
щелочная.
6. С метиламином не взаимодействует
вода;
гидроксид калия;
серная кислота;
кислород.
7. Сколько различных дипептидов может быть получено из глицина и аланина?
один;
два;
три;
четыре.
Ответы: 3,4,4,4,4,2,,4,
Критерии оценивания заданий
«5»: 80%-100% от максимальной суммы баллов
«4»: 60-80% от максимальной суммы баллов
«3»: 40-60% от максимальной суммы баллов
«2»: 0-40% от максимальной суммы баллов
За каждое правильно выполненное задание – 1 балл.
Задания для входного контроля:
1. Строение вещества (13 вопросов)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 Электронная формула внешнего энергетического уровня атома кремния
А. 3s23p2 Б. 3s23p4 В. 4s24p2 Г. 4s24p4
2 . Порядковый номер элемента в Периодической системе определяется:
A. Зарядом ядра атома.
Б. Числом электронов в наружном слое атома.
B. Числом электронных слоев в атоме.
Г. Числом нейтронов в атоме.
3 Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. Si и SiH4 Г. S и H2S
4 Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и Se. В. К и Са. Г. Мn и Fe.
5 s-Элементом является:
А. Барий. Б. Галлий. В. Америций. Г. Ванадий.
6 Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Sr—Rb—К. Б. Na—К—Са. В. Be—Li—К. Г. А1—Mg—Be.
7 Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А. Э2О. Б. Э2О3. В. ЭО2. Г. Э2О5.
8 Электронная формула атома фосфора
А. 1s22s2 2p3 Б. 1s22s22p63s23p3 В. 1s22s22p5 Г. 1s22s22p63s23p5
9 Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А. алюминия Б. азота В. фосфора Г. хлора
10 Электронная формула атома 1s22s22p63s23p3. Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. P и PH3 Г. S и H2S
11. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и P. В. К и Nа. Г. Мn и Fe.
12. s-Элементом является:
А. натрий. Б. фосфор. В. уран. Г. ванадий.
13. Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Mg—Ca—Zn. Б. Sr—Rb—К. В. А1—Mg—Са. Г. Ge—Si—Sb.
2. Классификация неорганических соединений и их свойства (12 вопросов)
1. К амфотерным оксидам относится
1.CuO 2.P2O3 3.Cr2O3 4.CrO3
2. Среди перечисленных веществ кислой солью является
1. гидрид магния; 2.гидрокарбонат натрия; 3.гидроксид кальция; 4.гидроксокарбонат меди.
3. Какой из элементов может образовать кислотный оксид?
1.стронций 2.марганец 3. кальций 4.магний
4. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1. водой и соляной кислотой;
2. кислородом и оксидом магния;
3. оксидом кальция и гидроксидом натрия;
4. водой и медью.
5. Гидроксид железа (III) образуется при действии растворов щелочей на:
1. оксид железа (II); 2. оксид железа (III); 3. растворы солей железа (II); 4. растворы солей железа (III).
6. Хлорид железа (II) реагирует с каждым из двух веществ:
1. MgO , HCl 2. Zn , AgNO3 3.HNO3, CO2 4.CaO, CO2.
7. В схеме превращений CaCO3 ? X1 ? X2 + NaCl веществом Х2 является
1. CaCO3 2.CaCl2 3.CaO 4. Ca(OH)2.
8. В схеме превращений FeCl3 ? X1 ? X2 ? Fe(OH)3 веществами Х1 и Х2 могут быть соответственно
1. Fe2(SO4)3, Fe2O3 2. FePO4, Fe3O4 3.Fe(NO3)3, Fe2O3 4.Fe(OH)3, Fe2(SO4)3.
9. Установите соответствие между формулой вещества и его принадлежностью к определенному классу
Формула вещества Класс неорганических соединений
A) H3AsO4
Б) BeO
В) Ca(OH)Cl
Г) SO3
1) кислота
2) основание
3) основный оксид
4) амфотерный оксид
5) кислотный оксид
6) соль
10. Формулы только основных солей указаны в ряду
1. KHCO3, Na2Cr2O7, (CuOH)2SO4;
2. CuCl2, NaHSO3, (AlOH) Cl2;
3. Ca(HCO3)2, ZnS, (FeOH)Cl;
4. (FeOH)NO3, (CuOH)2CO3, MgOHCl.
11. Оксид углерода (IV) реагирует с каждым из двух веществ:
1. водой и оксидом кальция;
2. кислородом и оксидом серы (IV);
3. сульфатом калия и гидроксидом натрия;
4. фосфорной кислотой и водородом.
12. При прокаливании Cr(OH)3 образуется вода и
1.оксид хрома (II); 2.оксид хрома (III); 3.оксид хрома (VI); 4.хром.
3. Химические реакции (12 вопросов)
1. Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Концентрации реагирующих веществ.
Г. Форма сосуда, в котором протекает реакция.
2. Фактор, влияющий на смещение химического равновесия:
A. Вид химической связи.
Б. Катализатор.
B. Природа реагирующих веществ.
Г. Температура.
3. При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза. В. В 8 раз.
Б. В 4 раза. Г. В 16 раз.
4. С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(г) + Н2О(г) ↔ С2Н5ОН(г)
A.He изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
5. Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + 02 ↔ 2SO3 + Q,в сторону исходных веществ необходимо:
A. Увеличить давление.
Б. Повысить температуру.
B. Понизить температуру.
Г. Применить катализатор.
6. Повышение температуры смещает химическое равновесие вправо (→) в обратимой реакции, уравнение которой:
А. 2Н2 + О2 ↔ 2Н 2О + Q
Б. SO2 + H2O ↔ H2SO3 + Q
В. 2NO + O2 ↔ 2NO2 + Q
Г. C4Н10 ↔ С4Н8 + Н2 – Q
7 Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Способ получения реагентов.
Г. Температура.
8 Фактор, не влияющий на смещение химического равновесия:
A. Давление.
Б. Концентрация реагирующих веществ.
B. Температура.
Г. Природа реагирующих веществ.
9.Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ =2) надо повысить температуру:
А. НаЗ0°С. В.На50°С.
Б. На 40 °С. Г. На 60 °С.
10 С увеличением концентрации SO2 равновесие обратимой химической реакции,
уравнение которой 2SO2 + О2 ↔2SO3 + Q:
A. Не изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.


 омер пробирки
омер пробирки









