| № | Этап урока | Деятельность учителя | Деятельность учеников | Дидактические материалы и средства |
| 1 | Мотивационный этап | Приглашает детей к участию в игре «Конкурс знатоков щелочных металлов», | Рассаживаются по командам, готовятся к совместной деятельности: выбирают капитана, название команды, распределяют роли, изучают лист ответов | Слайд № 1 |
| 2 | Этап подготовки учащихся к активному усвоению знаний | Сообщает цель урока, шкалу оценивания. | Готовятся к активной работе в команде. |
|
| 3 | Этап обобщения и систематизации | С помощью презентации демонстрирует вопросы по теме обобщения, вводит ограничение по времени для ответов на вопросы, в зависимости от сложности | Заполняют листы ответов, работая в командах. |
|
| Вопрос № 1 Этот металл был открыт шведским химиком Й. Арфведсоном в 1817 г. По предложению Й.Берцелиуса назван так (от греч. – камень). | Слайд № 2 |
| Вопрос № 2 Этот английский ученый (химик и физик) впервые получил натрий и калий в 1807г при электролизе едких щелочей. | Слайд № 3 |
| Вопрос № 3 Й. Берцелиус предложил назвать один новый элемент _ _ _ _ _ _ _ (от араб. – сода), а второй элемент по предложению Гильберта назван _ _ _ _ _ _ (от араб.– щелочь). | Слайд № 4 |
| Вопрос № 4 Этот элемент был открыт по характерным линиям в длинноволновой области спектра в 1861г. немецкими учёными Р. Бунзеном и Г. Киргофом. Цвет этих линий определил и название элемента. По латыни - тёмно-красный. В 1863г. Бунзен получил его в чистом виде. | Слайд № 5 |
| Вопрос № 5 Этот элемент был первым элементом, открытым с помощью метода спектрального анализа.
В 1860 г Р. Бунзен и
Г. Киргоф по ярко-синим линиям в спектре обнаружили в воде минеральных источников в Боварии новый химический элемент. Название элемента происходит от лат. слова - «небесно-голубой». | Слайд № 6 |
| Вопрос № 6 Этот элемент был открыт в 1939г француженкой М. Перей. Она доказала, что этот элемент является продуктом распада актиния. Это радиоактивный элемент. Период его полураспада 22 минуты. В начале 50-х годов ХХ века удалось получить его искусственно. | Слайд № 7 |
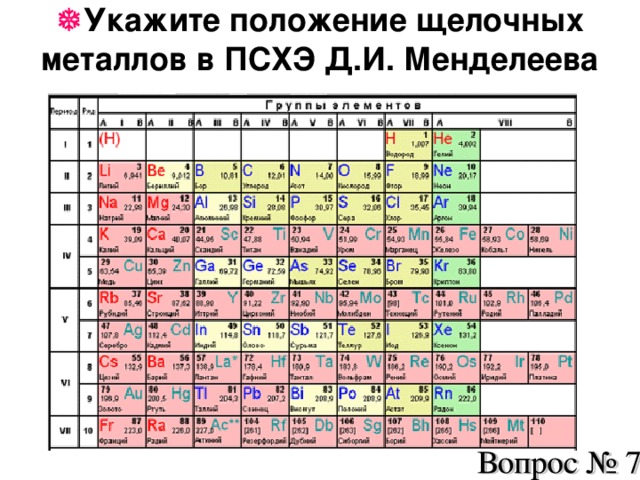
| Вопрос № 7 Укажите положение щелочных металлов в ПСХЭ Д.И. Менделеева | Слайд № 8 |
| Вопрос № 8 Чему равна максимальная степень окисления щелочных металлов в соединениях | Слайд № 9 |
| Вопрос № 9 Как изменяется радиус и восстановительные свойства в подгруппе щелочных металлов | Слайд № 10 |
| Вопрос № 10 С кислородом натрий и калий образуют не оксиды, а эти соединения. Запишите уравнение реакции горения калия. | Слайд № 11 |
| Вопрос № 11 Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Как называются продукты их взаимодействия с Водородом; Хлором; Серой? | Слайд № 12 Взаимодействие калия с хлором и натрия с серой |
| Вопрос № 12 Запишите уравнение реакции взаимодействия рубидия с водой | Слайд № 13 |
| Вопрос № 13 Запишите уравнение реакции взаимодействия пероксида натрия с металлическим натрием | Слайд № 14 |
| Вопрос № 14 История открытия кислорода интересно переплетается с историей появления подводных лодок. Есть сведения, что кислород был открыт еще в XVII веке голландским ученым К. Дреббелем. Он использовал этот газ для дыхания в подводной лодке собственной конструкции. Попробуйте записать уравнение реакции получения кислорода на подводной лодке из углекислого газа и пероксида натрия. | Слайд № 15 |
| Вопрос № 15 Запишите уравнения химических реакций взаимодействия гидроксида натрия: С углекислым газом; С соляной кислотой; С сульфатом меди.
| Слайд № 16 Взаимодействие раствора гидроксида натрия с соляной кислотой, Взаимодействие раствора гидроксида натрия с сульфатом меди. |
| Вопрос № 16 Приведите другое название гидроксида калия. | Слайд № 17 |
| Вопрос № 17 Приведите другие названия гидроксида натрия | Слайд № 18 |
| Вопрос № 18 Запишите формула кристаллической соды | Слайд № 19 |
| Вопрос № 19 Запишите формулу глауберовой соли | Слайд № 20 |
| Вопрос № 20 Запишите формулу пищевой соли | Слайд № 21 |
| Вопрос № 21 Запишите формулу каустической соды | Слайд № 22 |
| Вопрос № 22 Запишите формулу пищевой соды | Слайд № 23 |
| Вопрос № 23 Запишите формулу поташа | Слайд № 24 |
| Вопрос № 24 В какие цвета окрашивают пламя натрий и калий? | Слайд № 25 |
| Вопрос № 25 Решите задачу: Объем водорода, выделившийся при взаимодействии с водой лития массой 28 г, равен _____ л | Слайд № 26 |
| 4 | Этап оценивания и подведения итогов | Организует взаимооценивание команд, раздав ключи к вопросам | По разбалловке, предложенной учителем оценивают лист ответа другой команды. |
|
| 5 | Рефлексия |
| Оценивание урока смайликами(конверт на столах) |
|
| 6 | Этап информации о домашнем задании | выполнить упражнения № 3 – 5 после § 14 | Записывают домашнее задание |
|