Российская Федерация
Управление образования администрации Озерского муниципального района
Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа №6
140560, Московская область, г. Озёры, ул.2-ая Высокополянская, д.22
8 (496 70) 21059
Открытый урок по химии для учащихся 9 класса:
« Свой среди чужих, чужой среди своих»
(амфотерные соединения)
Сведения об авторе:
Гвоздева Татьяна Львовна,
учитель химии и биологии
высшей квалификационной категории
2015г.
Цели урока:
обучающая – сформировать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах. Повторить, закрепить и развить знания о классификации и свойствах оксидов и гидроксидов и о генетической связи между классами веществ.
развивающая – совершенствовать навыки составления уравнений реакций, работы с лабораторным оборудованием, усвоения правил работы в химическом кабинете; развивать умение наблюдать, делать выводы. Способствовать развитию самостоятельности, внимания, памяти, логического мышления, креативности учащихся;
воспитательная – вырабатывать коммуникативные качества, воспитывать желание активно учиться, с интересом, без принуждения и перегрузок.
Методы обучения: наглядные, практические, поисковые, словесно-репродуктивные, игровые.
Методические приемы: составление и чтение формул и названий веществ; самостоятельная работа по составлению уравнений химических реакций; работа с доской, технологической картой, «Рабочим листом»; выполнение химического эксперимента; «химические» игры; тестирование.
Принципы, соблюдаемые в деятельности учителя и учащихся: сотрудничество, соучастие, наглядность, доступность.
Оборудование и реактивы:
компьютер, проектор, экран, презентация урока (Microsoft PowerPoint), на каждой парте у учащихся: 3 чистых пробирки, водные растворы ZnCl2 , HCl, NaOH, пробиркодержатель, технологические карты, «Рабочие листы», трафареты «Скала»)
Структура урока:
| № п/п | Этап урока | Примерное время |
| I. | Организационный этап | 1 мин |
| II. | Мотивация учебной деятельности | 2 мин |
| III. | Актуализация знаний обучающихся | 7 мин |
| IV. | Первичное усвоение новых знаний | 18 мин |
| V. | Физкультминутка | 1 мин |
| VI. | Первичное закрепление знаний | 4 мин |
| VII. | Первичная проверка понимания изученного | 6 мин |
| VIII. | Рефлексия | 1 мин |
Ход урока.
Организационный момент
Приветствие учащихся, проверка готовности учащихся к уроку, настрой на работу.
Учитель.
Здравствуйте, уважаемые члены жюри, гости и, конечно же, дети! Сегодня урок химии буду вести у вас я, Гвоздева Татьяна Львовна, учитель химии МБОУ СОШ №6 г.Озёры Московской области. Я к ребятам своей школы обращаюсь на «ты», вы позволите мне обращаться к вам на «ты»?
Эпиграфом нашего урока будут следующие слова:
Три пути ведут к знанию:
путь размышления – самый благородный,
путь подражания – самый легкий,
и путь опыта – это самый горький.
Я желаю вам идти к достижению цели трудными, но благородными путями.
Мотивация учебной деятельности.
В начале урока учитель ставит проблемные вопросы:
Как вы думаете, почему тема нашего урока звучит именно так: «Свой среди чужих, чужой среди своих»? Кстати, это одноименное название известного дебютного фильма Никиты Михалкова, в котором главную роль сыграл Юрий Богатырев. Эти слова имеют отношение к человеку. А если рассмотреть с позиции химии, то при описании каких веществ можно было бы использовать эти слова? Какие свойства должны проявлять эти вещества?
Перед вами алюминиевая кастрюля. Когда-то в моем детстве бабушка говорила мне, что нельзя варить кислые щи и хранить квашеную капусту в алюминиевой посуде. В наше время в телевизионных передачах нам советуют не мыть алюминиевую посуду щелочными средствами, например, содой? Кому верить: бабушке или современным советам? Или, может, и то, и другое правда?
Исходя из поставленных вопросов и ваших рассуждений попытайтесь, сформулировать тему нашего урока. (учащиеся высказывают свои предположения) (наводящий вопрос, если у детей возникнет затруднение: Как фразу «Свой среди чужих, чужой среди своих» можно перевести на язык химии? Вот мы и сформулировали тему урока)
Есть выражение: «Покорять горные вершины». Мы с вами тоже сегодня будем покорять горную вершину. На какой высоте вы видите себя в начале урока? Определите свое место на «скале» (учитель раздает ученикам заранее приготовленные трафареты «скалы»).
Слайд

В начале урока
Актуализация знаний
Фронтальный опрос. Учитель задает вопросы учащимся:
1. Какова классификация веществ по составу?
(простые и сложные)
2. Какие вещества называются сложными?
(состоящие из 2-х и более химических элементов)
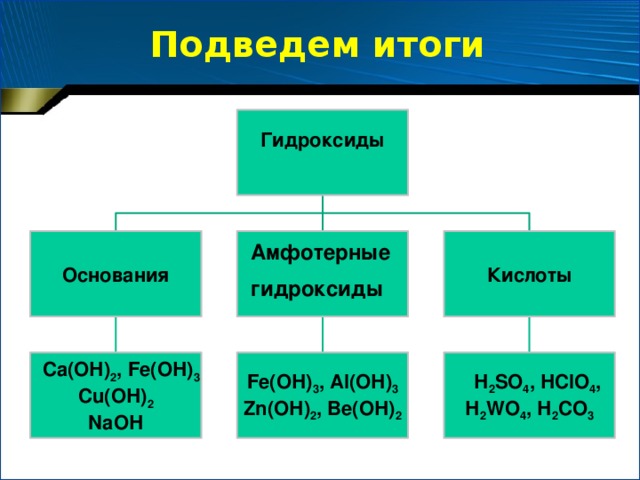
3. (Слайд № ) Какие основные классы неорганических соединений Вам известны?
(оксиды, кислоты, основания, соли)
4. (Слайд № ) Что такое оксиды?
(это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2)
5. (Слайд № ) Выберите из списка веществ оксиды:
CuO, SCl6, H2O, P2O5, NaOH, WO3 , CaCl2, CO2 , H2SO4, SO3, Fe2O3
(Учащиеся работают в «Рабочих листах», затем обмениваются с соседом по парте и проверяют работу друг друга)
6. (Слайд № ) Что такое основания? Приведите примеры.
7. (Слайд № ) Какова классификация оснований по отношению их к воде? (растворимые (щелочи) и нерастворимые
8. (Слайд № ) Что такое кислоты? Какова классификация кислот?
9. (Слайд № ) Что такое соли? Какова классификация солей? Приведите примеры солей.
10. (Слайд № ) Распределите вещества по классам неорганических соединений:
H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3, Al2O3, H2CO3, Cl2O7, Ca(OH)2, H3PO4, Mg(NO3)2, HCl, CaO, BaSO4
| оксиды | кислоты | основания | соли |
|
|
|
|
|
(На слайде каждой колонке соответствует свой цвет. Перед учащимися на парте лежат 4 сигнальных квадрата, цвета которых совпадают с цветом колонок. Распределяем с ними вещества по классам неорганических соединений следующим образом: учитель показывает на формулу и дает команду, по которой дети одновременно поднимают сигнальный квадрат, цвет которого совпадает с цветом колонки соответствующего класса соединений). Учащиеся работают в «Рабочих листах», затем обмениваются с соседом по парте и проверяют работу друг друга)
(Слайд № ) Проверьте себя:
| оксиды | кислоты | основания | соли |
| SO3 Na2O Al2O3 Cl2O7 CaO | H2S H2CO3 H3PO4 HCl | KOH Al(OH)3 Ca(OH)2 | CuSO4 FeCl3 K3PO4 FeS Al2(SO4)3 Mg(NO3)2 BaSO4
|
(Слайд № ) Выполните задания:
- Составьте и назовите формулы оксидов и гидроксидов, образованных следующими элементами:
| Химический элемент | Формула оксида | Характер свойств | Формула гидроксида | Характер свойств |
| Ba |
|
|
|
|
| P |
|
|
|
|
- Укажите характер свойств этих оксидов и гидроксидов;
как из простого вещества можно получить оксид, а из оксида - гидроксид?
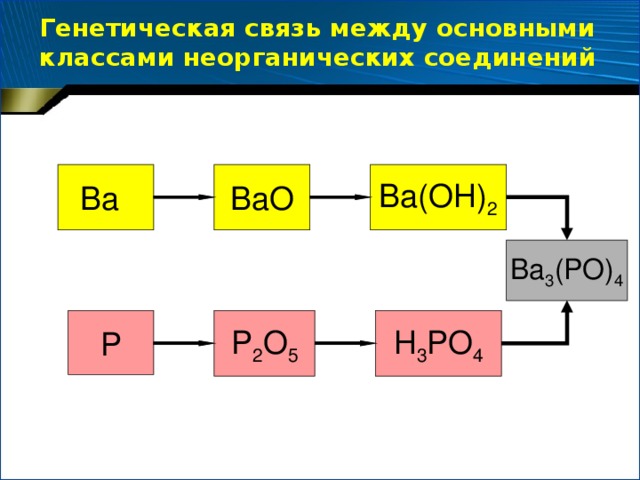
- Составьте цепочки превращений и решите их (парная работа по вариантам, каждый учащийся решает свой вариант, затем обмениваются «Рабочими листами» и проверяют работу друг друга).
( Ва – ВаО – Ва(ОН)2
2Ва + О2 = 2 ВаО
ВаО + Н2О = Ва(ОН)2
Р – Р2О5 – Н3РО4
4Р + 5О2 = 2Р2О5
Р2О5 + 3Н2О = 2Н3РО4 )
Далее вспоминаем генетическую связь между важнейшими классами неорганических соединений:
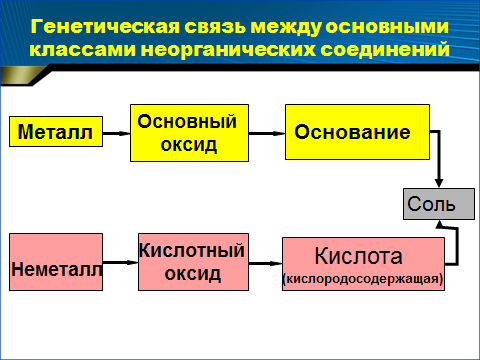

Задание: составьте последнее в этой цепочке уравнение химической реакции между гидроксидом бария и ортофосфорной кислотой (одного из желающих учеников вызываем к доске).
3Ва(ОН)2 + 2Н3РО4 = Ва3(РО4)2 + 6Н2О
Сделайте вывод, какие оксиды и гидроксиды (по характеру свойств) соответствуют металлам, а какие неметаллам.
Ответ учащихся: неметаллам соответствуют кислотные оксиды и кислоты, а металлам – оснόвные оксиды и основания.
Первичное усвоение новых знаний
Учитель. Продолжим изучать свойства химических соединений.
Тема сегодняшнего урока «Амфотерные оксиды и гидроксиды».
Слова оксиды и гидроксиды часто звучали на предыдущих уроках, а вот слово «амфотерные» слышим не на каждом уроке. Что означает это слово? Если заглянуть в толковый словарь в поисках слов, имеющих общий корень со словом «амфотерный», то можно обнаружить следующее:

 Слайд
Слайд
амфора – древний глиняный сосуд для жидких и сыпучих продуктов, c двумя вертикальными ручками и узким горлом.
Слайд
амфибии – по-русски земноводные, живущие двоякой жизнью: и на суше, и в воде, и как животные, и как рыбы.
Слайд

амфитеатр – места для зрителей, расположенные полукругом на склонах холмов с двух сторон от артистов
Амфибрахий – стихотворный размер, при котором ударный слог расположен между двумя неударными.
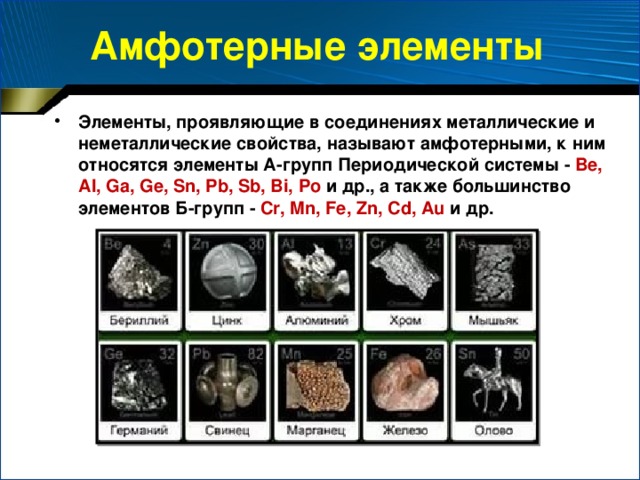
Учитель. Судя по греческой частице «амфо» или «амфи» - (что означает: с двух сторон; и то, и другое), это вещества, которые проявляют свойства и те, и другие. Значит, амфотерные вещества могут проявлять свойства металла и неметалла, кислоты и основания.
Обращаясь к периодической системе химических элементов, предлагаем учащимся следующее:
Найти в периодической системе химические элементы с амфотерными свойствами и назвать формулы их соединений (оксидов, гидроксидов)
(Вещества, обладающие амфотерными свойствами приведены на рис.1. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.

Рис. 1. Вещества, проявляющие амфотерные свойства
Примеры их амфотерных оксидов приведены в таблице 1.
| Амфотерные оксиды |
| Химическая формула | Название |
| BeO | Оксид берилия (II) |
| ZnO | Оксид цинка |
| Al2O3 | Оксид алюминия |
| Cr2O3 | Оксид хрома (III) |
| As2O3 | Оксид мышьяка (III) |
| GeO | Оксид германия (II) |
| PbO2 | Оксид свинца (IV) |
| MnO2 | Оксид марганца (IV) |
| Fe2O3 | Оксид железа (III) |
| SnO | Оксид олова (II) |
)
Проблема: как доказать амфотерный характер оксида или гидроксида?
Ответ учащихся: опытным путем.
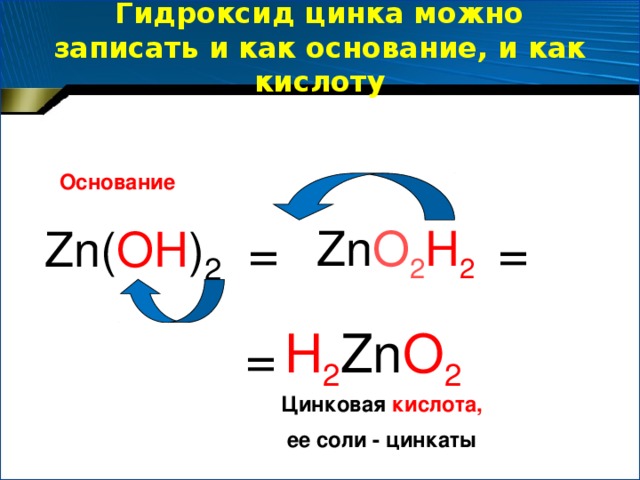
Предлагаем учащимся выполнить лабораторную работу. Цель работы: получить амфотерный гидроксид (на примере гидроксида цинка) и изучить его свойства.
Но, прежде чем приступать к работе, следует вспомнить правила обращения с химическими реактивами, как следует вести себя в кабинете химии.
(Ответы учащихся)
Учитель. Если не соблюдать правила может и такое случится
Слайд

Учитель раздает учащимся технологические карты, которые они заполняют в процессе выполнения работы. На экране слайд «Технологическая карта»:
Слайд 1.
|
| Что делали | Что наблюдали |
| 1 | В пробирки №1 и №2 налили по 1-2 мл р-ра NaOH и добавили несколько капель ZnCl2 до образования осадка |
|
| У равнение реакции: NaOH + ZnCl2 равнение реакции: NaOH + ZnCl2 |
| 2 | К осадку в пробирке №1 добавили р-р соляной кислоты |
|
| У равнение реакции: Zn(OH)2 + HCl равнение реакции: Zn(OH)2 + HCl |
| 3 | К осадку в пробирке №2 добавили р-р гидроксида натрия (избыток) |
|
| У равнение реакции: Zn(OH)2 + NaOH равнение реакции: Zn(OH)2 + NaOH (H2ZnO2) |
Учащиеся работают в парах (в это время звучит легкая музыка). После окончания работы предлагаем им прокомментировать результаты.
Слайд 2.
|
| Что делали | Что наблюдали |
| 1 | В пробирки №1 и №2 налили по 1-2 мл р-ра NaOH и добавили несколько капель ZnCl2 до образования осадка | Образуется белый студенистый осадок |
| У равнение реакции: 2NaOH + ZnCl2 Zn(ОH)2 + 2NaCl равнение реакции: 2NaOH + ZnCl2 Zn(ОH)2 + 2NaCl |
| 2 | К осадку в пробирке №1 добавили р-р соляной кислоты | Осадок растворяется |
| У равнение реакции: Zn(OH)2 + 2HCl ZnCl2 + 2H2O равнение реакции: Zn(OH)2 + 2HCl ZnCl2 + 2H2O |
| 3 | К осадку в пробирке №2 добавили р-р гидроксида натрия (избыток) | Осадок растворяется |
| У равнение реакции: Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O равнение реакции: Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O (H2ZnO2) |
Дополнение учителя: на самом деле, взаимодействие гидроксида цинка со щелочью с образованием средней соли – цинката натрия - происходит при нагревании (сплавлении) твердых веществ. Если же взять водные растворы веществ, то реакция пойдет несколько иначе – с образованием комплексной соли:
Zn(OН)2 + 2NaOH → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Аналогично происходит взаимодействие и оксида цинка с водным раствором гидроксида натрия:
ZnO + 2NaOH + Н2О → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Таким образом, продукты реакции зависят от условий проведения реакции: в расплаве или в водном растворе щелочи.
Далее обозрению учащихся предлагается слайд, в котором следует вставить пропущенные слова:
Учитель: итак, какой вывод о свойствах гидроксида цинка можно сделать, исходя из результатов проделанной вами работы?
Учащиеся: гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Физкультминутка
Учитель: предлагаю вам немного отдохнуть. Под звуки спокойной музыки примите удобную позу, закройте глаза и подумайте о чем-нибудь приятном. Спокойно выполните повороты головы влево, вправо, вперед, назад, повторите движения еще раз. Откройте глаза. А теперь продолжим работать.
Первичное закрепление знаний
Учитель: кроме цинка, наиболее типичным представителем переходных металлов является алюминий, оксид и гидроксид которого также проявляют амфотерные свойства.
Al2O3 - оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.

Рис. 2. Минералы на основе оксида алюминия
Учитель предлагает учащимся выполнить в «Рабочих листах» следующие задания (учащиеся работают по вариантам в своих «Рабочих листах», затем обмениваются и проверяют работу друг друга):
Вариант 1: составьте уравнения реакций взаимодействия оксида алюминия Al2O3 с соляной кислотой и гидроксидом натрия.
Вариант 2: составьте уравнения реакций взаимодействия гидроксида алюминия Al(OH)3 с соляной кислотой и гидроксидом натрия.
(Слайд № ) Проверьте себя:
Вариант 1: Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 3NaOH = Na3AlO3 + 3H2O
Вариант 2: Al(OН)3 + 3HCl = AlCl3 + 3H2O
Al(OН)3 + 3NaOH = Na3AlO3 + 3H2O
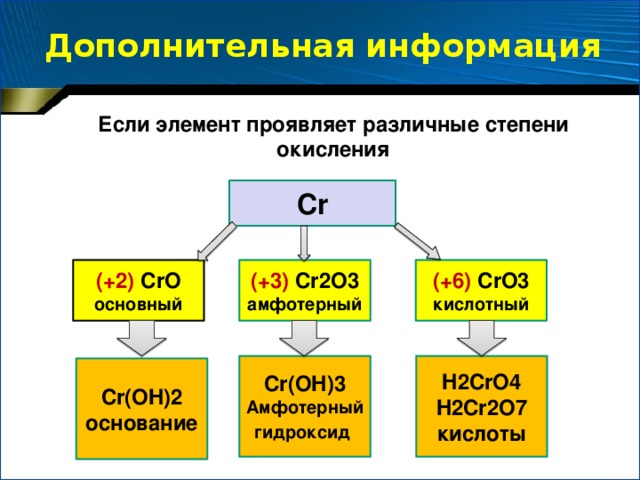
Дополнение учителя: если химический элемент - металл проявляет различные степени окисления, то он образует несколько оксидов и соответствующих им гидроксидов. Причем, с увеличением степени окисления этого элемента усиливается кислотный характер его соединений. Демонстрация слайда:
Слайд
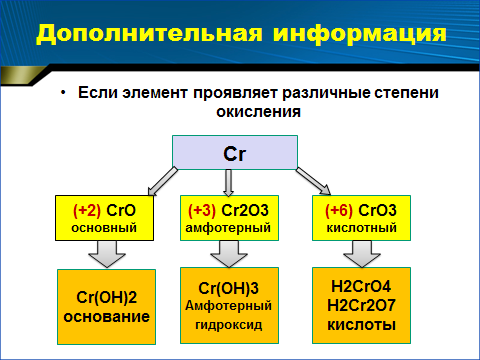
Надо сказать, что элементы, которые образуют амфотерные соединения – оксиды и гидроксиды, могут и сами проявлять амфотерные свойства.
Zn + H2SO4(разб.)→ ZnSO4 + H2↑
Zn + 2NaOH → Na2ZnO2 + Н2↑(цинкат натрия)
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + Н2↑(тетрагидроксоцинкат натрия)
Первичная проверка понимания изученного
а) в игровой форме:
Слайд: Вещество – универсал:
Щелочь он парализует,
Кислоту нейтрализует,
И в реакции такой
Получаем соль с водой.
Слайд:
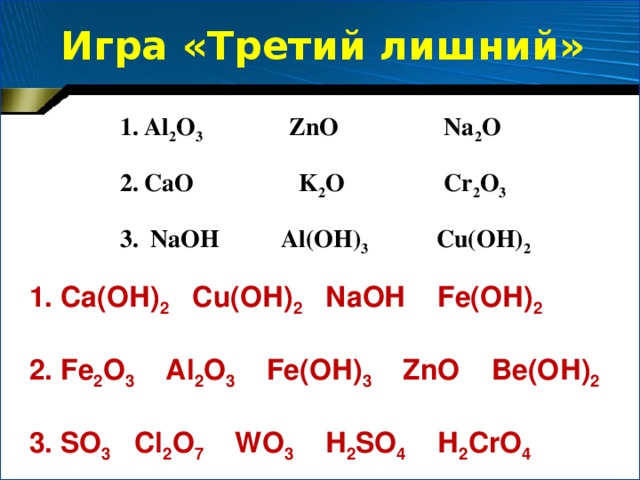
«Третий лишний»
Al2O3, ZnO, Na2O
CaO, K2O, Cr2O3
NaOH, Al(OH)3, Cu(OH)2
«Третий лишний»
1. Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2
2. Fe2O3, Al2O3, Fe(OН)3 , ZnO, Be(OН)2
3. SO3, Cl2O7, WO3, Н2SO4, Н2CrO4
б) тестирование
Тесты (два варианта) готовятся учителем заранее на каждого ученика. Содержат 3-4 задания. Проводим выборочную проверку тестов.
| Тест «Амфотерные оксиды и гидроксиды» |
| Вариант 1 | Вариант 2 |
| 1.Амфотерным оксидом является: а) К2О; б) ZnО; в) P2О3; г) Ag2О. 2. Какой из гидроксидов будет взаимодействовать и с серной кислотой, и с гидроксидом калия: а)Fe(ОН)2; б)Mg(OH)2; в) Ca(OH)2; г)Be(OH)2. 3. С водным раствором гидроксида натрия будет взаимодействовать: а) Fe; б) Al; в) Ni; г) Сu 4. При взаимодействии оксида бериллия с расплавом гидроксидом калия образуется: а  ) К2ВеО2 б) Be(OH)2 ) К2ВеО2 б) Be(OH)2 в) BeO г) K2 Be(OH)4
| 1. Амфотерным гидроксидом является: а)Al(OH)3; б) Ba(OH)2; в)Ni(OH)2; г)NaОН. 2. При взаимодействии оксида алюминия с гидроксидом натрия при сплавлении образуется: а  ) K Al(OH)4 ; б)Al(OH)3; в)Al; г) Na3AlO3 ) K Al(OH)4 ; б)Al(OH)3; в)Al; г) Na3AlO3 3. 3.Какой из металлов будет взаимодействовать и с гидроксидом бария, и с соляной кислотой а) алюминий б) свинец в) магний г) железо 4. С водным раствором гидроксида натрия не взаимодействует: а) Zn(OH)2; б) BeO; в) Cu; г)Al.
|
Рефлексия.
Сегодня на уроке вы познакомились с амфотерными оксидами и гидроксидами. Это вещества, которые имеют амфотерные (двойственные) свойства. Химические реакции, протекающие с ними, имеют особенности.
Решение проблемы, поставленной в начале урока:
1. Как вы думаете, почему тема нашего урока звучит именно так: «Свой среди чужих, чужой среди своих»? Обоснуйте свой ответ.
2. Как вы считаете, можно ли варить кислые щи в алюминиевой посуде и хранить квашеную капусту? и можно ли мыть алюминиевую посуду щелочными средствами, например, содой? Почему? Обоснуйте свой ответ.
Надеюсь, что в ходе работы на уроке вы не только узнали много нового, но и многому научились. Предлагаю теперь определить свое местоположение на «скале знаний».
Слайд

Выборочно предлагаю учащимся озвучить свое мнение.
После урока свой «Рабочий лист» и Технологическую карту вы можете оставить у себя и использовать их в дальнейшем при подготовке к следующему уроку, или самостоятельной (контрольной) работе.
Учитель, обращаясь к ученикам: Спасибо за Вашу поддержку и понимание! Удачи при восхождении к новым вершинам знаний!
Если останется время
Можно предложить учащимся решить проблемную задачу:
После летних каникул в кабинете химии обнаружены банки с реактивами, отвалившиеся этикетки которых были перепутаны: AlCl3, CuCl2, FeCl3, MgCl2. Как определить, в какой пробирке какое вещество находится?
Осуществите следующие превращения:
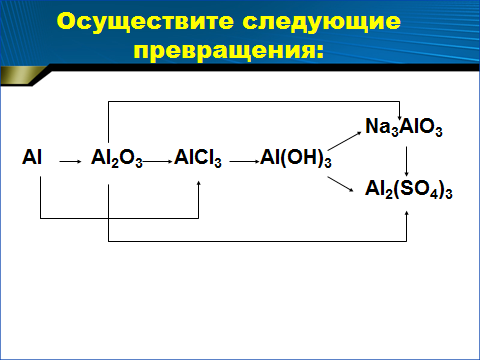
ПРИЛОЖЕНИЯ
«Рабочий лист» Ф.И. ученика (цы)_______________ Вариант № ___
| № зад. | Задание | Решение | Взаимопроверка | Оцени себя сам |
| 1 | Выберите из списка веществ оксиды и подчеркните их: CuO, SCl6, H2O, P2O5, NaOH, WO3 , CaCl2, CO2 , H2SO4, SO3, Fe2O3
|
|
|
|
| 2 | Распределите вещества по классам неорганических соединений: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3, Al2O3, H2CO3, Cl2O7, Ca(OH)2, H3PO4, Mg(NO3)2, HCl, CaO, BaSO4
| Оксиды | кислоты | основания | соли |
|
|
| 3 | 1.Составьте формулы оксидов и гидроксидов, образованных следующими элементами, и назовите их: Ba, P 2.Укажите характер свойств этих оксидов и гидроксидов; 3. Как из простого вещества можно получить оксид, а из оксида - гидроксид? 4. Составьте цепочки превращений и решите их.
|
|
|
|
| 4 | Составьте уравнение реакции между гидроксидом бария и ортофосфорной кислотой. |
|
|
|
| 5 | Вариант 1: составьте уравнения реакций взаимодействия оксида алюминия Al2O3 с соляной кислотой HCl и гидроксидом натрия NaOH. Вариант 2: составьте уравнения реакций взаимодействия гидроксида алюминия Al(OH)3 с соляной кислотой HCl и гидроксидом натрия NaOH.
|
|
|
|
|
|
| На уроке: Если сумма баллов, набранных за урок: 22 – 25 – «Ура! Я на вершине» 18 – 21 – «До вершины еще один перевал» 14 – 17 – «До вершины еще долго, но я на верном пути» меньше 14 – «Накрыло лавиной, но мы не отступим». | О цените свою работу на уроке по 25-тибалльной шкале: цените свою работу на уроке по 25-тибалльной шкале: |
Технологическая карта
|
| Что делали | Что наблюдали |
| 1 | В пробирки №1 и №2 налили по 1-2 мл р-ра NaOH и добавили несколько капель ZnCl2 до образования осадка |
|
| У равнение реакции: NaOH + ZnCl2 равнение реакции: NaOH + ZnCl2 |
| 2 | К осадку в пробирке №1 добавили р-р соляной кислоты |
|
| У равнение реакции: Zn(OH)2 + HCl равнение реакции: Zn(OH)2 + HCl |
| 3 | К осадку в пробирке №2 добавили р-р гидроксида натрия (избыток) |
|
| У равнение реакции: Zn(OH)2 + NaOH равнение реакции: Zn(OH)2 + NaOH (H2ZnO2) |
Трафарет «Скала»
Определите свое местоположение на «скале знаний».


В начале урока В конце урока
| Тест «Амфотерные оксиды и гидроксиды» |
| Вариант 1 | Вариант 2 |
| 1.Амфотерным оксидом является: а) К2О; б) ZnО; в) P2О3; г) Ag2О. 2. Какой из гидроксидов будет взаимодействовать и с серной кислотой, и с гидроксидом калия: а)Fe(ОН)2; б)Mg(OH)2; в) Ca(OH)2; г)Be(OH)2. 3. С водным раствором гидроксида натрия будет взаимодействовать: а) Fe; б) Al; в) Ni; г) Сu 4. При взаимодействии оксида бериллия с расплавом гидроксидом калия образуется: а  ) К2ВеО2 б) Be(OH)2 ) К2ВеО2 б) Be(OH)2 в) BeO г) K2 Be(OH)4
| 1. Амфотерным гидроксидом является: а)Al(OH)3; б) Ba(OH)2; в)Ni(OH)2; г)NaОН. 2. При взаимодействии оксида алюминия с гидроксидом натрия при сплавлении образуется: а  ) K Al(OH)4 ; б)Al(OH)3; в)Al; г) Na3AlO3 ) K Al(OH)4 ; б)Al(OH)3; в)Al; г) Na3AlO3 3. 3.Какой из металлов будет взаимодействовать и с гидроксидом бария, и с соляной кислотой а) алюминий б) свинец в) магний г) железо 4. С водным раствором гидроксида натрия не взаимодействует: а) Zn(OH)2; б) BeO; в) Cu; г)Al.
|
20













 равнение реакции:
равнение реакции: 

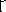
 ) К2ВеО2 б)
) К2ВеО2 б) 
 )
) 

 цените свою работу на уроке по 25-тибалльной шкале:
цените свою работу на уроке по 25-тибалльной шкале:







































![Дополнительная информация элементы, которые образуют амфотерные соединения – оксиды и гидроксиды, могут и сами проявлять амфотерные свойства. Zn + H 2 SO 4(разб.)→ Zn SO 4 + H 2 ↑ Zn + 2NaOH → Na 2 ZnO 2 + Н 2 ↑ (цинкат натрия) Zn + 2NaOH + 2H 2 O → Na 2 [ Zn(OH) 4 ] + Н2↑ (тетрагидроксоцинкат натрия)](https://fhd.multiurok.ru/7/f/6/7f675185a59c09a9a998afc500d4b662fe7475cf/img_phpqrtn25_konkursnyj-urok-Amfoternye-soedineniya_0_47.jpg)