Просмотр содержимого документа
«Конспект "Строение атома. Закономерности в изменении свойств химических элементов первых трёх периодов" (базовый уровень)»
СТРОЕНИЕ АТОМОВ И ИОНОВ
|
|
| Атом (нейтральный) |
| Число протонов (Z) = числу электронов = = заряду ядра атома (+) = порядковому номеру элемента в ПСХЭ. Число нейтронов (N) = А – Z, где А – массовое число (А = Z + N); А – округлённое значение относительной атомной массы из ПСХЭ. Обозначение элемента Э – 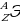 . . |
|
| 
|
|
| 
|
|
| 
|  Ядро Ядро
|
|
|  Электронная оболочка Электронная оболочка
|
|
|
|
|
|
|
|
| Протоны р (заряд +1) |
| Нейтроны n (заряд 0) |
| Электроны  (заряд –1) |
Строение электронной оболочки: ▪ Число электронных слоёв равно номеру периода в ПСХЭ.
◌ ) ) ) ) ) ) ) ▪ Число электронов во внешнем электронном слое равно номеру группы в ПСХЭ.
Ядро 1 2 3 4 5 6 7 ▪ Номер группы показывает максимальное число валентных электронов,
Электронные слои высшую положительную степень окисления и высшую валентность.
Периодический закон и основные понятия
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов» – периодический закон (современная формулировка).
Период – горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся благородным газом.
Группа – вертикальный ряд элементов, имеющих сходные свойства.
Валентность – способность элементов образовывать определённое число химических связей.
Высшая валентность и высшая степень окисления (положительная) равна номеру группы.
Низшая валентность и низшая степень окисления (отрицательная), вычисляют по формуле: номер группы – 8.
Низшая степень окисления характерна для неметаллов.
Промежуточная степень окисления – возможные значения степени окисления элемента между высшей и низшей степенями окисления.
Радиус атома – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Электроотрицательность – способность атома притягивать (удерживать) внешние (валентные) электроны при образовании химической связи. Она определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Восстановительные свойства – способность отдавать электроны.
Окислительные свойства – способность принимать электроны.
Кислотные свойства – способность взаимодействовать с веществами, проявляющими оснóвные свойства.
Оснóвные свойства – способность взаимодействовать с веществами, проявляющими кислотные свойства.
Амфотерные свойства – способность проявлять как оснóвные, так и кислотные свойства.
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ В ПЕРИОДАХ И ГРУППАХ
| Свойство или характеристика элемента | Изменение свойства в периоде (слева направо) | Изменение свойства в группе (сверху вниз) |
| Заряд ядра атома | Увеличивается | Увеличивается |
| Число электронных слоёв в атоме | Не изменяется | Увеличивается |
| Число электронов во внешнем электронном слое | Увеличивается | Не изменяется |
| Валентность в высших оксидах и гидроксидах | Увеличивается | Не изменяется |
| Радиус атома | Уменьшается | Увеличивается |
| Восстановительные (металлические) свойства | Уменьшаются | Увеличиваются |
| Окислительные (неметаллические) свойства | Увеличиваются | Уменьшаются |
| Электроотрицательность | Увеличивается | Уменьшается |
| Кислотные свойства высших оксидов и гидроксидов | Усиливаются | Ослабевают |
| Оснóвные свойства высших оксидов и гидроксидов | Ослабевают | Усиливаются |







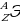 .
.

 Ядро
Ядро Электронная оболочка
Электронная оболочка










