11 класс
Физика
Урок № 48
Тема: Строение атома. Опыты Резерфорда.
Тип: урок изучения нового материала.
Цель: изучить планетарную модель атомного ядра; дать определение понятию
атомного ядра; рассмотреть опыты Резерфорда; сравнить модели атома Томсона
и Резерфорда.
ХОД УРОКА
I. Организационный момент
Учитель и ученики приветствуют друг друга. Проверяется готовность к уроку. Выявление отсутствующих на уроке.
II. Проверка домашнего задания
Учитель берёт тетради для проверки выполнения домашнего задания у 2–3 учащихся.
III. Актуализация опорных знаний учащихся
– Какую тему мы изучали на прошлом уроке?
– Чем отдельные молекулы поглощают световую энергию?
– На какие составные части при поглощении углекислого газа листья расщепляют его молекулы? Где это происходит? Кто это установил?
IV. Постановка темы и целей урока
– Научная тория о строении вещества получила своё развитие в XVIII – XIX вв. Учёными доказано, что все вещества состоят из молекул, а молекулы из ещё более мелких частиц – атомов. Воздух, вода, почва, растения, человек – всё состоит из атомов. Атомы – это строительные блоки всего того, что окружает нас – всего материального мира. В переводе с древнегреческого атом означает «неделимый, неразрезаемый». Ещё Демокрит утверждал, что все веществ состоят из мельчайших неделимых частиц, при этом Аристотель выдвигал гипотезу, что делимость вещества бесконечна.
– Как вы думаете, можно ли увидеть атомы? Выслушиваю ответы учащихся.
– В современном мире существуют микроскопы, благодаря которым возможно увидеть атомы. Размеры атомов составляют десятые доли нанометров.
– Верна ли гипотеза о неделимости атома? Попробуем разобраться! На это уроке мы узнаем о планетарной модели строения атома.
V. Изучение нового материала
1. Идея электронной структуры атома
– Идею электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Именно им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом–электроны, и они являются частью атома.
2. Как связаны булочка с изюмом с физикой?
– По мысли Томсона заряд занимает весь объём атома и распределён в этом сферическом объёме равномерно. У более сложных атомов в положительно заряженном шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели «пудинг с изюмом» или «булочка с изюмом».
3. Электрон
– К началу ХХ века было известно, что атомы материи имеют сложную внутреннюю структуру, они являются электрически нейтральными системами, а носителями отрицательного заряда атома являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов.
Учитель делает запись на доске:
| Электрон – наименьшая электроотрицательная заряженная элементарная частица. Масса покоя электрона: те = 9,1 10-31 кг Отношение заряда электрона к его массе:  = 1,759 1011 Кл/кг. = 1,759 1011 Кл/кг.
|
Однако, модель атома Томсона противоречила результатам экспериментов по изучению распределения положительных зарядов.
4. Опыты Эрнеста Резерфорда
К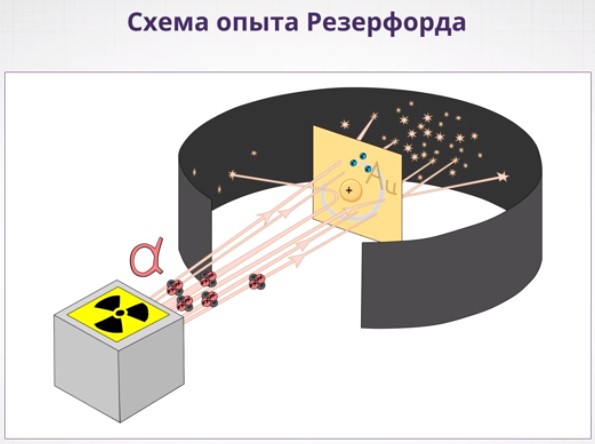 лассические опыты по проверке характера
лассические опыты по проверке характера
распределения заряда атома были осуществлены
английским физиком Эрнестом Резерфордом.
Эрнест Резерфорд в 1906 году предложил
применить зондирование атома ɑ-частицами,
скорость которых составляет 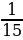 скорости света.
скорости света.
Эти частицы возникают при распаде, например
радия и некоторых других радиоактивных
элементов. Сами же ɑ-частицы это
ионизированные атомы гелия. Положительный
заряд гелия по модулю в 2 раза больше заряда
электрона. Этими частицами Резерфорд
бомбордировал атомы тяжёлых элементов –
золото, медь и др. Если бы электроны были
распределены равномерно по всему объёму атома,
как в модели атома Томсона, электроны не могли
бы заметно изменять траекторию ɑ-частиц,
т.к. размеры и масса электронов в 8000 раз меньше массы ɑ-частиц.
те тɑ
-Изменение направления движения альфа-частиц может вызвать только массивная часть атома, при этом только положительно заряженная.

Схема опытов Резерфорда показана на рисунке:

Учитель строит схему опытов Резерфорда на доске, а учащиеся у себя в тетради.
- Весь прибор размещался в сосуде, из которого был откачен воздух. Радиоактивный препарат помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок ɑ-частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеивания альфа-частицы попадали на полупрозрачный экран, покрытый ZnS. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией – вспышкой света, которую можно было наблюдать в микроскоп. Сотрудники Резерфорда вели счёт альфа-частиц, попадающих в регистрирующее устройство, при отклонении их от первоначального направления на определённый угол  .
.
| Угол отклонения
ɑ-частиц  , , | 15 | 60 | 105 | 150 | 180 |
| Число частиц N | 132000 | 477 | 70 | 33 | 1 – 3 |
-Отсюда можно сделать вывод: такое поведение ɑ-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряженным телом малых по сравнению с атомом размеров. Так Резерфорд пришёл к мысли о существовании атомного ядра.
Ученики делают запись в тетрадь:
| Атомное ядро – тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома. |
-Подсчитывая число ɑ-частиц, рассеянных на различные углы, Резерфорд смог установить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12–10-13 см. Размер самого атома – 10-8, т.е. от 10 до 100000 раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.
Планетарная модель атома Резерфорда состоит в следующем:
-
В целом атом нейтрален
-
В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома
-
Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д.И. Менделеева
5. Электроны внутри атома
- Как же ведут себя электроны внутри атома? Находится в покое они не могут, т.к. упали бы на ядро. Они движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Запись на доске:
| Сила взаимодействия двух точечных зарядов в вакууме прямо пропорциональна произведению модулей зарядов, и обратно пропорциональна квадрату расстояния между ними. Fmax = k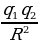 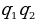 – модули двух точечных зарядов; – модули двух точечных зарядов;
R – радиус атома;
k – коэффициент пропорциональности k = 9 109 Нм2/Кл2
|
6. Строение атома водорода
- В атоме водорода вокруг ядра обращается всего лишь один электрон. Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу примерно 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода – это радиус орбиты его электрона.
7 . Планетарная модель атома
. Планетарная модель атома
-Простая и наглядная планетарная модель атома имеет
прямое экспериментальное обоснование. Она кажется
необходимой для объяснения опытов, по рассеиванию
альфа-частиц. Но на основе этой модели нельзя объяснить
факт существования атома, его устойчивость, ведь
движение электронов по орбитам происходит с
ускорением.
-Ускоренно движущийся заряд должен излучать электромагнитные волны с чистотой, равной чистоте его обращения вокруг ядра. Электроны должны приближаться к тому, как спутник приближается к Земле, при торможении в верхних слоях атмосферы. Атом должен прекратить своё существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбуждённом состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Несогласующийся с опытом вывод о неизбежной гибели атомов, вследствие потери энергии на излучение, это результат применения законов классической физики к явлениям внутри атома. Отсюда следует, что к таким явлениям законы классической физики нельзя применять.
VI. Закрепление изученного материала. Решение упражнений
Учащимся выдаются карточки:
| ФИЗИКА
11 КЛАСС
УРОК №48 Карточка с заданиями по теме: «Строение атома. Опыты Резерфорда» 1. Какие характерные черты описывают модель атома Дж. Томсона? Выберите несколько вариантов ответов.
а) Атом водорода представляет собой заряженный шар, внутри которого
расположен электрон;
б) Электроны движутся по своим орбитам вокруг ядра;
в) Электроны распределены по всему объёму атома;
г) Положительный заряд занимает весь объём атома. 2. Установите соответствие между физической величиной и её значением. 1) Размер атома (см) а) 8000
2) Диаметр ядра (см) б) 10-8
3) Скорость ɑ-частицы от скорости света в) 1/15
составляет (из опыта Резерфорда) г) 10-12 –10-13
4) Масса частицы больше массы
электрона в _______ раз 3. Заполните пропуски в тексте:
Ядро атома водорода имеет положительный заряд, равный по модулю
заряду ________________, и массу, примерно в 1836,1 раза больше массы
____________________. 4. В ядре атома серебра 108 частиц. Вокруг ядра атома обращается 47 электронов. Зарядовое число атома серебра составляет:
а) + 108; б) – 46;
в) – 61; г) + 47. 5. В ядре атома Дубния 262 частицы. Вокруг ядра обращается 105 электронов. Чему равно зарядовое число ядра атома Дубния? 6. В ядре атома Резерфордия 261 частица. Вокруг ядра обращается 104 электрона. Чему равно зарядовое число ядра атома Резерфордия? 7. Вставьте нужное число в пропуск: Электрон в атоме водорода радиусом 3,26⋅10–11м движется со скоростью _________ ⋅106 м/с по ближайшей орбите к ядру.
|
Рекомендации к решению упражнений на уроке:
Задания 1 – 4 решают учащиеся с низкой успеваемостью.
Задания 5 и 7 решают учащиеся с средней успеваемостью.
Задание 6 даётся для самостоятельного решения на уроке.
VII. Анонс домашнего задания
-
Прочитать §94
-
Отвечать на вопросы из §94
-
Решить задачу:
Во сколько раз уменьшится сила кулоновского отталкивания двух маленьких бусинок с равными зарядами, если, не изменяя расстояния между ними, перенести две трети заряда с первой бусинки на вторую бусинку?
Обсуждение выполнения домашнего задания
VIII. Подведение итогов урока
Учитель выставляет оценки за работу на уроке, тем самым подводит итоги занятия.







 = 1,759 1011 Кл/кг.
= 1,759 1011 Кл/кг. лассические опыты по проверке характера
лассические опыты по проверке характера 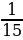 скорости света.
скорости света. 

 .
. 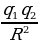
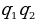 – модули двух точечных зарядов;
– модули двух точечных зарядов; . Планетарная модель атома
. Планетарная модель атома 



















