Урок № 56
класс 8
дата 26.03.2025 г.
Тема урока: Характеристика химического элемента по его положению в Периодической системе Д. И. Менделеева
Тип урока: изучение нового материала.
Цель урока: расширить и углубить полученные знания построению атомов химических элементов, научить составлять план характеристики химического элемента, исходя из его положения в Периодической системе и строения атома.
Планируемые результаты:
Предметные: учащиеся должны знать структуру Периодической системы, уметь характеризовать элемент по его положению в ПС, составлению электронной схемы атома и определению химических свойств.
Метапредметные: умение развивать способность сравнивать элементы разных групп и периодов, обобщать информацию и делать выводы.
Личностные: формировать ответственное отношение к учебе, интерес к химии и самостоятельность в изучении нового материала.
Оборудование: учебник Рудзитиса, таблица Д.И. Менделеева, рабочие тетради, карточки-задания.
Методы урока: объяснительно-иллюстративный, репродуктивный, проблемный, частично-поисковый.
Оборудование: компьютер, интерактивная доска, проектор.
Ход урока
Организационный этап.
Приветствие обучающихся, подготовка к уроку.
2. Проверка домашнего задания
На прошлом уроке мы изучали с Вами «Строение электронных оболочек атомов элементов Периодической системы Д. И. Менделеева»
Учащихся делят на команды (или каждый ученик работает индивидуально). Каждая команда получает набор карт с изображениями атомов различных элементов и пустых клеток для заполнения электронной конфигурации.
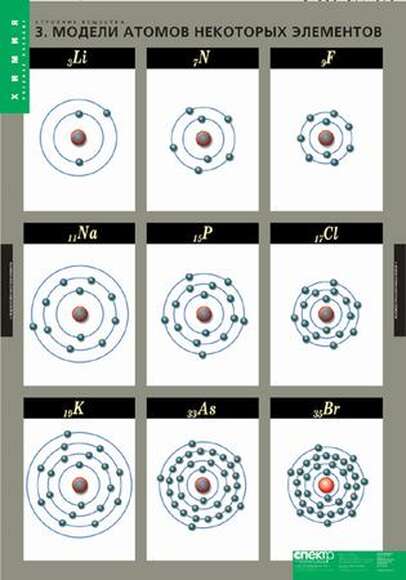
Учитель называет элемент или символ элемента, задача команд — быстро заполнить соответствующую карточку элементами правильной электронной конфигурации.
Для усложнения можно добавить вопросы типа:
- сколько электронов находится на внешнем уровне у магния (Mg)?
- какой элемент имеет следующую электронную конфигурацию: 1s2 2s2 2p6 3s11s22s22p63s1?
У доски выполняют задание 2 ученика, остальные взаимопроверка и выставление оценок.
3. Актуализация знаний
Учитель задает вопросы:
Что такое атом?
Какие частицы входят в состав атома?
Где расположены электроны, протоны и нейтроны в атоме?
Чем отличается ядро от электронной оболочки?
Что обозначают термины «массовое число» и «атомный номер»?
Как определить количество протонов, нейтронов и электронов в атоме конкретного элемента?
Что такое энергетические уровни и орбитали?
Какие принципы определяют распределение электронов по энергетическим уровням?
Какие существуют типы орбиталей (ss, pp, dd, ff) и какова их максимальная вместимость электронов?
Ответы:
Атом — наименьшая частица химического элемента, сохраняющая его химические свойства.
В состав атома входят протоны, нейтроны и электроны.
Протоны и нейтроны образуют ядро, а электроны движутся вокруг него.
Ядро атома заряжено положительно, а электронная оболочка отрицательно.
Массовое число — сумма числа протонов и нейтронов в ядре. Атомный номер — число протонов в ядре.
Количество протонов определяется атомным номером, количество нейтронов — разница между массовым числом и атомным номером, а количество электронов совпадает с количеством протонов у нейтрального атома.
Энергетические уровни — области пространства, где наиболее вероятно присутствие электрона. Орбитали — различные формы движения электронов внутри каждого уровня.
Распределение электронов регулируется принципами Паули и Хунда, а также правилом Клечковского.
Типы орбиталей: s-орбиталь вмещает максимум 2 электрона, p-орбиталь — 6 электронов, d-орбиталь — 10 электронов, f-орбиталь — 14 электронов.
4 . Постановка формируемых результатов и задач урока. Мотивация учебной деятельности.
Представьте себе, что вам предстоит знакомство с незнакомым человеком. Первое впечатление создаётся сразу: внешность, манера поведения, голос... Так и с химическими элементами: достаточно взглянуть на их расположение в Периодической системе Д.И. Менделеева, чтобы многое сказать о них заранее.
Вы знали, что химия обладает своей уникальной картой мира — таблицей Менделеева? Она похожа на карту путешественника, позволяющую заглянуть внутрь любого элемента и увидеть, какой он на самом деле. Ведь расположившись в определённом месте таблицы, элемент раскрывает свои секреты:
- Как много электронов у него в распоряжении?
- Насколько устойчивы его внешние слои?
- Будет ли он активным участником химических реакций или предпочтёт спокойную жизнь одиночки?
Например, взглянув на натрий (Na), расположенный в первой группе, вы сможете предположить, что этот элемент невероятно активный и мгновенно вступает в реакции, образуя соли.
Так вот, сегодня наш урок посвящен этому волшебству расшифровки элементов. Мы узнаем, как с первого взгляда читать карты свойств элементов, понимать, почему одни соединяются друг с другом, а другие предпочитают оставаться свободными.
Начало формы
Это позволяет плавно перейти к изучению темы урока.
Формулировка и запись темы урока.
Учитель: Строение электронных оболочек атомов элементов Периодической системы Д. И. Менделеева
Какая цель нашего урока исходя из темы?
5. Изучение нового материала
Учитель: Кто бы мог подумать, что простая школьная таблица станет ключом к разгадкам великих тайн Вселенной?! Позвольте познакомить вас с нашим героем сегодняшнего приключения — великим русским учёным Дмитрием Ивановичем Менделеевым, создателем самой знаменитой классификации веществ — Периодической системы химических элементов.
- «Что скрывает каждая ячейка?»
Каждая клеточка в таблице Менделеева хранит свою историю. Вот некоторые подсказки:
Название элемента: Оно дано не случайно. Иногда оно связано с мифологией («Прометей»), иногда с географией («Америка»).
Символ элемента: Короткое имя, отражающее сущность вещества.
Атомный номер: Уникальное число, определяющее количество протонов в ядре атома.
Относительная атомная масса: Важнейшая характеристика массы атома относительно водорода.
Посмотрим на пример:
| Ячейка | Название элемента | Символ | Атомный номер | Относительная атомная масса |
| 1 | Водород | H | 1 | 1 |
| 2 | Гелий | He | 2 | 4 |
- «Путешествие по строкам и колоннам»
Таблица Менделеева делится на строки (периоды) и колонки (группы). Каждое местоположение несет важную информацию:
Группа (колонка): Скрывает секреты общих химических свойств. Например, щелочные металлы (первая группа) чрезвычайно активны и охотно реагируют с водой.
Период (строка): Показывает увеличение сложности атомов и постепенное усиление металлических свойств.
Пример:
| Группа / Период | Свойства |
| Щелочные металлы | Очень активные |
| Благородные газы | Практически не взаимодействуют |
Записывают план в тетради:
План характеристики элементов по ПСХЭ
Порядковый номер элемента, относительная атомная масса (Ar), химический знак.
Строение атома (заряд ядра (Z), количество протонов, нейтронов, электронов).
Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).
Распределение электронов по энергетическим уровням, электронная формула атома.
Характер элемента (металл, неметалл).
Высшая и низшая валентность.
Сравнение со свойствами соседних элементов (по группе, по периоду).
Формула высшего оксида, название, его характер.
Формула гидроксида (основания или кислоты), название, его характер.
Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
Несколько учеников записывают на доске характеристику элементов: алюминий, калий, водород, цинк.
Охарактеризуем металл калий К
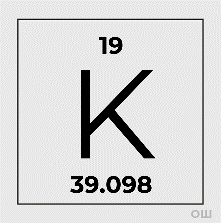 Рис. 1. Калий в ПСХЭ
Рис. 1. Калий в ПСХЭ
1.Порядковый номер калия, то есть клетка, в которой он стоит, — 19, относительная атомная масса Ar — 39. Химический символ — K.
2. Заряд его ядра равен Z = +19 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 19 электронов, и 19 протонов, а число нейтронов определяется по формуле n = Ar − Z, то есть 39–19 = 20, значит, в атоме 20 нейтронов.
3. Калий расположен в ПС в I группе, главной (A) подгруппе, 4 большом периоде, относится к элементам s-семейства, так как последняя заполненная орбиталь
4. Калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором — 8, на третьем — 8, на четвёртом, значит, — 1 электрон:
Электронная формула атома калия: 1s22s22p63s23p64s1.
5. Так как калий расположен над диагональю B-At в ПСХЭ, то он является металлом.
6. Сравним свойства элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, так как в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра, их становится легче отдавать.
7. Сравним свойства элемента калия со свойствами его соседей по периоду: металлические свойства калия выражены сильнее, чем у кальция, так как в периодах слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее отдавать, чем присоединить.
8. Калий – металл I A группы, его высшая валентность I (определяется номером группы). Металлу соответствует оксид калия – K2O, значит, это основный оксид, и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
К2О + 2HCl = 2KCl + H2O
K2O + SO3 = K2SO4
K2O + H2O = 2KOH
9. Гидроксид калия (едкое кали) – это KOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями. Это подтверждается уравнениями реакции:
КОH + HNO3 = KNO3 + H2O
2KOH + CO2 = K2CO3 + H2O
2KOH + MgCl2 = 2KCl + Mg(OH)2
Физкультминутка гимнастика для глаз
6. Первичное закрепление нового материала
Задание: составить характеристику элементов № 10,17,26,32
Работают на местах, один у доски – проверка. Проверка у доски, металлы, неметаллы записываем парами.
Чем они отличаются друг от друга?
Подводит к итогам урока: Д.И. Менделеева: “ «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер атомов этих элементов.»
Итоги урока. Рефлексия
себя, как прошла твоя встреча с миром химических элементов:
Возможно, ты столкнулся с трудностью в запоминании правил распределения электронов или возникновении путаницы в различии периодов и групп. Ничего страшного! Повторяй материал, пользуйся справочными материалами.
Итак, подведём итоги твоего пути: на сегодняшнем уроке ты стал ближе к миру науки, открыл для себя законы природы и приобрёл важные инструменты для дальнейшей успешной учебы. Молодец!Начало формы
Учитель выставляет отметки обучающимся, комментируя их.
8. Домашнее задание
Изучить §53, письменно выполнить №1 стр. 188,
Диф. задание:
1. Создай небольшую презентацию, объясняющую зависимость физических и химических свойств элементов от их положения в Периодической системе. Включите в неё описание влияния атомного номера, количества энергетических уровней и числа внешних электронов.
2. Нарисуй схему атома азота (N) и опиши его свойства, учитывая его положение в Периодической системе.







 Рис. 1. Калий в ПСХЭ
Рис. 1. Калий в ПСХЭ









