Конспект урока по химии на тему
«Общая характеристика растворов. Растворимость газов, жидкостей и твердых веществ.»
Цель урока: сформировать знания учащихся о растворение как о физико-химическом процессе и растворе как о физико-химической системе.
Задачи:
Образовательные: ввести понятия растворов, гидратов, разобрать типы растворов, классификацию растворов, факторы, влияющие на растворение веществ; основные положения физической, химической и современной теории растворов.
Развивающие : развивать умения и навыки мыслительной деятельности (умения обобщать, сравнивать, анализировать), общеучебные умения и навыки (формирование самостоятельной и познавательной деятельности учащихся);
Воспитательные : воспитывать положительное отношение к учению, способствовать осознанию роли знаний в развитии личности, воспитании характера, преодолении трудностей.
Средства: презентация, таблица растворимости веществ.
Тип урока: изучение нового материала.
Структура урока:
Организационный момент
Изучение нового материала
Домашнее задание
Ход урока:
Организационный момент
Приветствие учителя. Проверка готовности класса к уроку.
Изучение нового материала
Растворение – это физико – химический процесс, а растворы – это однородная (гомогенная) система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия – гидратов.
Гидраты – непрочные соединения веществ с водой, существующие в растворе.
Студенты записывают определения в тетрадь со слайда
Растворимость веществ. Типы растворов.
От чего зависит растворение веществ?
1) от природы веществ. - хорошо растворимые;
- малорастворимые;
-практически нерастворимые
Рассмотрите таблицу растворимости кислот, оснований и солей в воде, приведите примеры растворимых, малорастворимых и нерастворимых веществ (работа с таблицей растворимости).
2) от температуры
Классификация растворов:

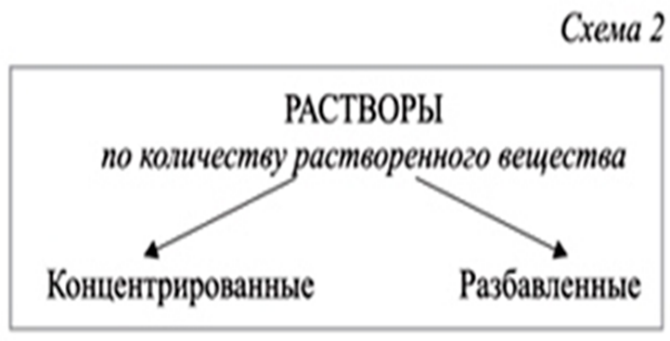
Концентрированный раствор — раствор с высоким содержанием растворённого вещества.
Разбавленный раствор- раствор, содержащий малое количество растворённого вещества. Работа с определениями.
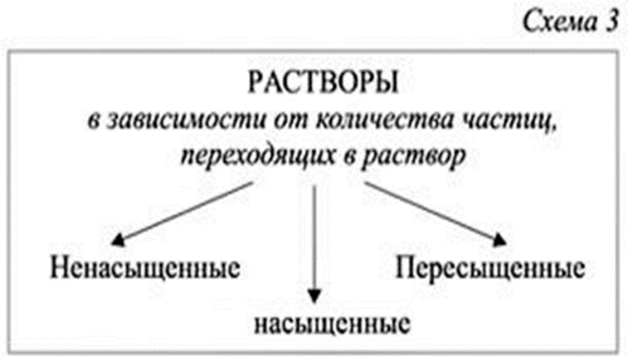
Студентам предлагается по изображению на презентации определить типы растворов.
Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется.
Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
Пересыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Под растворимостью понимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Растворимость зависит:
от природы растворенного вещества и растворителя;
от температуры;
от давления;
от присутствия третьих компонентов.
Влияние природыкомпонентов на растворимость определяется принципом:подобное растворяется в подобном. Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
Влияние температурына растворимость зависит от теплового эффекта растворения и определяется принципом Ле Шателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей - процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:Количество газа, растворенного в определенном объеме жидкости при постоянной температуре прямо пропорционально давлению газа.
c(X) = Kгp(X)
где c(X) – молярная концентрация газа,моль/л
Kг - константа Генри, моль/лПа
p(X) – давление газа над раствором, Па
Влияние присутствия третьих компонентов.
Растворимость газов в жидкостях значительно снижается в присутствии электролитов (солей) Этот процесс называют высаливанием.
Закон Сеченова:Растворимость газов в жидкостях в присутствии электролитов понижается.
С(X) = С0(X)
где С(X) – растворимость газа в присутствии электролита
С0(X) – растворимость газа в чистом растворителе
КС- константа Сеченова
Сэ- концентрация электролита
Биологическое значение законов Генри и Сеченова.
Изменение растворимости газов в крови при изменении давления может привести к тяжелым заболеванием. Кесонная болезнь у водолазов – проявление закона Генри. В соответствии с законом Сеченова растворимость кислорода и углекислого газа в крови зависит от концентрации электролитов, а также белков, липидов и других веществ.
Домашнее задание с. 109-114, 135-137


















