8 класс _________________ Дата
Тема урока: Оксиды: классификация, номенклатура, свойства оксидов, получение, применение
Тип урока: комбинированный урок
Цель урока: систематизация и углубление знаний учащихся об оксидах
Задачи урока:
Образовательные:
- изучить основные правила химической номенклатуры оксидов и научиться называть их;
- познакомить с классификацией оксидов;
- ввести понятия «основный оксид», «кислотный оксид», «амфотерный оксид»;
- познакомить с физическими и химическими свойствами оксидов;
- познакомить учащихся с основными способами получения оксидов;
- расширить знания о применении и значении оксидов в природе и жизни человека.
Развивающие:
развивать познавательный интерес, умение сравнивать, анализировать, обобщать, делать выводы.
Воспитательные:
воспитывать личностные качества, обеспечивающие успешность исполнительной деятельности (дисциплинированность, ответственность), творческой деятельности (активность, увлечённость, наблюдательность, сообразительность, способность к самооценке).
Планируемые результаты обучения:
Предметные - Знать определения основных и кислотных оксидов. Уметь классифицировать оксиды по составу и свойствам, сравнивать основные и кислотные оксиды, прогнозировать химические свойства оксидов на основании их состава, доказывать основный и кислотный характер оксидов.
Метапредметные - Развивать умения устанавливать аналогии, причинно-следственные связи, строить умозаключение и делать выводы, владеть устной речью, формулировать, аргументировать и отстаивать своё мнение.
Личностные - Формировать ответственное отношение к учению
Оборудование и материалы: Периодическая система химических элементов Д.И. Менделеева, карточки, образцы оксидов
| Ход урока | Деятельность учителя | Деятельность учащихся |
| Организационный этап | Приветствует учащихся, отмечает отсутствующих, настраивает обучающихся на работу. | Приветствуют учителя, готовятся к работе на уроке. |
| Проверка знаний ранее изученного материала и выполнения домашнего задания | Составить уравнения реакций: 1) горения кальция 2) горения меди. Медь, в образующимся соединении двухвалентна 3) горения бария 4) кальция с водой 5) калия с водой 6) оксида лития с водой 7) оксида марганца с водой | У доски и в тетрадях составляют уравнения реакций. |
| Актуализация знаний | Человека окружает огромное количество химических веществ. 1) На какие две группы все химические вещества делятся по составу? 2) Вспомните, какие вещества называются простыми? 3) Приведите примеры таких веществ? 4) А какие вещества называются сложными?
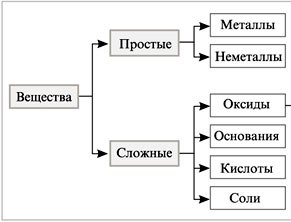 Записывает на доске примеры сложных веществ (CaO, H2O, BaO, K2O, Li2O, ZnO, CO2, CO, NO). Просит посмотреть на доску и предположить, о каком именно классе неорганических соединений мы будем сегодня говорить? Запишите тему урока и сформулируйте цель.
| Предполагаемые ответы: 1) на простые и сложные 2) Простыми называются вещества, которые образованны атомами одного химического элемента 3) O2, H2, Fe, Cu, Al и т.д. 4) Сложными называются вещества, которые образованы атомами разных химических элементов.
Предполагаемый ответ: об оксидах. Записывают в тетрадь тему урока: «Оксиды: классификация, номенклатура, свойства оксидов, получение, применение» |
| Изложение нового материала | Просит учеников дать определение оксидам. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентностью равной 2. Общая формула оксидов имеет следующий вид: RxOy , где R – элемент (металл или неметалл), O – кислород, x и y – индексы, которые показывают количество атомов химического элемента и кислорода в оксиде. Любое из химических соединений имеет определенное название, так и оксиды. Их название начинается со слова «оксид» с добавлением названия второго химического элемента (металла или неметалла). Попробуем назвать оксиды, записные на доске. Классификация оксидов В чем сходство этих химических соединений? ( Наличие кислорода, сложные вещества, состоят из 2-х элементов (бинарные). Сходство нашли. Теперь посмотрите внимательно и скажите, чем отличаются оксиды? Обратите внимание, что в одних оксидах атом кислорода связан с атомом металла, а в других оксидах – с неметаллом (CO2, H2O). В зависимости от того, с каким химическим элементом связан кислород, различают – КИСЛОТНЫЕ (оксиды неметаллов) и ОСНОВНЫЕ оксиды (оксиды металлов). Кроме того, выделяют несолеобразующие оксиды и амфотерные (их изучают позже). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3). Получение оксидов Как вы думаете, как можно получить оксиды? Оксиды получают двумя способами. 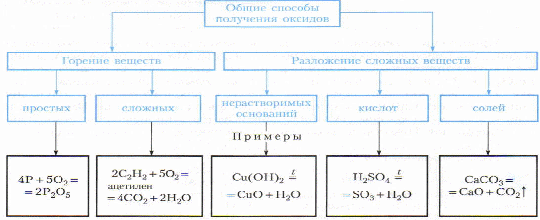 Физические свойства Любые вещества обладают физическими и химическими свойствами. Давайте вспомним, что относится к физическим свойствам? (Агрегатное состояние: твердое жидкое и газообразное, цвет, запах) Оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче воздуха. Вода - оксид, по агрегатному состоянию – жидкая. Если открыть бутылку воды, то мы слышим шипение и видим пузырьки выделяющегося газа – это оксид углерода (углекислый газ). Химические свойства оксидов Все оксиды, как кислотные, так и основные оксиды обладают разными свойствами (раздаточный материал – вклеить в тетрадь).  Значение оксидов в природе и жизни человека Значение оксидов в промышленности и быту, а также для природных процессов - велика. В промышленности: Fe2O3 и Fe3O4 – применяют в производстве чугуна (сплав железа с углеродом) и стали; CaO и SiO2 – производство строительных материалов;CO2 – в пищевой промышленности для производства газированных напитков; H2O – в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д. В быту: H2O – в питьевых и хозяйственных целях; SiO2 – входит в состав чистящих веществ; ZnO –входит в состав белой краски. В природных процессах: H2O и CO2 – обеспечивают осуществление процессов фотосинтеза; H2O – естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д. |
Слушают учителя, отвечают на вопросы, делают записи в тетрадях |
| Физкультурная минутка | Делегирует полномочия по проведению физминутки одному из учащихся. | Один из обучающихся проводит минутку отдыха. Остальные ученики повторяют физические упражнения |
| Закрепление знаний | Продолжить уравнения реакции: CаO + HCl= CaO+H2O= CuO+H2SO4=
CuO + H2 = BaO + HNO3=
Работа по карточкам (Приложение 2) | 1) Для выполнения задания ученики по очереди выходят к доске. 2) Самостоятельно выполняют задания в карточках |
| Рефлексивный этап | Выберите фразеологизм или пословицу, которые характеризуют вашу работу сегодня: Шевелить мозгами, Краем уха, Хлопать ушами, Считать ворон | Самооценка учениками собственной учебной деятельности. |
| Итоговый этап | Оценивание работы учеников на уроке Д.З. §30, упр. 1,3, 4, 6
| Ученики открывают дневники и учебники и записывают домашнее задание, выставляют оценки, подают дневники на роспись учителю |
Приложение 1

Приложение 2
Задание 1
Даны вещества:
CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2, CO2, N2O, FeO,SO3, Na2SO4,
ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3
Подчеркните формулы оксидов и подпишите над ними их тип (кислотные – К, основные – О, амфотерные – А, несолеобразующие – Н)
Задание 2
Только кислотные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 3
Только основные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 1
Даны вещества:
CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3,
Zn(OH)2, N2O5, Al2O3, Ca(OH)2, CO2, N2O,
FeO,SO3, Na2SO4,
ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3
Подчеркните формулы оксидов и подпишите над ними их тип (кислотные – К, основные – О, амфотерные – А, несолеобразующие – Н)
Задание 2
Только кислотные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 3
Только основные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 1
Даны вещества:
CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3,
Zn(OH)2, N2O5, Al2O3, Ca(OH)2, CO2, N2O,
FeO,SO3, Na2SO4,
ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3
Подчеркните формулы оксидов и подпишите над ними их тип (кислотные – К, основные – О, амфотерные – А, несолеобразующие – Н)
Задание 2
Только кислотные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 3
Только основные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 1
Даны вещества:
CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3,
Zn(OH)2, N2O5, Al2O3, Ca(OH)2, CO2, N2O,
FeO,SO3, Na2SO4,
ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3
Подчеркните формулы оксидов и подпишите над ними их тип (кислотные – К, основные – О, амфотерные – А, несолеобразующие – Н)
Задание 2
Только кислотные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 3
Только основные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 1
Даны вещества:
CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3,
Zn(OH)2, N2O5, Al2O3, Ca(OH)2, CO2, N2O,
FeO,SO3, Na2SO4,
ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3
Подчеркните формулы оксидов и подпишите над ними их тип (кислотные – К, основные – О, амфотерные – А, несолеобразующие – Н)
Задание 2
Только кислотные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3
Задание 3
Только основные оксиды расположены в ряду:
1) CaO, Fe2O3
2) N2O5, Na2O
3) N2O5, CO2
4) CuO, Al2O3




















