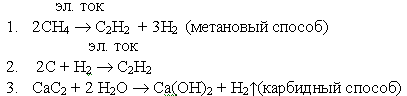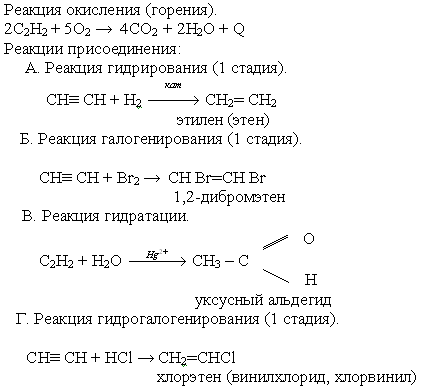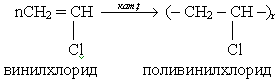Цели урока:
Познакомить учащихся с гомологическим рядом, изомерией, номенклатурой алкинов, рассмотреть способы получения ацетилена (карбидный и метановый);рассмотреть химические свойства алкинов: реакции присоединения, горения; полимеризацию винилхлорида; рассмотреть применение поливинилхлорида.
Развить представление об углеводородах.
Содействовать валеологическому воспитанию на примере утилизации твердых бытовых отходов на основе ПВХ.
Тип урока: урок изучения нового материала в форме лекции с элементами беседы и самостоятельной работы.
Методы организации и осуществления учебно-познавательной деятельности: словесный, наглядный, метод самостоятельной работы (работа в парах).
Оборудование:
Компьютерная презентация (Приложение);
карбид кальция, прибор для получения газов, растворы перманганата калия, вода, спиртовка, спички;
ученические столы: набор моделей атомов, карточки с заданием для самостоятельной работы.
Ход урока
1. Организационный момент
Учитель: Сегодня на уроке мы продолжим изучать большую тему “Углеводороды”, будем знакомиться с новым классом соединений, изучим особенности их строения, номенклатуру, изомерию, конечно, свойства и получение его типичного представителя.
Изучение нового материала.
(Перед изучением нового материала проводится фронтальная беседа по некоторым ранее изученным вопросам)
Учитель: Какие вещества называются углеводородами?
Ученик: Углеводороды – это органические соединения, которые состоят из двух элементов – углерода и водорода.
Учитель: Какие типы углеводородов известны? Чем они отличаются по строению друг от друга?
Ученик: Углеводороды бывают предельные и непредельные. Предельные углеводороды в своем составе содержат одинарные углерод-углеродные связи, а непредельные – кратные.
Учитель: Назовите классы непредельных углеводородов и особенности их строения.
Ученик: К непредельным углеводородам относятся алкены и алкадиены. У алкенов между атомами углерода существует одна двойная связь, а у алкадиенов – две двойных связи.
Строение, номенклатура и изомерия алкинов
Учитель: Среди указанных веществ выберите вещество, которое не относится ни к одному из изученных классов углеводородов, запишите его в тетрадь: (Слайд 2)
СН3 – СН3
СН2 = СН2
СН ≡ СН
СН2 = СН – СН = СН2
Ученик: Вещество под № 3 не относится к изученным классам соединений, так как 1 вещество принадлежит к алканам, 2 – к алкенам, 4 – к алкадиенам.
(Выбранное учениками вещество на слайде выделяется цветом)
Учитель: Запишите молекулярную формулу 3 вещества в тетрадь.
Ученики: С2Н2
Учитель: Называется это вещество ацетилен. Название этому веществу дал в 1860 г. французский химик Марселен Бертло. (Слайд 2)
Учитель: Давайте выясним, каковы особенности строения этого вещества?
Ученик: В молекуле ацетилена два атома углерода связаны тройной связью.
Учитель: Соберите из набора атомов шаростержневую модель этого вещества.
(Учащиеся работают в парах)
Учитель: Ацетилен – это вещество, которое является родоначальником нового класса непредельных углеводородов. Давайте вместе выведем общую формулу алкинов. Общая формула алканов CnH2n+2. В алкенах за счет отщепления двух атомов водорода образуется двойная связь, общая формула CnH2n. В алкинах появляется тройная связь, следовательно, они содержат на два атома водорода меньше. Значит, какую общую формулу будут иметь алкины?
Ученик: Общая формула алкинов CnH2n-2
Учитель: Давайте поиграем в хорошо известную вам игру “Крестики-нолики”. Выигрышный путь составляют формулы, которые могут соответствовать алкинам: (Слайд 3)
| С2Н2 | С10Н22 | С7Н16 |
| С6Н12 | С4Н6 | С5Н10 |
| С5Н8 | С4Н8 | С3Н4 |
(Один ученик показывает выигрышный путь на интерактивной доске)
| С2Н2 | С10Н22 | С7Н16 |
| С6Н12 | С4Н6 | С5Н10 |
| С5Н8 | С4Н8 | С3Н4 |
Учитель: Кроме ацетилена известны другие углеводороды, имеющие сходное с ним строение. Из приведенного перечня веществ выпишите в тетрадь алкины: (Слайд 4)

(Проверка задания. Углеводороды, которые относятся к алкинам, на слайде выделяются синим и красным цветом)
Учитель: Давайте вместе сделаем вывод по первой части урока. Какие углеводороды называются алкинами?(Учащиеся могут воспользоваться учебником, стр. 47)
Ученики: Алкины – непредельные углеводороды, молекулы которых содержат одну тройную углерод-углеродную связь. Состав отражает формула: CnH2n-2.
Учитель: Далее отметим особенности номенклатуры ацетиленовых углеводородов. В названиях алкинов используется суффикс –  . Вспомните правила, которые следует соблюдать, давая название органическим веществам.
. Вспомните правила, которые следует соблюдать, давая название органическим веществам.
Ученики: В структурной формуле выбирается самая длинная цепь, которая обязательно должна содержать кратную связь. Атомы углерода основной цепи нумеруют, начиная с того конца, к которому ближе кратная связь. В начале названия перечисляют радикалы с указанием атомов углерода, с которыми они связаны. Основой названия служит наименование предельного углеводорода (с измененным суффиксом) с тем же числом атомов углерода, что и в главной цепи.
Учитель: Назовите выписанные вами алкины.
(Учащиеся самостоятельно выполняют задание в тетради, проверка выполняется устно, правильные варианты ответов отображаются на сайде 4)
Ученики:
Учитель: Я предлагаю вам внимательно рассмотреть структурные формулы веществ (1) и (4). (На слайде они выделены красным цветом) Чем они отличаются по строению?
Ученики: Вещества 1 и 4 различаются положением тройной связи.
Учитель: Чем эти вещества являются по отношению друг к другу?
Ученик: Вещества пентин-1 и пентин-2 являются изомерами.
Учитель: Вспомните, как называется такой вид изомерии.
Ученик: Изомерия положения кратной связи.
Учитель: Какой еще вид изомерии характерен для углеводородов?
Ученик: Для углеводородов характерна изомерия углеродного скелета.
Способы получения ацетилена
Учитель: А теперь поподробнее остановимся на свойствах ацетилена, способах его получения. Ацетилен – газ, без запаха, малорастворим в Н2О, легче воздуха.
Учитель: Зная, что у ацетилена на два атома водорода меньше, чем у этилена, предложите способ его получение. Напишите соответствующее уравнение реакции в тетрадь.
Ученик: Поскольку ацетилен имеет на 2 атома водорода меньше, чем этилен, то его можно получить реакцией дегидрирования.
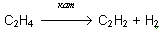
(1 ученик записывает уравнение реакции на доске, учащиеся на местах делают записи в тетради)
Учитель: С другими способами получения ацетилена я предлагаю вам ознакомиться самостоятельно. (Ученики работают по карточкам в тетради)
Способы получения ацетилена
Ацетилен был открыт Г.Дэви в 1836 году в продуктах разложения метана, под действием искровых электрических разрядов (Справка в § 3, стр. 29).
В 1860 г. М. Бертло синтезировал ацетилен из простых веществ, пропуская водород через электрическую дугу между угольными электродами.
В 1862 г. Ф.Велер получил ацетилен из карбида кальция, действуя на него водой (Справка в § 6, стр. 44).
Напишите уравнения упомянутых в данном тексте реакций.
(Результаты работы проверяются с помощью слайда 5)
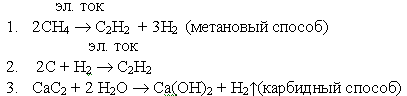
Химические свойства ацетилена
Учитель: Мы знаем, что ацетилен – непредельное соединение. Как доказать непредельность этого соединения?
Ученик: С моей точки зрения для доказательства непредельности ацетилена можно использовать растворы KMnO4 и Br2.
Учитель проводит демонстрационные опыты (получение ацетилена из карбида кальция, обесцвечивание раствора перманганата калия), подтверждающие выдвинутую гипотезу.
Демонстрация видеоролика “Обесцвечивание бромной воды ацетиленом”
Учитель: Учитывая особенности строения ацетилена, предположите, какими еще свойствами это вещество может обладать?
Ученики: Поскольку ацетилен является непредельным соединением, поэтому он может вступать в реакции присоединения, как все углеводороды горит.
Учитель: Реакция горения сопровождается выделением большого количества теплоты, она используется для резки и сварки металлов.
Демонстрация видеоролика “Взаимодействие ацетилена с кислородом”.
Ученики записывают уравнения реакций в тетрадь, пользуясь опорным конспектом учебника на стр. 182, называют продукты реакций, параллельно делаются записи на интерактивной доске (Слайд 8) или обычной.
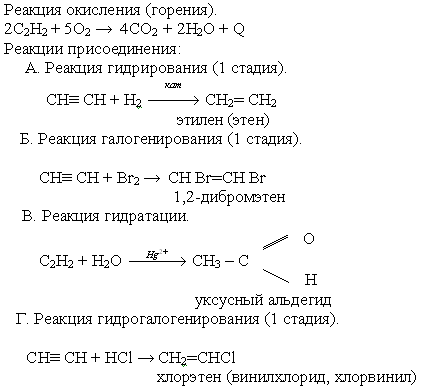
Учитель: Винилхлорид является исходным сырьем для получения полимера – поливинилхлорида. (Учитель записывает уравнение реакции на доске)
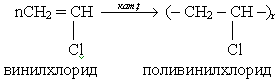
При полимеризации винилхлорида образуется поливинилхлорид, который находит широкое применение. Но у экологов отношение к этому полимеру неоднозначное. Давайте послушаем подготовленное по этому вопросу сообщение “Поливинилхлорид: друг или враг?”
Ученик: Человеческое общество по мере своего развития входит все в большую зависимость от полимерных материалов. Материалов с такими свойствами, которыми не обладают природные соединения.
Целью моей работы было:
1) изучить свойства и области применения поливинилхлорида (ПВХ);
2) изучить проблемы, связанные с утилизацией этого полимера.
Поливинилхлорид по своему составу и строению можно рассматривать как хлорпроизводное полиэтилена. ПВХ устойчив к действию кислот и щелочей, обладает хорошими диэлектрическими свойствами, большой механической прочностью, он практически не горит, однако сравнительно легко разлагается при нагревании, выделяя хлороводород.
На основе ПВХ получают пластмассы 2-х типов: винипласт, обладающий значительной жесткостью, и пластикат – более мягкий материал.
Из винипласта готовят химически стойкие трубы, детали химической аппаратуры, аккумуляторные банки. Пластикат идет на изготовление линолеума, искусственной кожи, клеенки, изоляции проводов.
Важной экологической проблемой, связанной с использованием ПВХ, является скопление твердых отходов, изготовленных из этого полимера. Они препятствуют газообмену в почвах и водоемах, выделяют токсичные для живых организмов вещества, медленно окисляются кислородом, очень медленно разрушаются под воздействием солнечных лучей. Конечным продуктом разложения являются: углекислый газ, вода, хлороводород. Время разложения полимера на земле и в пресной воде составляет несколько сотен лет. Способов вторичной переработки его не существует. ПВХ категорически запрещено сжигать, так как при этом образуются ядовитые хлорорганические соединения. Ученые установили, пребывание у костра в течение часа, где сжигают ПВХ, для организма равнозначно нахождению на оживленной автомагистрали.
Из вышесказанного можно сделать следующий вывод. ПВХ является ценным продуктом химической промышленности, но при утилизации этого полимера следует соблюдать определенные меры безопасности. Сжигать его нельзя! (Слайды 9–11) Приложение
Закрепление изученного материала
Учитель: Мы закончили изучение ацетиленовых углеводородов. Вам я предлагаю совершить “Подъем по лестнице знаний”, составив рассказ об алкинах. (Слайд 12)
Особенности строения.
Общая формула.
Родовой суффикс.
Изомерия алкинов.
Способ получения
Характерные химические свойства.
Применение.
Ученики рассказывают об алкинах, на каждый пункт дает ответ отдельный ученик.
Резервное задание. (Разбирается вместе с учениками)
Какие реакции лежали в основе принципа действия карбидных фонарей, применяемых для освещения в 19-ом веке?
Решение: В фонарь, наполненный карбидом кальция, по каплям поступала вода, а получившийся ацетилен поступал в горелку и использовался для освещения:
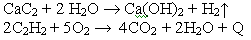
Учитель подводит итог урока, оценивает работу наиболее активных учеников.
Домашнее задание: § 6, № 4, № 6 (по желанию)
Литература:
Беспалов П.И. Модульные программы при изучении органической химии. Ч. 1 – М.: Центрхимпресс, 2003.
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М: Дрофа, 2006.
Габриелян О.С. Химия. 10 класс: рабочая тетрадь к учебнику О.С. Габриеляна “Химия. 10 класс. Базовый уровень”. – М: Дрофа, 2007.
Дмитров Е.Н. Познавательные задачи по органической химии и их решения: Пособие для учителей и учащихся.– Тула: Арктоус, 1996. – 86 с.
Кузьменок Н.М., Стрельцова Е.А., Кумачев А.И. Экология на уроках химии. – Мн.:Изд. ООО “Красико-принт”, 1996.
Электронные учебные пособия:
Химия (8–11-й класс). Виртуальная лаборатория. – Лаборатория систем мультимедиа, МарГТУ, 2004.