Тема урока: Степень окисления. Определение степени окисления по химической формуле вещества
Цель урока: Дать понятие "степень окисления", научить различать понятия "степень окисления" и "валентность"; научить определять степень окисления атома элемента по формуле соединения, а также по строению атомов, которые образуют эти соединения.
Тип урока: Усвоение новых знаний, умений и навыков.
Организационный этап
Актуализация опорных знаний
Какие типы связей вы знаете? (ионная, ковалентная полярная и неполярная, металлическая).
Что такое электроотрицательность? (ЭО — способность атомов притягивать валентные электроны других атомов).
Как изменяется электроотрицательность элементов в периодах и группах периодической системы? (ЭО увеличивается в группах снизу вверх, в периодах справа налево (увеличивается к F)).
Что такое валентность? Валентность — это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Как определять валентность с помощью Периодической системы химических элементов?
Высшая валентность химического элемента обычно равняется номеру группы, в которой он находится.
В большинстве случаев валентность равняется числу неспаренных электронов в атоме. Неметаллические элементы могут проявлять разные валентности.
Атом хлора в обычном состоянии проявляет валентность равную І (содержит один неспаренный электрон).
Низшая валентность 8-(минус)номер группы в которой расположен элемент.
У металлов группы А валентность постоянная, равна номеру группы.
Изучение нового материала
При изучении ионной и ковалентной связи, мы встречали такие соединения.
При образовании молекулы NaCl, Na отдаёт свой электрон атому Cl, при этом они оба превращаются в ионы Na+ и Cl-.
При образовании молекулы HCl, общая пара электронов смещена к атому Cl, т.к. он более электроотрицательный и на атомах появляются частичные заряды: на атоме H+δ, на атоме Cl-δ. Если предположить, что электрон от Н полностью перешёл к атому Cl, то их заряды будет не частичные, а +1 и –1: H+1 и Cl-1. Эти условные заряды и называют степенью окисления.
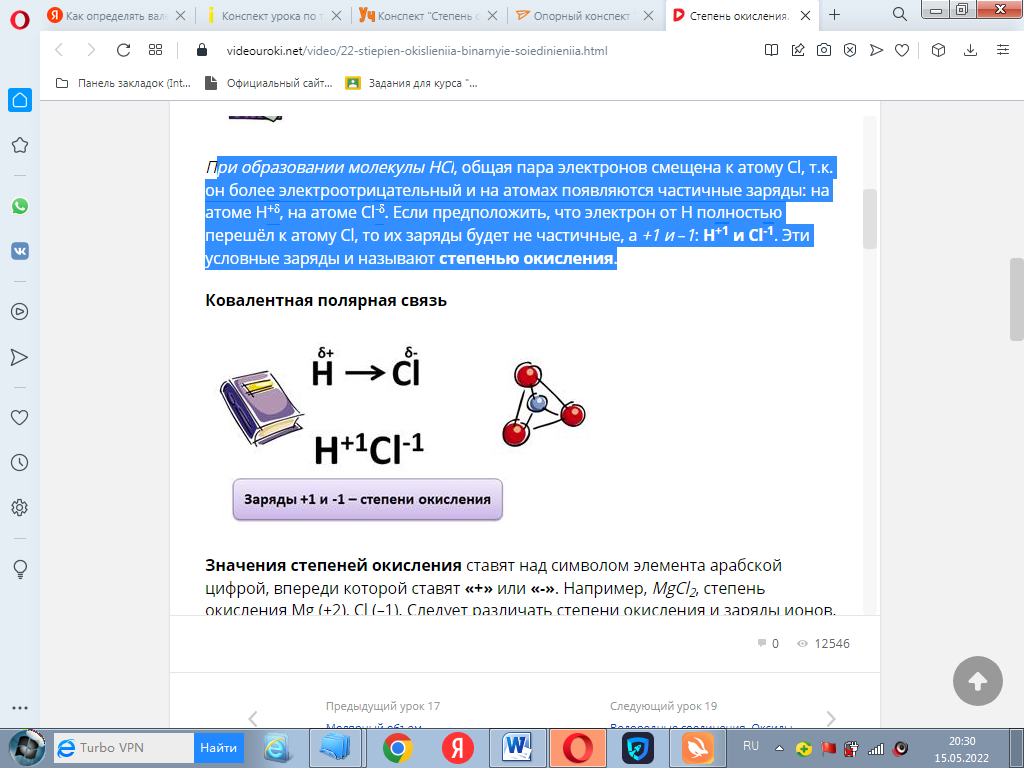


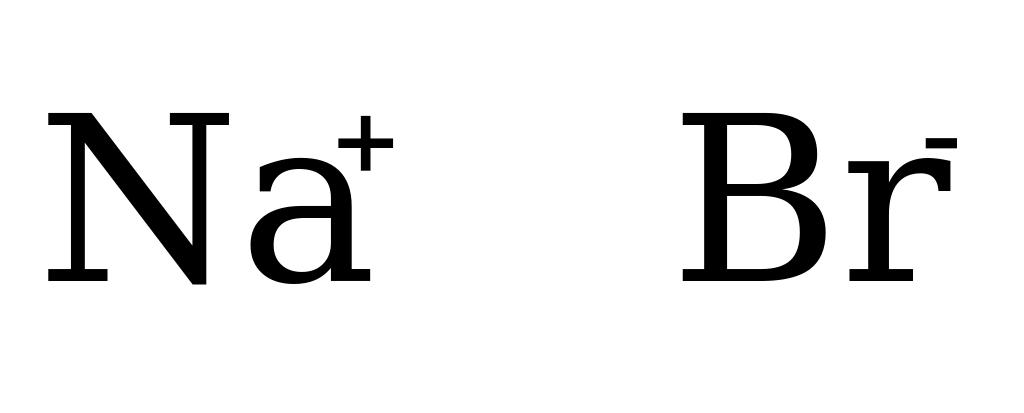
Значения степеней окисления ставят над символом элемента арабской цифрой, впереди которой ставят «+» или «-». Например, MgCl2, степень окисления Mg (+2), Cl (–1). Следует различать степени окисления и заряды ионов. Например, в молекуле NaCl, степень окисления Na (+1), а Cl (–1). В зарядах этих ионов цифры опускают и записывают ионы Na+, Cl-.
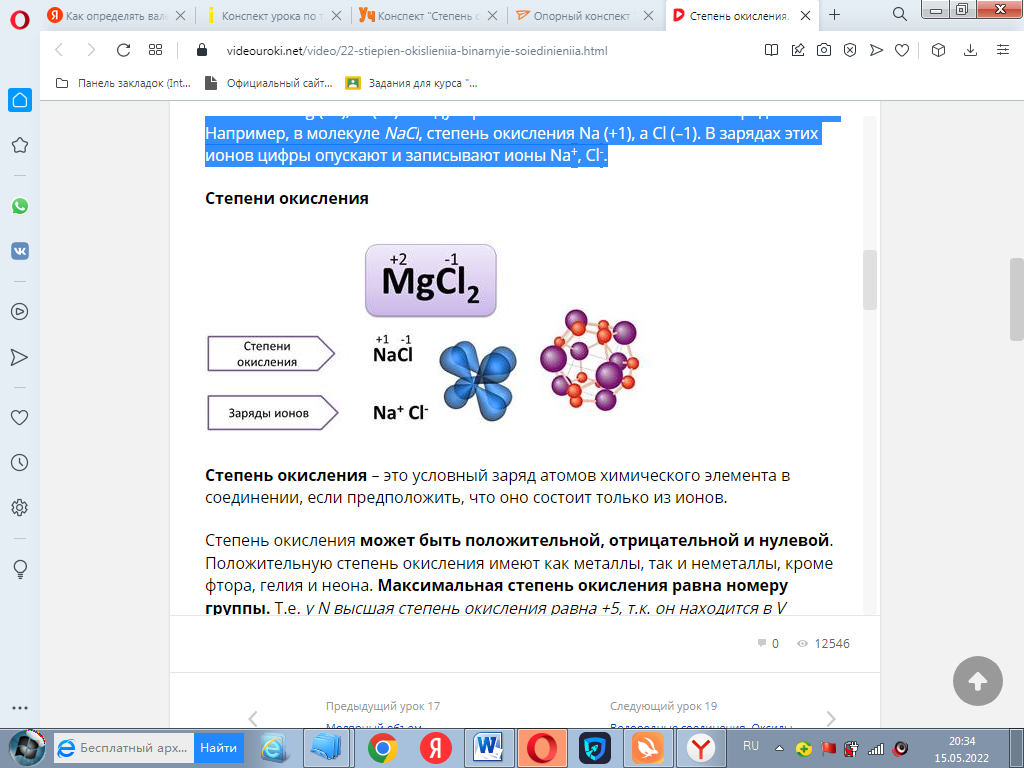
Степень окисления может быть положительной, отрицательной и нулевой.
Положительную степень окисления имеют как металлы, так и неметаллы, кроме фтора, гелия и неона.
Максимальная степень окисления равна номеру группы. Т.е. у N высшая степень окисления равна +5, т.к. он находится в V группе.
Отрицательную степень окисления имеют только неметаллы, т.к. они присоединяют электроны до завершения внешнего уровня.
Минимальная степень окисления равна № группы – 8. Т.о. у N минимальная степень окисления будет 5 – 8 = –3. Кроме максимальной и минимальной степени окисления есть еще промежуточная степень окисления. Например, у N она равна +3.
Степень окисления простых веществ равна 0, т.е. у N2, H2, S8, Cu, O3 и др. простых веществ она – 0.
Степень окисления F всегда –1, потому что он самый электроотрицательный элемент и принимает электроны при образовании химической связи. Например, в соединении NaF, у F степень окисления (–1).
У кислорода степень окисления –2, потому что он второй элемент по электроотрицательности, исключение cоставляет соединение кислорода с фтором, где его степень окисления +2. Например, в соединении CaO, степень окисления О (–2), а в соединении OF2, степень окисления О (+2).
У металлов степень окисления всегда положительная, т.к. они отдают электроны другим атомам. Степень окисления металлов А групп численно совпадает с валентностью.
Например, в соединении Na2O степень окисления Na (+1), т.к. он является металлом, значит, у него только положительная степень окисления, а 1, потому что он является металлом I A группы, значит, и валентность его – единица.
Аналогично и в соединении BaS, степень окисления Ва (+2), т.к. он металл II A группы, в соединении Al2O3, степень окисления Al (+3), т.к. это металл III А группы.
Степень окисления Н всегда (+1), за исключением его соединений с металлами, где у него степень окисления (–1). Например, CaH2, KH, LiH, в этих соединениях у водорода степень окисления (–1).
Как было сказано, валентность численно совпадает со степенью окисления. Однако не всегда. Степень окисления имеет знак заряда, а валентность – нет.
Закрепление знаний
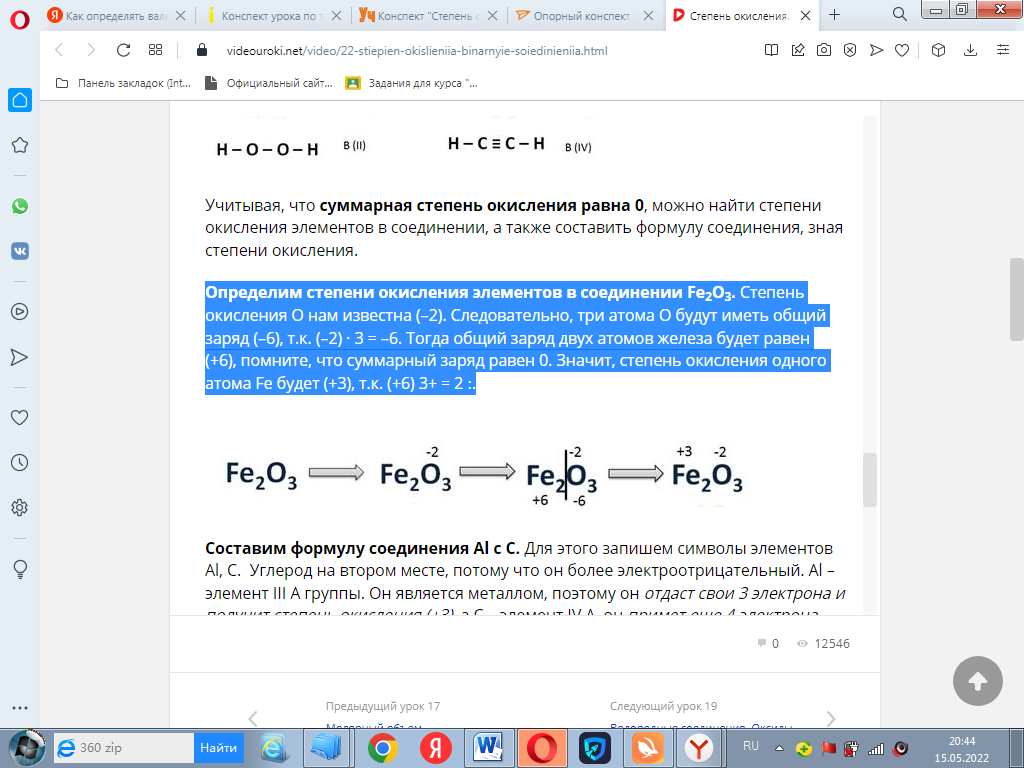
Определим степени окисления элементов в соединении Fe2O3. (Объяснение не писать, только пример переписать).
Степень окисления О нам известна (–2). Следовательно, три атома О будут иметь общий заряд (–6), т.к. (–2) · 3 = –6. Тогда общий заряд двух атомов железа будет равен (+6), помните, что суммарный заряд равен 0. Значит, степень окисления одного атома Fe будет (+3), т.к. (+6) ׃ 2 = +3
Молекула в целом электронейтральна, имеет заряд ноль (сколько минусов столько и плюсов).
Составим формулу соединения Al с C
Для этого запишем символы элементов Al, C. Углерод на втором месте, потому что он более электроотрицательный. Al – элемент III A группы. Он является металлом, поэтому он отдаст свои 3 электрона и получит степень окисления (+3), а С – элемент IV A, он примет еще 4 электрона для завершения своего внешнего уровня, на котором уже есть 4 электрона, при этом получит степень окисления (–4). Запишем значения степеней окисления в формулу сверху. Теперь найдем наименьшее общее кратное. Оно будет 12. Затем НОК разделим на абсолютные значения степеней окисления и получим соответствующие индексы. 12 : 3 = 4, значит индекс у Al – 4, 12 : 4 = 3, значит индекс у С – 3. Следовательно, формула будет Al4C3.

Подведем итог: (переписать по желанию в конец тетради)
Алгебраическая сумма степеней окисления всех атомов в веществе равна нулю. 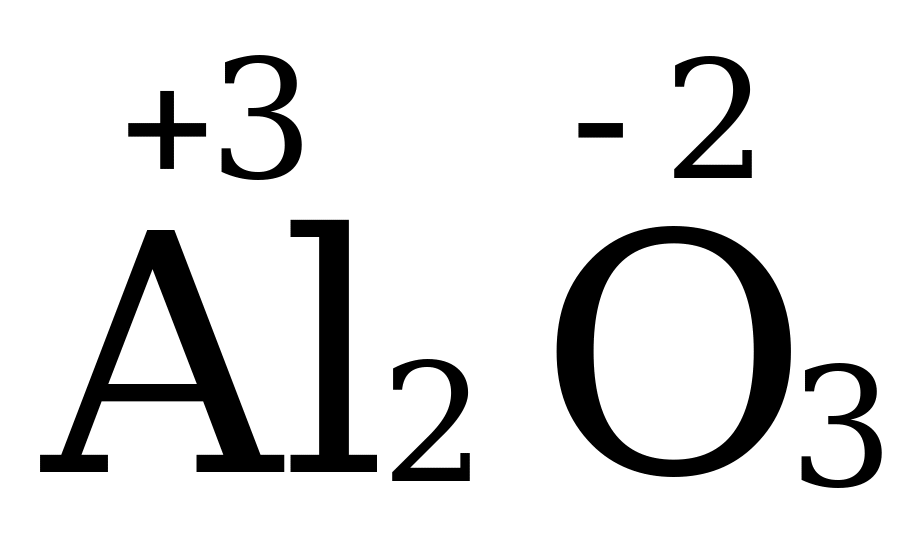 +3 · 2 + (-2) · 3 = 0
+3 · 2 + (-2) · 3 = 0
Степень окисления элементов в простых веществах равна нулю. 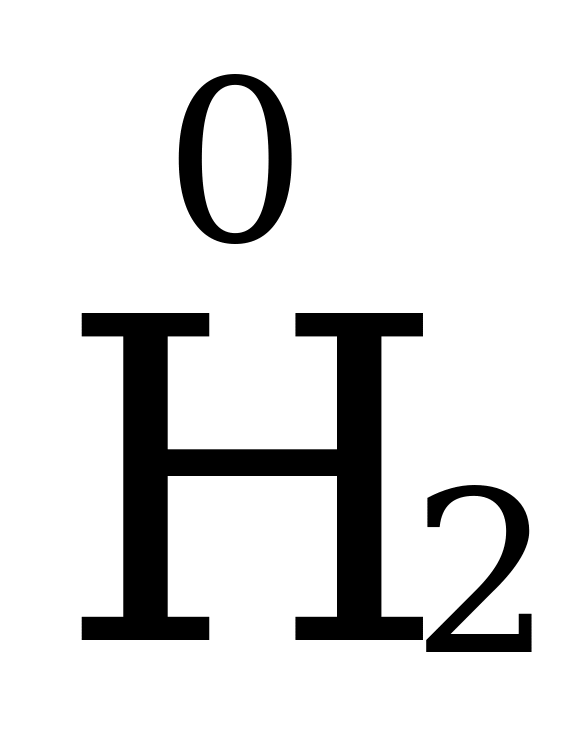 ,
, 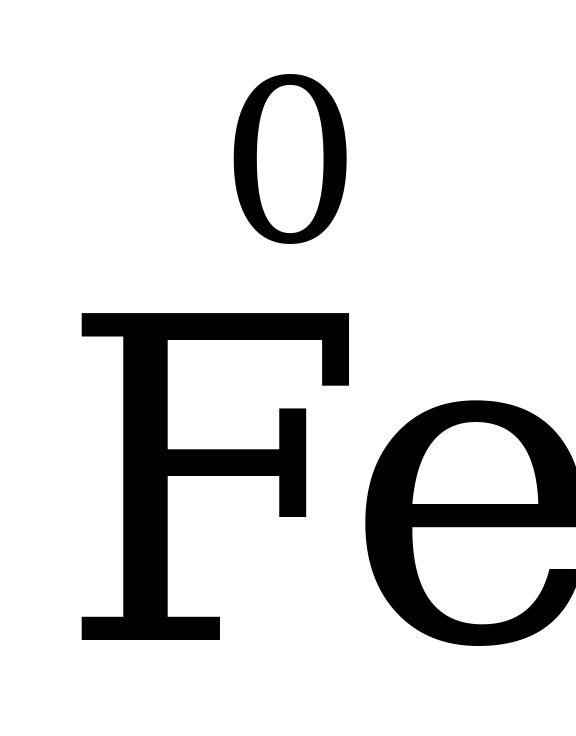 ,
, 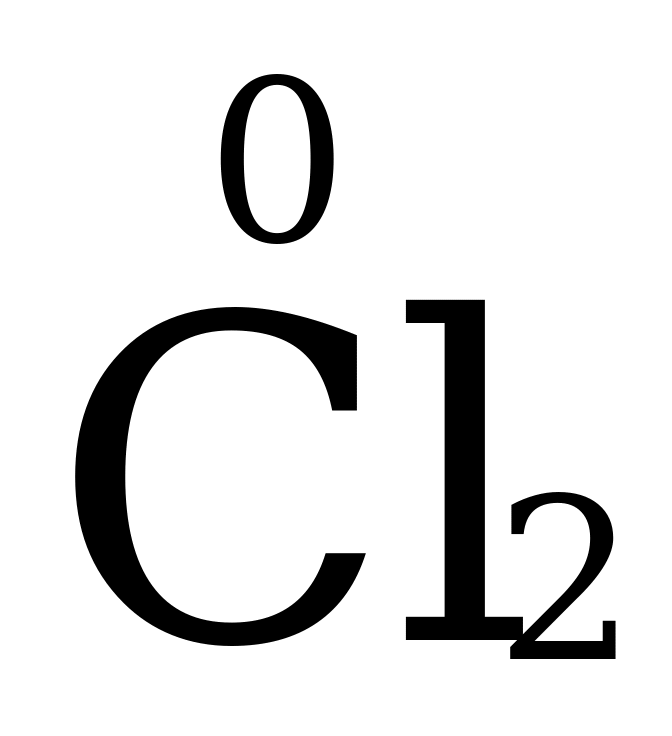 ,
, 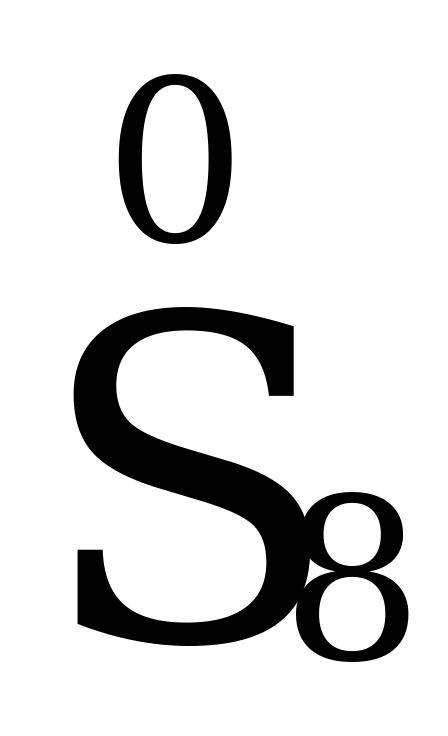 .
.
Металлические элементы имеют в соединениях положительную степень окисления.
Максимальная (положительная) степень окисления элемента совпадает с номером группы, в которой он находится (для элементов главной подгруппы).
Минимальная (отрицательная) степень окисления неметаллического элемента равняется номеру группы минус 8.
Степень окисления фтора (F) всегда равна -1.
Степень окисления водорода в соединениях с неметаллическими элементами равна +1 (за исключением гидредов металлов NaH, CaH2, в которых равна -1).
Степень окисления кислорода в соединениях составляет -2 (за исключением OF2, в которых равна +2, и пероксидов Na2O2, H2O2, где степень окисления равна -1).
Закрепление (примеры переписать)
Домашнее задание
Изучите §56
Определите степени окисления для: СО2, Н2О, Н2, NaCl, OF2, Ca, O3, HF.





















