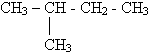Цель урока: познакомить учащихся с алканами и выявить важную их роль в промышленности.
Задачи урока:
Образовательная: рассмотреть гомологический ряд предельных углеводородов, строение, физические и химические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля.
Развивающая: развить понятие о пространственном строении алканов; развитие познавательных интересов, творческих и интеллектуальных способностей, развитие самостоятельности в приобретении новых знаний с использованием новых технологий.
Воспитательная: показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля.
Оборудование: компьютер, мультимедиа проектор, экран, презентация.
Ход урока
I. Организационный момент. (Сообщить цель и тему урока).
II. Изученного нового материала.
| Учитель | № слайда |
|
| Тема урока: "Алканы". | 1 |
|
| План изучения алканов. Определение. Общая формула класса углеводородов. Гомологический ряд. Виды изомерии. Строение алканов. Физические свойства. Способы получения. Химические свойства. Применение. | 2 |
|
| Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (?-) и имеют общую формулу: CnH2n+2 | 3 |
|
| - Что такое гомологи? Гомологический ряд метана СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16 гептан C8H18 октан C9H20 нонан C10H22 декан | Ученик | 4 |
| Гомологи - это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH2. |
| Структурная изомерия: 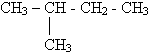
Алгоритм. 1. Выбор главной цепи: 
| 5 |
|
| 2. Нумерация атомов главной цепи: 
| 6 |
|
| 3. Формирование названия: 
2 - метилбутан | 7 |
|
| Строение алканов. Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, т. е. Имеет на внешнем уровне четыре неспаренных электрона. Каждое электронное облако обладает запасом энергии: s- облако имеет менший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается наформе и направленности облаков, происходит перестройка (пространственная) электронных облаков. В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28', поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними. Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию. | 8 9 10 11 12 13 |
|
| Физические свойства. СН4:C4Н10 - газы T кипения: -161,6:-0,5 °C T плавления: -182,5:-138,3 °C С5Н12:C15Н32 - жидкости T кипения: 36,1:270,5 °C T плавления: -129,8:10 °C С16Н34:и далее- твёрдые вещества T кипения: 287,5 °C T плавления: 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления. | 14 |
|
| Получение. В промышленности 1) крекинг нефтепродуктов: C16H34 - C8H18 + C8H16 2) В лаборатории: а) Гидролиз карбидов: Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3 б) Реакция Вюрца: C2H5Cl + 2Na - C4H10 + 2NaCl в) Декарбоксилирование натриевых солей карбоновых солей: СН3СООNa + 2NaОН - СН4 + Nа2СО3 + Nа2СО3 | 15 16 |
|
| Химические свойства Для алканов характерны следующие типы химических реакций: | 17 |
|
| 1) Замещение атомов водорода: А) Реакция галогенирования: CH4 +Cl2 - CH3Cl + HCl Б) Реакция нитрования (Коновалова): CH4 + HNO3 - CH3-NO2 + H2O + Q В) Реакция сульфирования: CH4 + H2SO4 - CH3-SO3 H + H2O + Q 2) Реакция изомеризации: CH3-CH2-CH2-CH2-CH3 -  3) Реакция с водяным паром: CH4 + H2O - CO + 3H2 4) Реакция дегидрирования: 2СН4 НС=СН + 3Н2 + Q 5) Реакция окисления: CH4 + 2O2 - Н-C + 2H2O + Q 6) Горение метана: CH4 + 2O2 CO2 + 2H2O + Q | 18 19 20 |
|
| Применение. (Возможно, заранее подготовленные выступления учащихся.) Широко используются в качестве топлива, в том числе для двигателей внутреннего сгорания, а также при производстве сажи (1 - картрижи; 2 - резина; 3 - типографическая краска), при получение органических веществ (4 - растворителей; 5 - хладогентов, используемых в холодильных установках; 6 - метанол; 7 - ацетилен) | 21 22 |
|
III. Закрепление.
Составьте все возможные изомеры для гептана и назовите их.
Составьте 2 ближайших гомолога для пентана и назовите их.
Определить предельный углеводород, плотность паров которого по воздуху равна 2. (C4H10).
Учебник: №12 (стр. 33).
IV. Домашнее задание: Учебник О.С. Габриелян (10 класс базовый уровень): ᄃ 3, упр. 4, 7, 8 (стр. 32).
Литература.
Горковенко М. Ю. Поурочные разработки по химии к учебным комплектам О. С. Габриеляна и др., 10 (11) класс. М.: "ВЕКО", 2005 г.
Рыбникова З.Д., Рыбников А. В. Органическая химия. 10 класс: Ключевые темы. Конспекты занятий. Контрольные и проверочные работы. - М.: Айрис - пресс, 2003 г.
Ульянова Г. М. Органическая химия. 10 класс: Методическое пособие. - СПб.: "Паритет", 2003 г.