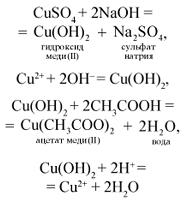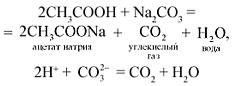Тема урока: Карбоновые кислоты.
Цели. Образовательные: Изучить состав, классификацию и представители кислот. Способствовать формированию умения экспериментировать, наблюдать, анализировать, делать выводы. Показать связь между свойствами веществ, их получением и применением.
Развивающие: развивать интеллектуальные умения – выделять главное, анализировать, сравнивать, делать выводы, использовать ранее накопленные знания по химии в контексте нового материала, расширять научную лексику в результате введения в активный словарь новых терминов, формирование культуры умственного труда.
Воспитательные: воспитывать коммуникативные навыки, формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую мотивацию к изучению химии на основании положительного эмоционального восприятия предмета.
Планируемые результаты обучения.
Знать строение функциональной группы карбоновых кислот; физические и химические свойства карбоновых кислот( общие и специфические).
Уметь объяснять взаимное влияние атомов в функциональной группе, образование водородной связи между молекулами карбоновых кислот, влияние ее на физические свойства; кислотные свойства карбоновых кислот.
Оборудование и материалы:
Компьютер, мультимедийный проектор, экран.
Лабораторное оборудование и реактивы: Раствор уксусной кислот, раствор сульфата меди(II), порошок оксида магния, лакмус, растворы гидроксида натрия, карбоната натрия.
Таблицы и дидактические материалы к уроку: «Физические свойства некоторых предельных одноосновных карбоновых кислот», «Водородная связь между молекулами карбоновых кислот».
ХОД УРОКА
Ум заключается не только в знаниях,
но и в умении применять знания на деле…
Аристотель
Урок начинается с игры «Черный ящик», в ходе которой формулируются тема, цели и задачи урока.
Учитель. Вам уже известны общие физические свойства карбоновых кислот, знаете вы и строение функциональной группы, номенклатуру этих кислородосодержащих органических соединений. А хорошо ли вам знакомы отдельные представители этого класса соединений?
1 . Задание «Черный ящик».
. Задание «Черный ящик».
1-е в е щ е с т в о. внимание на экран
У меня в черном ящике находится удивительное, но хорошо вам знакомое вещество. Название этого вещества древними греками отождествлялось с самим представлением о кислом. Нам оно хорошо известно в жидком агрегатном состоянии, но при охлаждении ниже 17 °С превращается в бесцветные кристаллы, похожие на лед.
О т в е т. Уксусная кислота
2 -е в е щ е с т в о.
-е в е щ е с т в о.
В черном ящике находится вещество, которым богаты плоды цитрусовых. В мякоти апельсина его около 2 %, в лимоне – 6 %. Было впервые выделено в 1784 г. К.Шееле.
|
|
| Плоды, богатые лимонной кислотой… |
О т в е т. Лимонная кислота
3 -е в е щ е с т в о.
-е в е щ е с т в о.
Впервые было получено алхимиком Агриколой, который наблюдал при прокаливании янтаря похожий на соль белый налет этого вещества; используется в медицине.
О т в е т. Янтарная кислота (таблетки янтарной кислоты
и табличка с формулой НООС–СН2–СН2–СООН).
Учитель. Янтарная кислота – настоящий подарок для нас. Это естественное вещество, которое присутствует в организме, вырабатывается им. При приеме внутрь не вызывает привыкания и особых побочных эффектов, укрепляет иммунитет, усиливает клеточное дыхание, способствует усвоению кислорода клетками.
2. Беседа по итогам мини-разминки.
• К какому классу кислородосодержащих органических соединений относятся эти вещества?
• Как называется функциональная группа, содержащаяся в этих соединениях?
• Какие свойства веществ помогли нам их быстро определить?
• Как вы думаете, какие свойства продемонстрированных органических соединений мы еще не рассматривали?
В ходе обсуждения ответов формулируются проблемы:
1. Какая связь существует между свойствами карбоновых кислот и их строением?
2. Сходны ли по химическим свойствам органические кислоты и минеральные, и если сходны, в чем причина этого?
3. Работа в малых группах.
Затем определяются направления и способы дальнейшей работы, заранее оговариваются формы представления результатов, критерии их оценивания. Работа класса организуется в малых группах, каждая из которых выполняет собственное исследование.
| Г р у п п а 1. «Исследование строения предельных карбоновых кислот, сравнение их физических свойств. |
На основе молекулярной формулы уксусной кислоты и общей формулы карбоновых кислот, учитывая положения теории строения органических соединений, группе необходимо рассмотреть электронное строение уксусной кислоты. Указать взаимное влияние атомов в функциональной группе карбоновых кислот; провести сравнение температур кипения и плавления кислот (табл. 1).
Таблица 1.
Физические свойства некоторых предельных одноосновных карбоновых кислот
| Формулы кислот | Температура, °С |
| плавления | кипения |
| Н–СООН | 8,3 | 100,8 |
| СН3–СООН | 16,8 | 118,1 |
| С2Н5–СООН | –20,8 | 141,1 |
| С3Н7–СООН | –5 | 163,5 |
Шаги решения исследовательской задачи: определение валентности всех химических элементов в молекулярной формуле уксусной кислоты; выделение функциональной группы; на основе положения химических элементов в таблице Д.И.Менделеева проведение анализа смещения электронной плотности в молекуле.
Задание для группы 1.
Прочитайте соответствующий раздел учебника. Рассмотрите представленную таблицу (см. табл. 1) и справочную информацию. Составьте структурную и электронную формулы уксусной кислоты, объясните смещение электронной плотности в молекуле органической кислоты. Составьте схему образования водородной связи между двумя молекулами уксусной кислоты.
Низшие члены гомологического ряда одноосновных карбоновых кислот являются жидкостями. Муравьиная, уксусная и пропионовая кислоты обладают резким запахом, смешиваются с водой в любых соотношениях. Последующие кислоты, начиная с масляной, имеют неприятный запах и ограниченно растворяются в воде. Высшие кислоты – твердые вещества, нерастворимые в воде.
Результатом работы являются схемы: смещение электронной плотности в молекуле уксусной кислоты; образование водородных связей между молекулами.
| Г р у п п а 2. «Исследование взаимодействия уксусной с металлами и действие на индикатор». |
Учащиеся самостоятельно проводят химический эксперимент взаимодействия уксусной кислот с лакмусом и порошком магния, соблюдая правила техники безопасности. В ходе выполнения лабораторного опыта учащиеся должны подтвердить или опровергнуть предположение о сходстве общих химических свойств минеральных и органических кислот.
Задание для группы 2.
Лабораторная работа.
Свойства уксусной кислоты.
О п ы т 1. В две пробирки налейте по 1–2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами и минеральными кислотами). В 1-ю пробирку внесите 1–2 капли лакмуса (отметьте цвет индикатора). Во 2-ю пробирку добавьте немного порошка магния.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций.
Результатом работы являются наблюдения, оформленные в виде таблицы (табл. 2), записи уравнений реакций, вывод, а также названия полученных веществ.
Таблица 2.
| Вещество | № опыта | Действие | Наблюдение | Уравнение реакции |
| Уксусная кислота | 1 | Взаимодействие с лакмусом | Лакмус окрасился в красный цвет | – |
| Взаимодействие с магнием | Выделение газа | 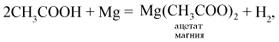
2Н+ + Mg = Mg2+ + Н2 |
Вывод. Уксусная взаимодействуют с активным металлом магнием. Магний вытесняет водород из раствора кислоты. Лакмус окрашивается в красный цвет.
| Г р у п п а 3. «Исследование взаимодействия уксусной кислоты с оксидами металлов и основаниями». |
Группе необходимо на основе знаний о химических свойствах минеральных кислот выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту.
Задание для группы 3.
Лабораторная работа.
Свойства уксусной кислоты
О п ы т 1. В две пробирки налейте по 1–2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В 1-ю пробирку добавьте немного порошка оксида магния. Во 2-ю пробирку внесите 1–2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи (гидроксида натрия).
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы (табл. 3).
Таблица 3.
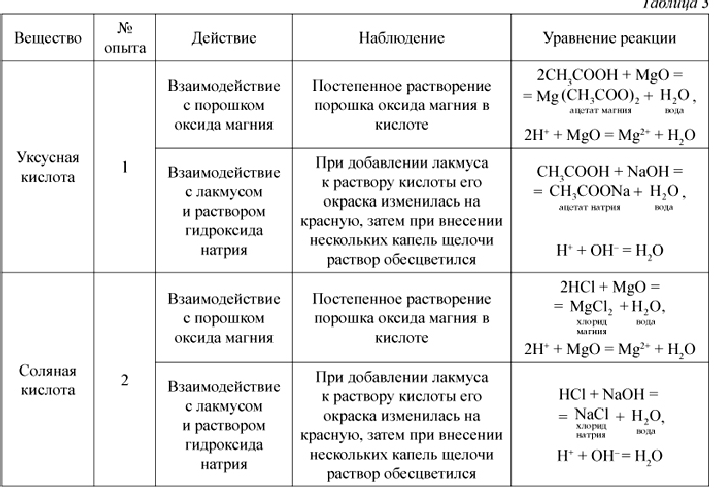
Результатом работы являются уравнения химических реакций, названия полученных веществ и вывод.
Вывод. Уксусная кислота реагирует с оксидами металлов и щелочами, образуя соответствующие соли и воду.
| Г р у п п а 4. «Исследование взаимодействия уксусной кислоты с солями и нерастворимыми основаниями». |
Группе необходимо выдвинуть предположение о сходстве химических свойств минеральных и органических кислот.
Задание для группы 4.
Лабораторная работа.
Свойства уксусной кислоты
О п ы т 1. Налейте в 1-ю пробирку 2–3 мл раствора сульфата меди(II) и прибавьте 1–2 мл раствора гидроксида натрия (отметьте, что наблюдаете), затем налейте немного уксусной кислоты. Во 2-ю пробирку налейте 1–2 мл раствора уксусной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы (табл. 4).
Таблица 4.
| Вещество | № опыта | Действие | Наблюдение | Уравнения реакций |
| Уксусная кислота | 1 | Взаимодействие с нерастворимым основанием – гидроксидом меди(II) | При смешивании растворов сульфата меди(II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора уксусной кислоты | 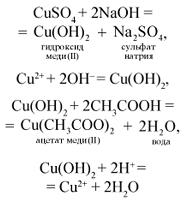
|
| Взаимодействие с раствором карбоната натрия | Выделение газа | 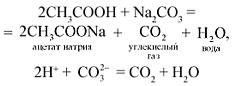
|
Результатом исследования являются записи уравнений химических реакций, названий полученных веществ и вывод.
Вывод. Уксусная кислота реагирует с нерастворимыми основаниями и солями.
Г р у п п а 5. « Краткая историческая справка об открытии важнейших карбоновых кислот, нахождении их в природе и практическом применении».
Группа получает опережающее домашнее задание изучить историю открытия важнейших карбоновых кислот, нахождение их в природе и практическое применение и подготовить презентацию.
4. Представление и оценка результатов.
После завершения исследования группы представляют результаты своей работы, которые оцениваются по следующим критериям:
1) Умение школьников кратко обобщить и записать итог выполненной работы в виде химических формул, уравнений, выводов.
2) Умение учащихся конкретно, полно, развернуто и научно объяснить полученные результаты исследования.
3) Использование средств наглядности (моделей, таблиц, схем, эксперимента) для обоснования своих теоретических выводов.
4) Умение учащихся правильно говорить на «химическом языке».
5) Участие (активность) каждого ученика в работе группы.
6) Умение учащихся анализировать, сравнивать, логически мыслить и делать выводы.
5. Закрепление знаний.
В качестве закрепления знаний и обобщения полученных результатов учащимся предлагается ответить на вопросы мини-теста (если учащиеся отвечают правильно, то в таблице ответов (табл. 5) появляется цифра пять).
Таблица 5
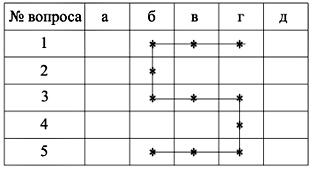
Тест
Отметьте правильные ответы (их может быть несколько) в таблице.
1. Раствор уксусной кислоты реагирует с веществами:
а) NН3; б) FeO; в) Na2CO3; г) ZnO; д) CO.
2. Предельные одноосновные карбоновые кислоты имеют общую формулу:
а) СnН2nO; б) СnН2nO2; в) СnН2n+2O;
г) СnН2nO3; д) СnН2n–2O2.
3. Следующие признаки верно отражают физические свойства уксусной кислоты:
а) газообразное вещество;
б) имеет характерный запах;
в) хорошо растворяется в воде;
г) при комнатной температуре бесцветная жидкость;
д) плохо растворяется в воде.
4. Соли уксусной кислоты называются:
а) формиаты; б) цитраты; в) пропионаты;
г) ацетаты; д) оксалаты.
5. При взаимодействии уксусной кислоты с карбонатом натрия образуются вещества:
а) Н2СО3; б) СО2; в) Н2О;
г) СН3СООNa; д) NaОН.
Домашнее задание:§12, с. 187, приложение 9.






 . Задание «Черный ящик».
. Задание «Черный ящик». -е в е щ е с т в о.
-е в е щ е с т в о. -е в е щ е с т в о.
-е в е щ е с т в о.