Конспект урока по теме: «Размеры и масса атомов и молекул»
Подготовила преподаватель физики
ГОУ СПО ЛНР «Счастьенский профессиональный колледж»
Чистопашина Ирина Валериевна
Группа: ______________ Дата ______________
Цели урока: дать представление обучающимся о размерах и массах молекул и атомов, научить решать задачи по вычислению основных физических величин молекулярно-кинетической теории, характеристик молекул и атомов; провести контроль знаний по теме.
Тип урока: урок комбинированный при использовании личностно ориентированной технологии (обучение в сотрудничестве, работа малыми группами, дифференцированный подход к обучающимся).
Оборудование для преподавателя: компьютер, проектор, экран;
для обучающихся: сосуд с водой, крупинки краски, пипетка, периодическая система Д.И.Менделеева, учебники.
План урока
-
Организационный момент 1 минута
-
Подготовка к усвоению нового материала 3 минуты
-
Актуализация опорных знаний 6 минут
-
Освоение нового материала 20 минут
-
Закрепление нового материала 11 минут
-
Домашнее задание 2 минуты
-
Подведение итогов урока 2 минуты.
Ход урока
-
Организационный момент.
Озвучивание темы урока. Постановка цели урока. Мотивация темы.
-
Подготовка к усвоению нового материала.
Все тела нам кажутся сплошными. Почему?
Можно ли увидеть молекулы в микроскоп? Почему?
Можно ли взвесить молекулу или измерить диаметр молекулы? Почему?
-
Актуализация опорных знаний
Прежде чем изучать новый материал, проведем физический диктант. Как всегда, вы вопрос не записываете, а пишите номер вопроса и ответ коротко и разборчиво.
-
Назовите основные положения молекулярной теории строения вещества.
-
Что изучает молекулярная физика?
-
Напишите пример физического явления как доказательства, что тела состоят из молекул?
-
Какой энергией обладают молекулы вследствие своего движения?
-
Какой энергией обладают молекулы вследствие взаимодействия друг с другом?
Рядом сидящие обучающиеся обмениваются друг с другом своими работами и под диктовку преподавателя карандашом отмечают «плюс» напротив верного ответа. Выставляется оценка. «5» – 5 верных ответов; «4» – 4 верных ответов; «3» – 3 верных ответа; «2» – меньше 2 верных ответов. Работы сдаются преподавателю.
-
Освоение нового материала.
|
| Слайд | Древнегреческие философы Левкипп и его ученик Демокрит еще в 5 в. до н.э. разработали атомистическую теорию, согласно которой в мире существуют лишь атомы («атом» - неделимый), движущиеся в Великой пустоте. Размеры атомов очень малы (≈0,1нм). |
|
| Слайд | Увидеть атомы смогли только в конце 20-го века, т.е. спустя 2500 лет после рождения атомной теории, с помощью электронного микроскопа. Связано это с мощным развитием науки и техники. |
| Исследовательская работа |
| Растворите крупинку краски в небольшом количестве воды. Затем поместите каплю полученного раствора в сосуд с водой, тщательно перемешайте. Отлейте из сосуда половину окрашенной жидкости в другой сосуд, а первый долейте чистой водой до того же уровня. Повторите эту операцию 2-3 раза. В конце опыта оцените окрас жидкости в первом сосуде и сделайте соответствующий вывод о размерах частиц краски. Для сравнения: в чайной ложке воды содержится примерно столько же молекул воды, сколько чайных ложек воды в мировом океане. |
| Схема | Слайд | Атом – наименьшая частица данного химического элемента. Молекула – это наименьшая устойчивая частица данного вещества, обладающая его основными химическими свойствами. |
| Работа с учебником |
| В капле воды массой 1 г (V=1см3) при диаметре молекулы воды 3. 10 – 8 см содержится: 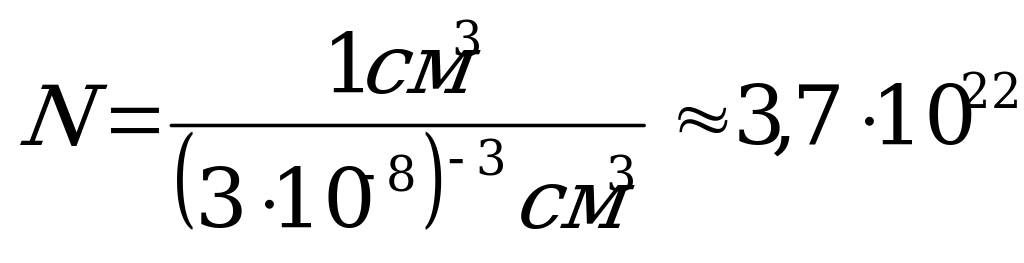 молекул. молекул.
|
| Работа с учебником |
| Массы молекул очень малы, поэтому удобно при расчетах использовать не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с 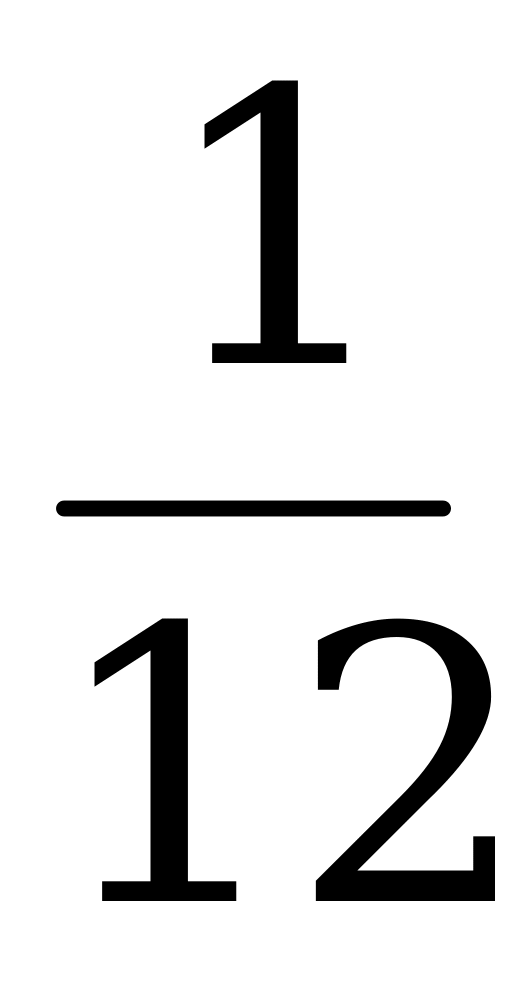 массы атома углерода. массы атома углерода. Масса одной молекулы воды (Н2О): 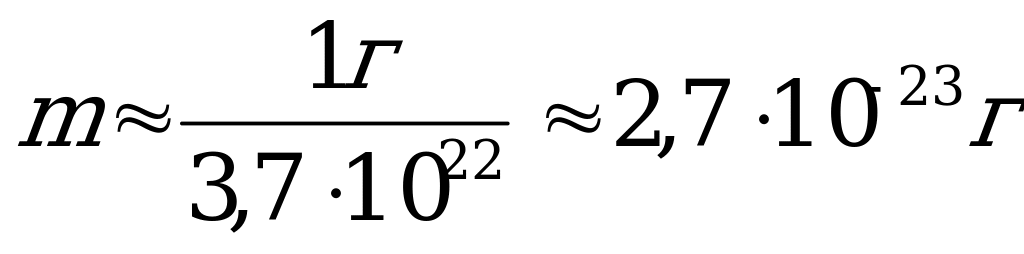
|
| Конспектирование на протяжении урока |
| На протяжении урока обучающиеся составляют конспект в виде таблицы | Название | Обозначение | Расчетная формула | Единица измерения | | Относительная молярная масса |
|
|
| | Количество вещества |
|
|
| | Постоянная Авогадро |
|
|
| | Масса молекулы (молярная масса) |
|
|
| | Масса вещества |
|
|
| | Число молекул |
|
|
|
|
| Работа с таблицей Менделеева |
| Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m0 данного вещества к 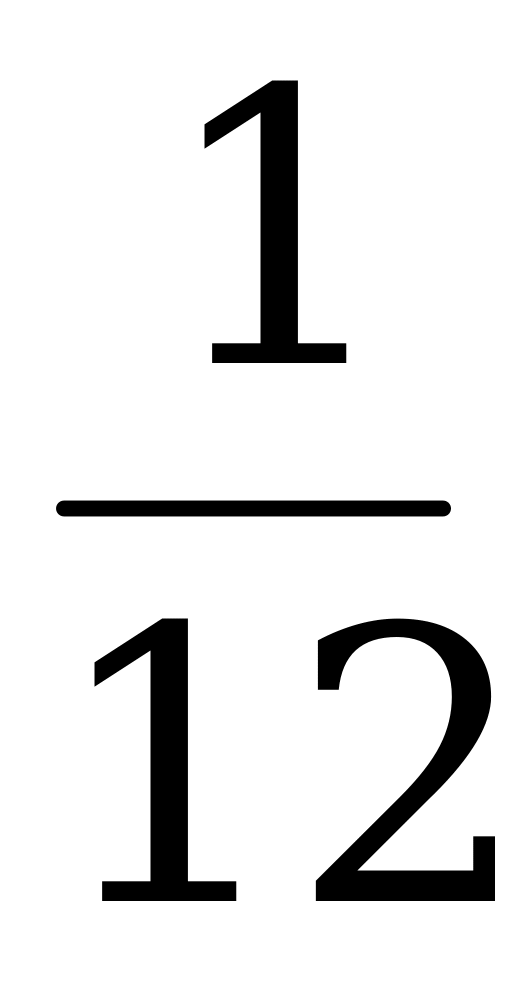 массы атома углерода. массы атома углерода. 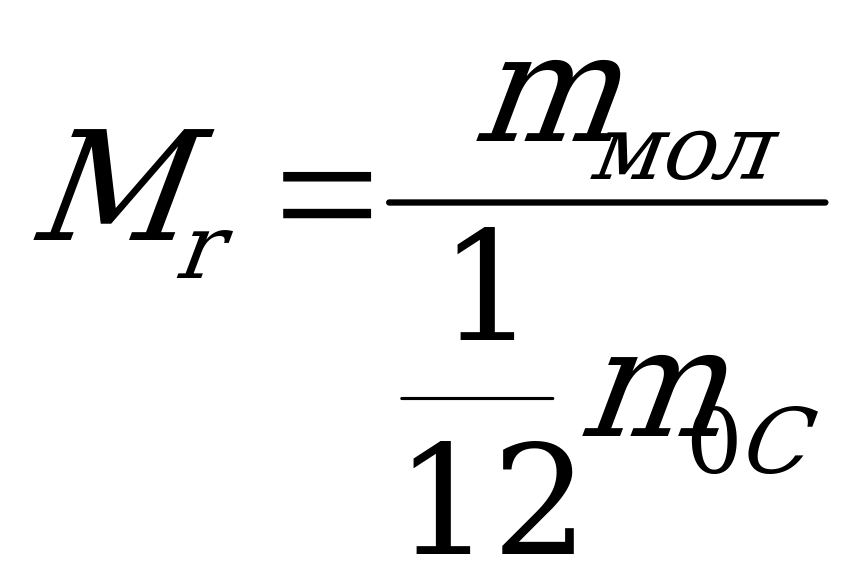 (1) (1) Относительные атомные массы всех химических элементов точно измерены. Относительная молекулярная масса углекислого газа СО2 приближенно равна 44 =12+2.16. |
| Работа с учебником |
| Количество молекул в любом макроскопическом теле велико, поэтому в расчетах используют не абсолютное число молекул, а относительное. В Международной системе единиц (СИ) количество вещества выражают в молях. Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг. В 1 моле любого вещества содержится одно и то же число атомов или молекул. Это число – постоянная Авогадро NA ≈ 6,02 . 10 23 моль-1 |
| Работа с таблицей Менделеева |
| Задача: рассчитать относительную молекулярную массу поваренной соли, кислорода Mr(NaCl)=23+35=58 г/моль Mr(Н2О)=1*2+16=18 г/моль |
| Работа с учебником |
| Количество вещества ν равно отношению числа молекул N в данном теле к постоянной Авогадро NА, т. е. к числу молекул в 1 моль вещества: 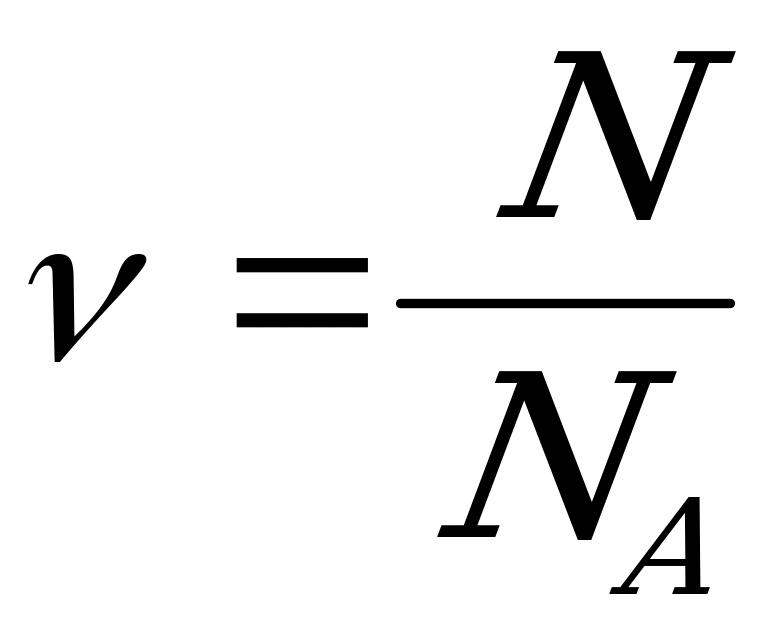 (2) (2) |
| Работа с учебником |
| Молярной массой М вещества называют массу вещества, взятого в количестве 1 моль, выражается в килограммах на моль (кг/моль) 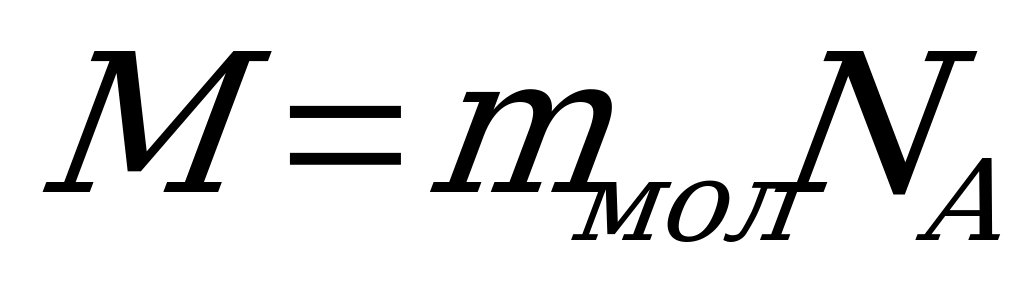 (3) (3) Молярная масса обозначена в таблице Меделеева |
| Работа с учебником |
| Масса любого вещества:  , (4) , (4) где 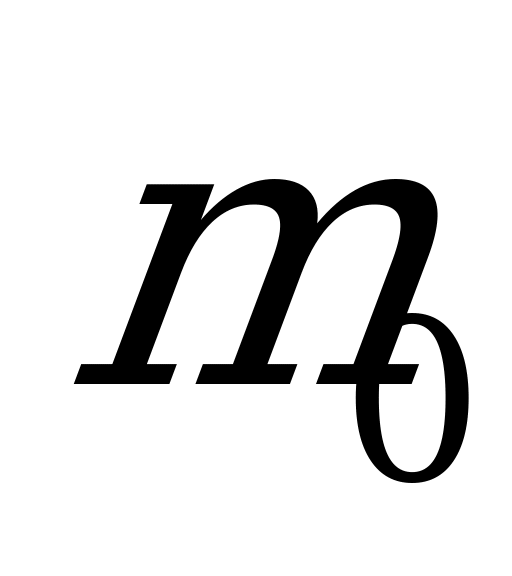 – масса одной молекулы – масса одной молекулы N – число молекул в теле. |
| Работа с учебником |
| Заменив величины N и NА в формуле (2) их выражениями из (3) и (4), получим для количества вещества: 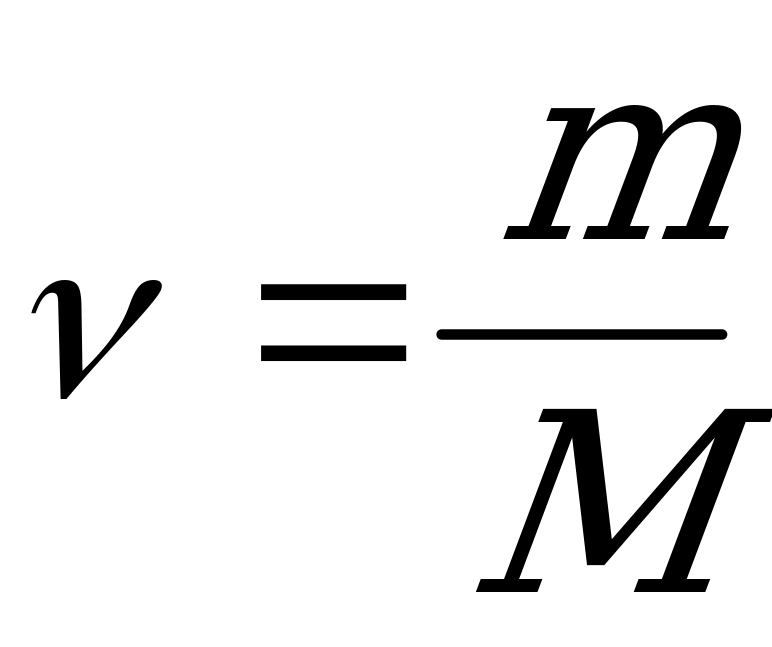 (5) (5) |
| Работа с учебником |
| Число молекул любого количества вещества массой m и молярной массой М согласно вышеприведенным формулам равно: 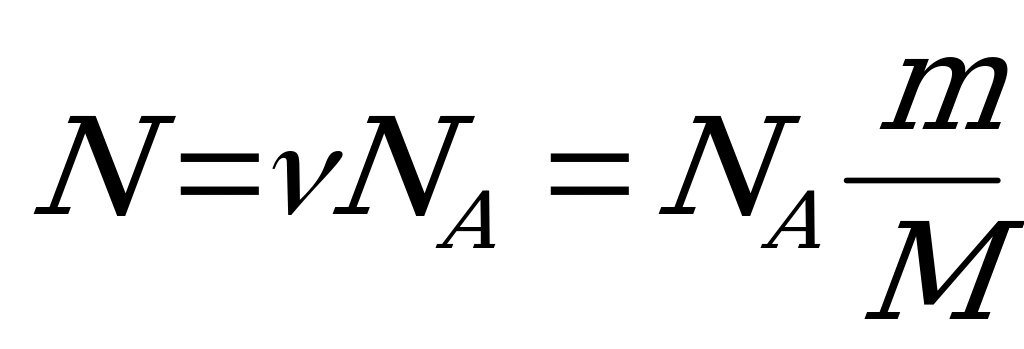 (6) (6) |
Вспомним алгоритм решения задач.
Рассмотрим задачу:
-
Какое количество вещества содержится в серебряном образце массой 0,432 кг?
-
Какова масса 250 молей метана СН4?
-
Закрепление нового материала
Работа в группах (обучающимся выдаются листочки с заданиями, которые они должны обсудить в группе и предоставить свой ответ, записанный на листочках).
-
Единица измерения количества вещества.
-
Определение молярной массы.
-
Обозначение количества вещества и количества молекул.
-
Что называют постоянной Авогадро?
-
Найдите относительную молекулярную массу Н2SО4.
Работы сдаются преподавателю.
-
Домашнее задание: параграф 53, используя учебник и рабочую тетрадь, дополнить таблицу изученных физических величин
-
Рассчитайте число молекул, содержащихся в 1 г калия.
-
Рассчитайте массу 6 ∙1023 молекул кремния.
-
Подведение итогов урока.
Обучающиеся самостоятельно оценивают работу в группе. Преподаватель выставляет общую оценку в журнал с учетом и проверочной работы, и работы в группе.
Рефлексия. Преподаватель благодарит обучающихся за слаженную работу на уроке.
| Название | Обозначение | Расчетная формула | Единица измерения | Определение |
| Относительная молярная масса |
|
|
|
|
| Количество вещества |
|
|
|
|
| Постоянная Авогадро |
|
|
|
|
| Масса молекулы (молярная масса) |
|
|
|
|
| Масса вещества |
|
|
|
|
| Число молекул |
|
|
|
|
| Название | Обозначение | Расчетная формула | Единица измерения | Определение |
| Относительная молярная масса |
|
|
|
|
| Количество вещества |
|
|
|
|
| Постоянная Авогадро |
|
|
|
|
| Масса молекулы (молярная масса) |
|
|
|
|
| Масса вещества |
|
|
|
|
| Число молекул |
|
|
|
|






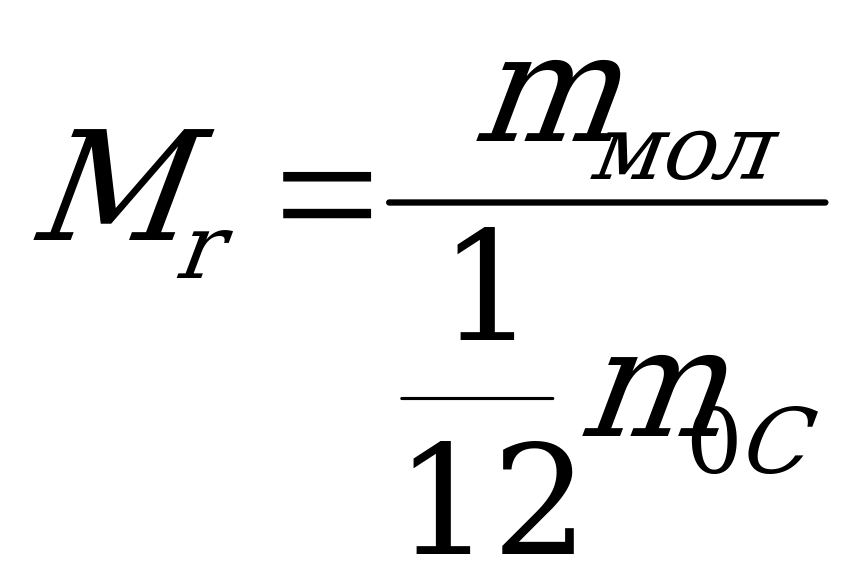 (1)
(1) 


















