Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа п.Дебин»
Конспект урока
«Оксиды фосфора. Фосфорная кислота»
Автор: Колесникова Н.А.,
учитель биологии, химии
П.Дебин
2016г.
Описание урока
Учебно-методическая разработка к уроку химии по теме «Оксиды фосфора. Фосфорная кислота». Комбинированный урок. Учебный материал рассчитан на 1 учебный час.
При проведении урока используются мультимедийная презентация, интерактивная доска. Используемые учебные материалы позволяют расширить иллюстративный материал по данной теме для лучшего усвоения учащимися основных понятий.
Разработка включает: проверку ранее изученного, изложение нового материала, самостоятельная работа с учебником, варианты заданий для закрепления учебного материала, домашнее задание.
Тип урока: объединенный (комбинированный) урок
Методы обучение: словесный, наглядный, проблемный, практичный
Формы организации урока: фронтальная, групповая, индивидуальная
Цель урока: расширить знания об оксидах и кислотах, познакомиться с составом оксидов фосфора, их свойствами, выяснить особенности фосфорной кислоты и состав ее солей, систематизировать знания о фосфоре и его соединениях.
Задачи урока:
Образовательная: изучить свойства оксидов фосфора и фосфорной кислоты, повторить классификацию и основные свойства оксидов и кислот.
Развивающая: развитие умений самостоятельно систематизировать и анализировать теоретическую и экспериментальную информацию, выделять главное в процессе проведения опытов, уметь самостоятельно делать выводы.
Воспитывающая: формирование научного мировоззрения, развитие коммуникативных умений в ходе групповой, парной работы, воспитание осознанного отношения к своему здоровью и “здоровью” окружающей среды, создание комфортности присутствия на уроке, воспитание эстетического отношения к предмету.
Оборудование: интерактивная доска, компьютер, мультимедийный проектор.
Ход урока
Организационный момент.
Учитель. «Фосфор – элемент жизни и мысли» (А.Е.Ферсман) Слайд №1
Вопрос к классу: Согласны ли вы с высказыванием, ответ обоснуйте?
Этап повторение ранее изученного материала:
Выполните тест по теме «Фосфор»: Слайд №2
Сколько электронов в атоме фосфора находится на внешнем энергетическом уровне?
2; 2) 3; 3) 5; 4) 15.
2. Число нейтронов в ядре атома 31Р:
5; 2) 15; 3) 16; 4) 31.
3. Максимальная степень окисления фосфора в соединениях равна:
+6; 2) +5; 3) +3; 4) +4.
4. При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна:
-3; 2) 0; 3) +3; 4) +5.
5. Среди перечисленных элементов V группы типичным неметаллом является:
1) фосфор; 2) мышьяк; 3) сурьма; 4) висмут.
Примерные ответы:
3
3
2
1
1
Слайд №3
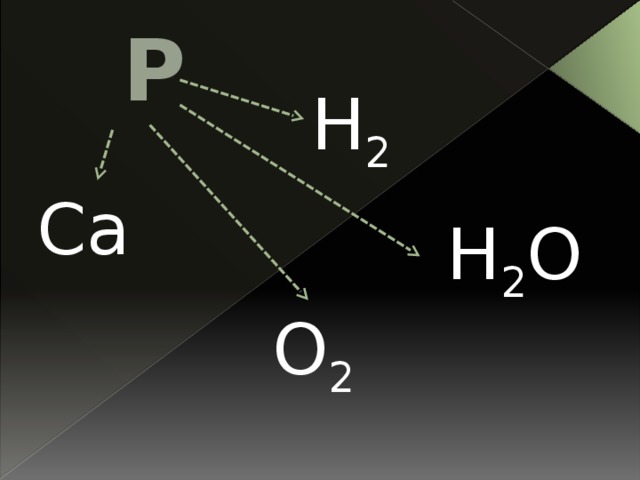
Напишите уравнения реакций, предложенных превращений веществ, используя интерактивную доску



 P H2
P H2
O2 H2O
Ca
Этап объяснения нового материала
Учитель. Тема урока … , определите цели и задачи урока: Слайд №4
Слайд №5
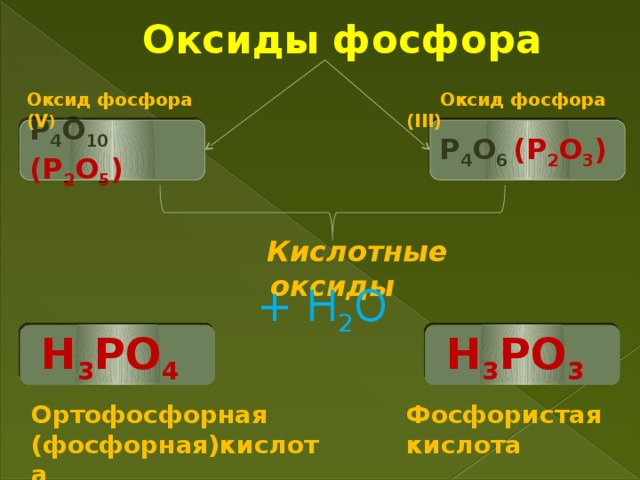
Учитель. Фосфор легко окисляется кислородом. При недостатке окислителя обычно образуются соединения фосфора (III)(P2O3), при избытке – соединения фосфора (V) (P2O5).
Триоксид фосфора Р2О3 (истинная формула – Р4О6) – белое кристаллическое вещество с неприятным запахом, Т. плав. 23,8 °C, Т. кип. 173; 175,4 °C.
Пентаоксид фосфора Р2О5 (истинная формула – Р4О10) – белое гигроскопичное кристаллическое вещество. Т. плав. 420оС, Т. кип. 359 °C
Слайд №6
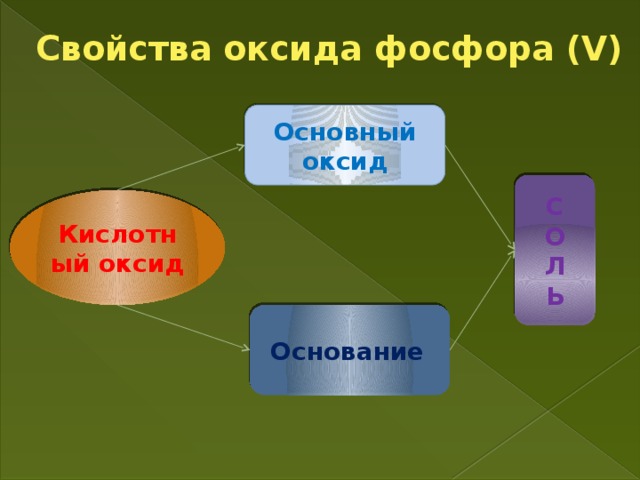
Учитель. Оксиды фосфора - типичные кислотные оксиды.
При взаимодействии с водой образуют:
(на холоде) фосфористую кислоту:
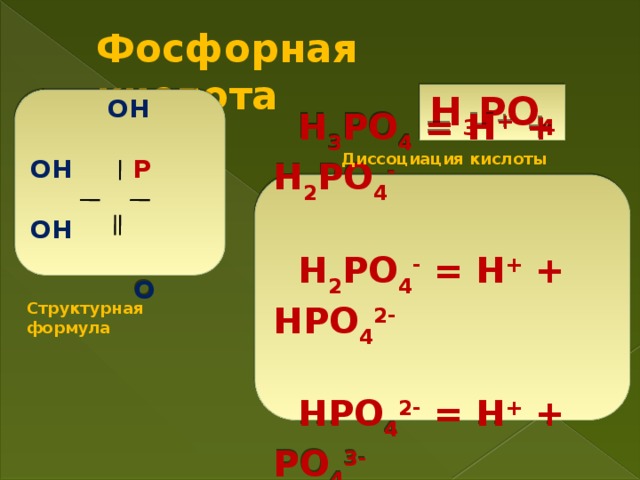
P2O3 + 3H2O = 2H3PO3
ортофосфорную (фосфорную):
P2O5 + 3H2O = 2H3PO4
Запишите уравнения соответствующих реакций, расставьте коэффициенты, дайте характеристику данных кислот
Вопрос к классу. С какими веществами еще будет взаимодействовать кислотные оксиды?
Примерные ответы (с основными оксидами, щелочами).
Слайд №7
Напишите уравнения реакций согласно предложенных схеме, расставьте коэффициенты
Соль
Основный оксид



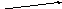
Щелочь
Кислотный оксид
Слайд №8,9,10
Физкультурная минутка
Слайд №11
Ортофосфорная кислота Н3РО4 – бесцветное кристаллическое вещество, очень хорошо растворимое в воде, гигроскопична. Это трехосновная кислота средней силы; не обладает выраженными окислительными свойствами.
Слайд №12
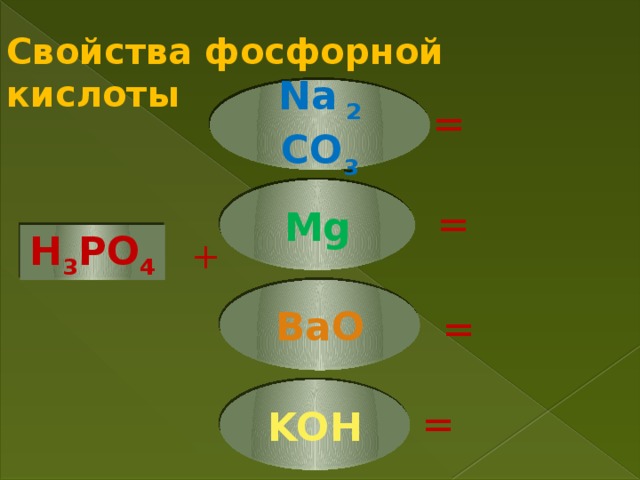
- проявляет все химические свойства, характерные для кислот
Вопрос к классу. С какими веществами будет взаимодействовать кислота?
(с металлами, основаниями, основными оксидами, солями)
Закончите уравнения реакций согласно предложенных схеме, расставьте коэффициенты
Слайд №13
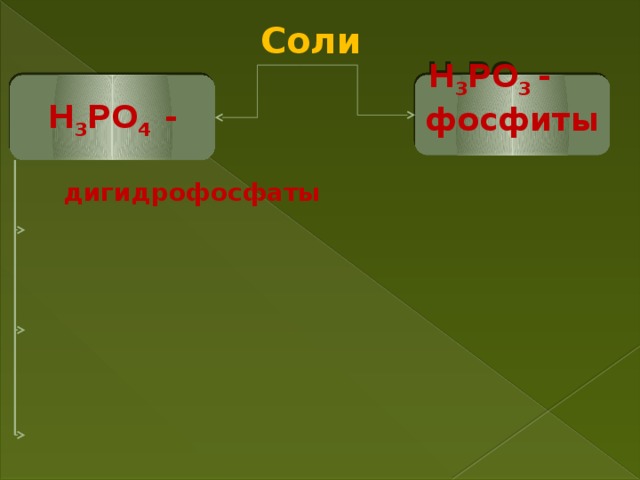
- образует три типа солей (фосфаты, гидрофосфаты и дигидрофосфаты)
Слайд №14
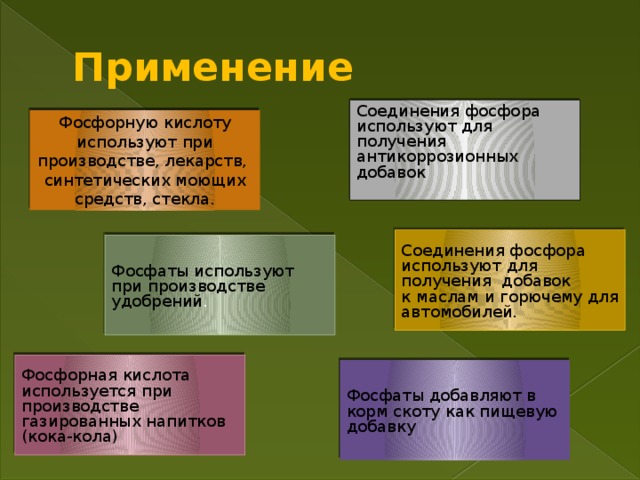
Учитель. Области применения оксидов фосфора, фосфорной кислоты и ее солей Самостоятельная работа с учебником стр.63,65
Этап закрепления материала. Слайд №15
Учитель. Повторим изученное.
(Возьмите листочки с вариантами заданий. Напишите Ф.И., число)
Перед вами цепочки превращений. Выберите одну. Вам дается 5-10 минут. Вы должны записать уравнения реакций при помощи, которых можно осуществить эти превращения.
Слайд №16
Итоги урока
Вопрос к классу. Достигнуты ли цели урока?
Домашнее задание §22 упр.5,6 стр 70, (по выбору - 1 цепочку превращений)
Рефлексия (Рефлексивный тест) Слайд №17
1. Узнал много нового.
2. Мне это пригодится в жизни.
3. На поставленные вопросы я получил ответы.
4. На уроке работал (с интересом, без удовольствия) и цели урока достигнуты.
5. Самооценка - “ __”.
Слайд №18
Учитель. Спасибо за сотрудничество:
Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Выставляет оценки
Приложение: презентация