Тема урока: Строение атома. Ионы.
Химия и физика так соединены между собой,
что одна без другой быть не может.
М.В. Ломоносов
Цели урока:
1. Образовательные – познакомить учащихся со строением атома и ядра, обеспечить усвоение понятий «электрон», «протон», «нейтрон», «положительный ион», «отрицательный ион»; научить пользоваться Периодической системой элементов Менделеева для определения состава атома, продолжить формировать умение извлекать информацию из разных источников и представлять ее в разных видах (схеме, рисунке, таблице).
2. Развивающие – развивать познавательный интерес, развивать у школьников умения выделять главное, существенное в изучаемом материале, сравнивать, обобщать, логически излагать свои мысли; развивать самостоятельность и волю школьников, используя для этого творческие, экспериментальные задания; развивать эмоции учащихся, создавая на уроке ситуации занимательности; формировать потребность в дополнительном, послеучебном познавательном труде; способствовать обогащению словарного запаса, прививать культуру умственного труда;
3. Воспитательные – приучать детей к аккуратному ведению записей в тетради, к доброжелательному общению, взаимопомощи, к самоконтролю; воспитывать чувство сопереживания за товарищей, формировать познавательный интерес к физике.
Тип урока: урок ознакомления с новым материалом.

Нуклид - ядро
План урока
1. Организационный момент;
2. Актуализация опорных знаний;
3. Подготовка к усвоению нового материала;
4. Освоение нового материала;
5. Закрепление материала;
6. Домашнее задание.
Ход урока
1. Этап начальной организации урока.
Задача: подготовить учащихся к работе на уроке.
Содержание: взаимное приветствие учителя и учащихся, определение отсутствующих, проверка готовности учащихся к уроку, организация внимания учащихся.
2. Актуализация опорных знаний.
Задача: вспомнить изученный ранее материал.
Содержание: фронтальный опрос.
Как на опыте показать, что электрический заряд делится на части?
Каким символом обозначается электрический заряд, и в каких единицах измеряется?
Чему равен элементарный заряд частицы?
Каков заряд и масса электрона?
Как объяснить появление отрицательного заряда на эбонитовой палочке при ее трении о шерсть?
Могут ли тела или частицы иметь заряд в 1.5 раза больше или меньше заряда электрона?
Электроскопу сообщили заряд равный 1.6 *10-19Кл. Какому числу электронов соответствует этот заряд?
Решить задачи



Сегодня наш урок мы посвятим атому и изучению его строения. И хоть в древности атом считали простейшей, не имеющей структуры частицей ( от греч. аtomos – неделимый), но в настоящее время уже известно, что атом имеет довольно сложную структуру.
Вспомним схему строения вещества (на доске, протоны не пишем, оставляем пустой прямоугольник)

Древнегреческие философы считали атом простейшей, не имеющей структуры частицей, (atomos - «неделимый»)

3. Этап подготовки учащихся к активному и сознательному усвоению нового материала. Постановка проблемных вопросов.
Запишем тему сегодняшнего урока «Строение атома. Ионы».
Сегодня на уроке мы:
познакомимся с планетарной моделью атома (это поможет нам научиться объяснять электрические явления).
узнаем, какие частицы входят в состав ядра атома;
узнаем, что такое положительные и отрицательные ионы.
4. Этап изучения нового материала.
Задача: познакомить учащихся со строением атома и ядра, обеспечить усвоение понятий «электрон», «протон», «нейтрон», «положительный ион», «отрицательный ион»; научить пользоваться Периодической системой элементов Менделеева для определения состава атома
Содержание.
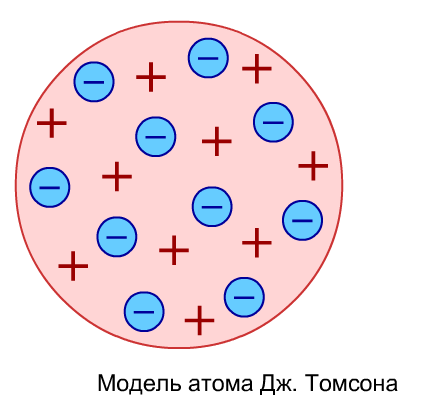
О дну из первых моделей строения атома предложил Джозеф Джон Томсон в 1903 г. Он предположил, что атом имеет форму шара, положительно заряженного по всему объему, а внутри него находятся отрицательно заряженные электроны. Ученые назвали эту модель «пудинг с изюмом».
дну из первых моделей строения атома предложил Джозеф Джон Томсон в 1903 г. Он предположил, что атом имеет форму шара, положительно заряженного по всему объему, а внутри него находятся отрицательно заряженные электроны. Ученые назвали эту модель «пудинг с изюмом».
Для проверки существующих гипотез в 1908-1911 г. английский ученый Эрнест Резерфорд и его сотрудники выполнили опыт, суть которого можно понять из такого сравнения (рис. 107!)
 Опыт Резерфорда:
Опыт Резерфорда:



Т.к. mеmᵃ, то электроны являлись препятствием, и те альфа-частицы, которые попадали в ядро атома золота или проходили рядом с ним, изменяли свою траекторию движения (ядро «+», альфа-частицы тоже «+»). Отклонявшихся частиц было мало (10:100 000), следовательно, ядро имело чрезвычайно малые размеры - диаметр ядра был в 100 000 раз меньше, чем диаметр самого атома, но в нем было сосредоточено 96,99% от всей массы атома.
Итак, Резерфорд предложил «планетарную» модель строения атома (рис.108!):
в центре атома любого элемента находится ядро, а вокруг ядра движутся электроны. Ядро имеет положительный заряд, а электроны - отрицательный. Электроны вращаются вокруг ядра подобно тому, как планеты вращаются вокруг Солнца. Их скорость вращения огромна, поэтому они не падают на ядро ( за 1 с электрон делает 7*1015 оборотов).

Позже было установлено, что
ядро тоже неоднородно – оно состоит из протонов и нейтронов.
весь положительный заряд сосредоточен в протонах, а нейтроны заряда не имеют, они нейтральны.
поскольку атом электрически нейтрален, то число протонов в ядре = числу электронов на электронных оболочках – орбитах. Нейтронов может быть любое количество.
масса протона приблизительно равна массе нейтрона. По сравнению с их массами масса электрона пренебрежимо мала.
Дополним нашу таблицу

Таблица I. Частицы, входящие в состав атома.
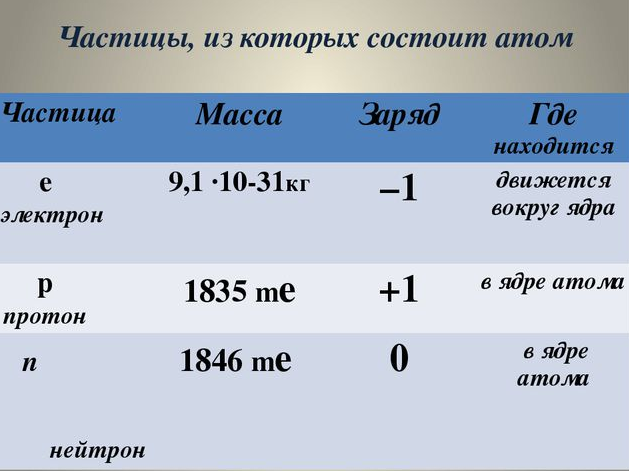
Посмотрим на таблицу Менделеева: порядковый номер Z показывает число протонов в ядре, следовательно, он показывает и число электронов, т.к. атом в целом нейтрален. А число нейтронов, входящих в ядро, можно найти таким образом: из массового числа А вычесть число протонов.

Например: кислород, серебро
Самостоятельно! Определить элементарный состав атома кальция и фосфора.
Поговорим о силах взаимодействия между частицами. Частицы ядра прочно связаны друг с другом особыми
ядерными силами. Притяжение же электронов к ядру гораздо слабее, поэтому электроны (в отличие от частиц ядра – протонов и нейтронов) могут отделяться от своих атомов. При этом атом не может просто потеряться, если один атом потерял электрон, то другой атом его присоединил и переходить к другим.
В результате таких переходов электронов образуются ионы – атомы или группы атомов, в которых число электронов не равно числу протонов.
Атом, потерявший один или несколько электронов, уже не является нейтральным, а будет иметь положительный заряд. Его называют положительным ионом.
 И обратно. Если к нейтральному атому присоединяется лишний электрон , в этом случае атом приобретает отрицательный заряд и становится отрицательным ионом.
И обратно. Если к нейтральному атому присоединяется лишний электрон , в этом случае атом приобретает отрицательный заряд и становится отрицательным ионом.
5. Этап первичной проверки понимания учащимися нового учебного материала.
Задача: Установить, усвоили ли учащиеся структуру атома, понятия «электрон», «протон», «нейтрон», «положительный ион», «отрицательный ион»;. Устранить проблемы в понимании материала. Научить применять полученные знания при решении качественных задач.
Содержание.
Работа с Периодической системой химических элементов Менделеева
а) Сравните строение атома бериллия, азота и серебра, используя Менделеева.
б) Расположите перечисленные далее химические элементы в порядке увеличения числа протонов в их ядрах: фосфор, цинк, кислород, гелий, сера.
г) Используя таблицу Менделеева сравните, как выглядят атом лития, положительный и отрицательный ионы лития. Результаты занесите в таблицу II (на доске и в тетради)
Таблица I. Характеристика положительного и отрицательного иона лития
| Характеристика | Число электронов | Число протонов | Заряд | Масса ( по сравнению с массой атома) |
| Атом лития | 3 | 3 | нет | m |
| Положительный ион лития | 2 | 3 | + | уменьшилась |
| Отрицательный ион лития | 4 | 3 | - | увеличилась |

Вопросы для обсуждения:
Почему рассмотренную сегодня на уроке модель атома называют планетарной?
В чем заключается ее сходство с Солнечной системой?
Кем и на каком основании была предложена планетарная модель атома?
На что наталкивались внутри атома альфа-частицы, которые в опыте Резерфорда отскакивали от фольги назад?
Какие частицы входят в состав атома?
Какие частицы входят в состав ядра?
Назовите отличия электрона от протона. Протона от нейтрона
Во сколько раз масса электрона меньше массы протона?
Что можно сказать о массах протона и нейтрона?
Где сосредоточена масса атома?
Чему равно число протонов?
Как найти число нейтронов?
Что представляют собой положительные и отрицательные ионы? Как они образуются?
От атома гелия отделился один электрон. Как называется оставшаяся частица? Каков её заряд?
Во что превратится атом натрия, если «убрать» из его ядра один протон, не изменяя количество электронов?
Что имеет большую массу: атом лития или положительный ион лития?
Что имеет большую массу: атом хлора или отрицательный ион хлора?
Существуют ли атомы с зарядом ядра меньшим, чем заряд протона?
Может ли атом водорода или другого вещества лишиться заряда, равного 0,5 заряда электрона?

6. Этап подведения итогов урока. Домашнее задание
Задача. Дать анализ успешности овладения знаниями об изученных явлениях, показать типичные недостатки в знаниях, умениях и навыках
Дополнительно.
На альбомном листе нарисуйте: а) модель атома углерода; б) положительный и в) отрицательный ионы углерода.













 дну из первых моделей строения атома предложил Джозеф Джон Томсон в 1903 г. Он предположил, что атом имеет форму шара, положительно заряженного по всему объему, а внутри него находятся отрицательно заряженные электроны. Ученые назвали эту модель «пудинг с изюмом».
дну из первых моделей строения атома предложил Джозеф Джон Томсон в 1903 г. Он предположил, что атом имеет форму шара, положительно заряженного по всему объему, а внутри него находятся отрицательно заряженные электроны. Ученые назвали эту модель «пудинг с изюмом».
 Опыт Резерфорда:
Опыт Резерфорда:






 И обратно. Если к нейтральному атому присоединяется лишний электрон , в этом случае атом приобретает отрицательный заряд и становится отрицательным ионом.
И обратно. Если к нейтральному атому присоединяется лишний электрон , в этом случае атом приобретает отрицательный заряд и становится отрицательным ионом. 











