УГЛЕРОД
Строение атомов химических элементов углерода и кремния
| Название химического элемента | Схема строения атома | Электронное строение последнего энергоуровня | Формула высшего оксида RO2 | Формула летучего водородного соединения RH4 |
| 1. Углерод | C+6 )2 )4 | …2s22p2 | C+4O2 | C-4H4 |
| 2. Кремний | Si +14)2 )8 )4 | …3s23p2 | Si+4O2 | Si-4H4 |
Как видно из схем строения атомов, на внешнем энергетическом уровне этих элементов находится 4 электрона, поэтому, углерод и кремний проявляют степень окисления +4 и -4.
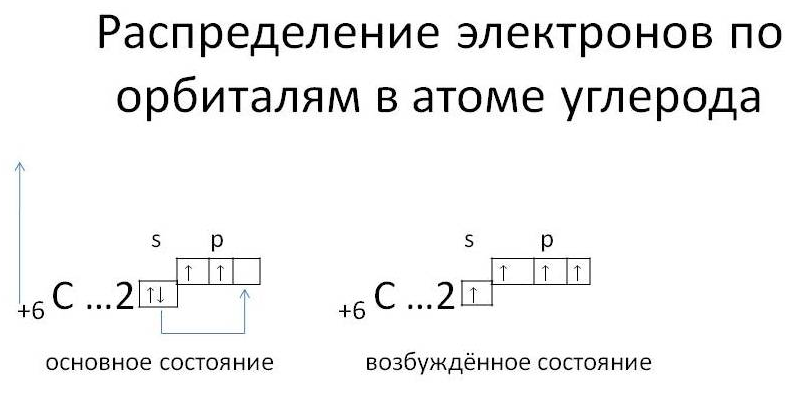
Из схемы видно, что у тома углерода два неспаренных электрона на внешнем уровне (аналогично и у кремния). Этим объясняется, что углерод и кремний могут иметь степень окисления +2 (Например, СО – угарный газ). Переходя в возбуждённое состояние, один из s-электронов может перейти на свободную p-орбиталь. Тогда в атомах появляется 4 неспаренных электрона и степень окисления равна +4 и – 4
УГЛЕРОД. АЛЛОТРОПИЯ УГЛЕРОДА
Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.
| Алмаз | Графит | Карбин | Фуллерен |
| Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C
| Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см3 | Чёрный порошок; ρ = 2 г/см3; полупроводник. Состоит из линейных цепочек. При нагревании переходит в графит.
| В отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку |
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод - малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
| С – восстановитель С0 – 4 е-→ С+4 или С0 – 2 е-→ С+2 | С – окислитель С0 + 4 е-→ С-4 |
| 1) с кислородом C0 + O2 t˚C → CO2 (углекислый газ) при недостатке кислорода: 2C0 + O2 t˚C → 2C+2O 2) со фтором С + 2F2 → CF4 3) с водяным паром C0 + H2O t˚C → С+2O + H2 (водяной газ) 4) с оксидами металлов С + MexOy = CO2 + Me C0 + 2CuO t˚C → 2Cu + C+4O2 5) с кислотами – окислителями: C0 + 2H2SO4(конц.) → С+4O2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O | 1) с некоторыми металлами образует карбиды 4Al + 3C0 t˚C → Al4C3-4 Ca + 2C0 t˚C → CaC2-1 2) с водородом C0 + 2H2 t˚C → CH4
|
КРЕМНИЙ
Кремний открыл и получил в 1823 году шведский химик Йенс Якоб Берцелиус. Второй по распространённости элемент в земной коре после кислорода (27,6% по массе). Встречается в соединениях.
Кристаллический – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см3, t°пл. =1415°C; t°кип. = 2680°C. Имеет алмазоподобную структуру и образует прочные ковалентные связи. Инертен.
Аморфный - бурый порошок, гигроскопичен, алмазоподобная структура, ρ = 2 г/см3, более реакционноспособен.
Типичный неметалл, инертен.
| Si – восстановитель Si 0 – 4 е-→ Si +4 | Si – окислитель Si 0 + 4 е-→ Si -4 |
| 1) С кислородом Si0 + O2 t˚→ Si+4O2 2) С фтором (без нагревания) Si0 + 2F2 → SiF4 3) С углеродом Si0 + C t˚→ Si+4C 4) С водородом не взаимодействует. Силан (SiH4) получают разложением силицидов металлов кислотой: Mg2Si + 2H2SO4 → SiH4 + 2MgSO4 5) С кислотами не реагирует (только с плавиковой кислотой Si+4HF=SiF4+2H2) Растворяется только в смеси азотной и плавиковой кислот: 3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O 6) Со щелочами (при нагревании): Si0 + 2NaOH + H2O t˚→ Na2Si+4O3+ 2H2 | 1) С металлами (образуются силициды): Si0 + 2Mg t˚→ Mg2Si-4
|


























