6
Интегрированный урок по химии и биологии по теме «Кислород как химический элемент и простое вещество»
Цель и задачи урока:
Познакомить учащихся с кислородом как самым распространенным химическим элементом на земле, расширить их представления о свойствах кислорода, его значении для живых существ, показать необходимость предотвращения загрязнения атмосферы, обобщить знания о значении кислорода в процессе дыхания.
Установление межпредметных связей между химией и биологией.
Продолжать развивать умения учащихся самостоятельно работать с дополнительной литературой.
Обеспечить условия для экологического просвещения учащихся.
Оборудование и реактивы:
Компьютер, проектор, интерактивная доска, видеофрагменты из единой коллекции цифровых образовательных ресурсов; портреты ученых; пробирки, нагревательный прибор, штатив, лучинки, колбы, H2O2, , оксид марганца, перманганат калия.
Тип урока: комбинированный.
Методы и формы обучения: Частично-поисковый, фронтальный, объяснительно-иллюстративный, словесный (эвристическая беседа).
Ход урока
Организационный этап. Здравствуйте ребята, садитесь. Прежде чем мы начнем заниматься делом, я хотел бы, чтобы каждый из вас настроился на урок. Перед вами лежат карточки разных цветов. Если в конце урока вы почувствуете, что ваши знания и настроение улучшились – поднимите карточку красного цвета, если вы получили недостаточно информации – зеленого цвета, а если урок не принес вам полезных знаний и удовлетворения – синего цвета.
Этап актуализации знаний. Учитель. По мнению людей религиозных, вездесущим, всемогущим и в то же время невидимым может быть только бог. В действительности эти три эпитета вполне можно отнести и к химическому элементу, о котором пойдет речь на нашем уроке. Я загадаю вам несложную загадку: (слайд 2)
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг, и каждый час?
Без чего мертва природа?
Правильно, без ………. Учащиеся: Кислорода!
Да, именно кислород мы и поговорим сегодня с вами.(слайд 3) Тема нашего урока : кислород как химический элемент и простое вещество.
Задачи нашего урока следующие: (слайд 4)
Когда же появились первые упоминания о кислороде? Об этом нам подготовил информацию ___. Давайте, послушаем его.
Ученик 1. Многие ученые прошлого догадывались, что существует вещество со свойствами, присущими кислороду. Сведения о нем – косвенные, разумеется,- есть в трактате китайского алхимика Мао Хао (VIII в.). Китайцы знали «деятельное начало», входящее в состав воздуха, и называли его «йын». В XV в. следы кислорода можно обнаружить в трудах Леонардо да Винчи. Потом снова теряются - до XVII в., когда голландец Дреббель изобретает подводную лодку. Он использует селитру, чтобы получив из нее кислород обогатить им воздух в подводной лодке. Но этот факт остался незамеченным. В 1758 году М.В.Ломоносов на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее металл. Сегодня известно, что речь шла о кислороде.
Открытие кислорода является одним из важнейших событий не только в истории элементов, но и химии вообще и связано с именами Д. Пристли, К. Шееле и А. Лавуазье. Рассмотрим подробнее фамилии этих ученых. Д.Пристли смог получить кислород в своей лаборатории. Интересно, как он относился к данному явлению? _________ изучила информацию о его личных записях, сохранившихся до наших дней, и вот что хочет нам поведать: (слайд 5)
Ученик 2. Вот как об этом писал сам Джозеф Пристли: «1 августа 1774 г. Я попытался извлечь воздух из ртутной окалины (оксида ртути) и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению».
(слайд 6) То есть он получил кислород разложением оксида ртути .
Полгода спустя Д. Пристли осуществил опыт с мышами (помните, в 6 классе на уроках биологии мы говорили об этом). Он поместил одну мышь в сосуд с кислородом, а другую - в такой же сосуд с воздухом, и обнаружил, что в кислороде мыши живут дольше, чем в воздухе. Затем он сам пробовал дышать полученным газом и убедился, что дышится чрезвычайно им «свободно и легко».
(слайд 7) Одновременно с Пристли кислород открыл и шведский ученый Карл Шееле. Шееле даже получил его раньше, чем Пристли, но сообщение об этом было опубликовано позже, чем открытие Пристли. И все-таки главная фигура в истории открытия кислорода – не Шееле и не Пристли. Они открыли новый газ – и только. (слайд 8) Собственно открывшим кислород остается французский химик Антуан Лавуазье. В 1775 году он исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона (теория огненной материи). За два века, прошедшие со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась. Лавуазье дал название кислороду oxygenium – рождающий кислоту.
Ребята, давайте попробуем охарактеризовать положение химического элемента кислорода в таблице Менделеева. (слайд 9)
- период
- группа, подгруппа
- порядковый номер
- относительная атомная масса
- валентность
- металл или неметалл
В природе кислород образует два простых вещества (что такое простое вещество?):
(слайд 10)
- кислород с формулой О2. Попробуйте охарактеризовать его физические свойства (агрегатное состояние, цвет, запах, вкус, растворимость в воде) . Сжижается, если его охладить до температуры -183С0 при н.у. Если снизить температуру до -218,8С0, то жидкий кислород превратится в красивые синие кристаллы.
(слайд 11)
- озон с формулой О3. Он образуется во время грозы при прохождении разрядов молнии через слои воздуха. Он образуется из молекулярного кислорода. При нормальных условиях это газ, голубоватого цвета с запахом свежести. Он образует озоновый слой нашей планеты. Зачем он нужен? (защищает от ультрафиолетовых лучей).
Мы говорим, что кислород образует простые вещества, но он также входит в состав сложных веществ. Так какова же распространенность кислорода на земле? (слайд 12) Это самый распространенный элемент на земле: в литосфере – 49%, в атмосфере – 21%, в гидросфере – 98%.
Кислород можно получить тремя способами: (слайд 13)
- при термическом разложении веществ
-разложением воды под действием электрического тока
- разделением воздуха на составные части.
Как же можно получить кислород в лаборатории. Запишите в тетради «получение кислорода». Может кто-нибудь знает? Чтобы получить чистый кислород, нужны исходные вещества, богатые этим элементом. В лаборатории его получают разложением перманганата калия. Проведем эксперимент. (Описать опыт: перманганат калия при нагревании разлагается – что такое реакция разложения – с выделением кислорода) Но как его собрать в пробирку: держать ее вверх дном или вниз дном? Рассчитайте молярную массу кислорода. Молярная масса воздуха 29 г/моль. Куда пойдет кислород? Значит как надо держать пробирку? Собрать кислород можно методом вытеснения воздуха и вытеснения воды. Мы соберем методом вытеснения воды. (Делаем опыт) Далее я помещу в пробирку с собранным кислородом тлеющую лучинку. Что с ней происходит? О чем это говорит? Да, кислород поддерживает горение. (слайд 14) Запишите уравнение реакции в тетрадь.
Попробуем получить кислород другим способом. Разложением перекиси водорода. Но в присутствии катализатора – это вещество ускоряет ход химической реакции, но сам при этом не расходуется. В качестве катализатора используем оксид марганца (4). Докажем выделение кислорода поднесением тлеющей лучинки. (слайд 15) Запишем уравнение реакции.
(слайд 16) В присутствии этого же катализатора при сильном нагревании до 400 градусов разлагается бертолетова соль (хлорат калия) с выделением кислорода. Запишем уравнение реакции в тетрадь.
Кислород образует так много соединений потому, что он химически активный. Каковы же химические свойства кислорода? Т.е. с какими веществами и как способен взаимодействовать кислород? Запишите в тетради «химические свойства кислорода».
Для кислорода характерны реакции горения. Горение чего вы наблюдали? Чем сопровождались эти процессы? То есть реакции горения это такие реакции, при которых происходит окисление веществ с выделением теплоты и света. Можно также назвать реакции с кислородом реакциями окисления. Давайте посмотрим конкретные примеры взаимодействия различных веществ, то есть их горение и окисление.
Горение угля. (слайд 17) Многие из вас, наверное, наблюдали это явление. Но давайте посмотрим видеоопыт. (видео включить). Давайте попробуем записать уравнение этой реакции на доске:
С + О2 = СО2
Для того, чтобы записать формулу продукта реакции, вспомним валентности этих элементов по таблице Менделеева. Уравняем реакцию. Кто знает, как называется полученное вещество? Верно, углекислый газ. Но у этого вещества есть еще одно название. Посмотрите, это простое или сложное вещество? Да, сложное. Из скольки химических элементов оно состоит? Да, из двух. Один из которых кислород. Вот такие вещества называются оксидами. Как их называть? (слайд 18) В данном случае это оксид углерода (4). А почему 4? Да, из-за валентности углерода.
Горение серы. (слайд 19) Посмотрим видеоопыт горения серы. (Смотрим опыт). Попробуем записать уравнение данной реакции на доске. (пишем на доске, разбираем пример, даем название вещества).
Горение магния. (слайд 20) (Смотрим опыт. Пишем реакцию на доске. Уравниваем. Даем название продукта реакции). Данная реакция раньше использовалась при фотографировании.
Горение железа. (слайд 21)(Смотрим опыт)В результате этого опыта образуется необычный оксид – железная окалина. Почему он имеет такой состав мы рассмотрим гораздо позже, не сегодня. Перепишите уравнение реакции к себе в тетрадь.
Какие выводы мы можем сделать после просмотренных опытов?
-в реакцию взаимодействия с кислородом вступают простые вещества (металлы и неметаллы)
- одно из обязательных условий – предварительное нагревание
-интенсивность горения резко увеличивается в атмосфере кислорода
-все реакции взаимодействия кислорода с простыми веществами относятся к реакциям соединения
- сложные вещества, состоящие из двух элементов, один из которых кислород, называются оксидами.
- все реакции окисления являются экзотермическими.
Кислород также взаимодействует со сложными веществами. Например, с метаном, входящим в состав природного газа. (слайд 22) Запишем уравнение реакции в тетрадь:
СН4 + 2О2 = СО2 + 2Н2О + О1
Это экзотермическая реакция.
Как вы думаете, где используется кислород?
Применение кислорода:
Находит широкое применение в медицине и промышленности.
При высотных полётах лётчиков снабжают специальными приборами с кислородом.
При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
Кислородом в баллонах снабжают подводные лодки.
Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.
Давайте попробуем закрепить полученные знания.
Задание 1. Ответьте на вопросы со слайда. 23, 24, 25
Таким образом, что вы сегодня узнали на уроке?
Да, все это верно. Но мы с вами не уделили внимания тому, что кислород играет важную роль для процесса дыхания. То есть о кислороде надо говорить не только с точки зрения химии, но и биологии. Вот этому будет посвящена вторая половина нашего урока.
БИОЛОГИЯ
Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс- фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
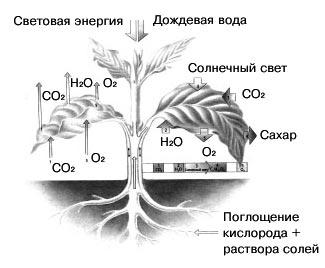
Рис.6 « Схема фотосинтеза растениями»
Биолог 1. Благодаря солнечному свету и хлорофиллу углекислый газ поглощается растениями, выделяющими кислород, так необходимый человеку и животным. Самыми активными «производителями» кислорода являются не растения, которые мы видим на суше, а бесчисленные мелкие водоросли, произрастающие в поверхностных теплых слоях морей и океанов. Подсчитано, что сухопутные растения вырабатывают ежегодно 53 млрд. тонн кислорода, а водоросли – почти в 10 раз больше. Было определено также, что населению Земли и животным нужно две тысячи лет, чтобы исчерпать весь кислород атмосферы, а растениям и водорослям достаточно 600 лет, чтобы восстановить массу кислорода в воздухе, окружающем Землю.
Учитель: Исключительно важна роль кислорода в процессе дыхания человека и животных. Давайте вспомним. У самого берега возле стебля тростника повис вниз головой жук-плавунец. Что он высматривает на дне? Возле него расположились какие-то личинки, также вниз головой, выставив над водой свои «хвостики». Слово предоставляется группе биологов.
Биолог 1. Жук и личинка запасаются кислородом. Поднимаясь на поверхность воды, жук выставляет из воды задний конец своего тела, и некоторое время остается висеть в этой позе совершенно неподвижно. Воздух поступает через дыхальца, открывающиеся на спинной стороне его брюшных колец. Дыхальца – отверстия в брюшке (у личинок они находятся в «хвостиках»), от них отходят трахеи трубочки к каждому органу жука. Кислород воздуха из трахеи проникает в каждую клетку организма жука, а углекислый газ из клеток проникает в трахеи и выводится наружу.
Учитель. Совсем близко к берегу подплыла рыбка. Вы видите ее темную спинку и замечаете, как периодически движутся у нее жаберные крышки. Почему?
Биолог 2. Она прогоняет через жаберные щели воду, которая омывает жаберные лепестки, пронизанные капиллярами. Через их стенки растворенный в воде кислород переходит в кровь, а из крови в воду переходит углекислый газ.. Характерно, что для разных пород рыб нужно разное количество кислорода. Наименее требователен карась. Он выживает и в заиленных прудах, обедненных кислородом, где почти весь растворенный в воде кислород расходуется на окисление органических веществ. Из прудовых рыб самый привередливый в этом смысле карп. Ему нужно, чтобы концентрация кислорода в воде была не меньше 4 мг/л. Еще больше кислорода требуется рыбам, обитающим в реках, особенно горных, например, форели.
Учитель. А где реакции окисления протекают быстрее и интенсивнее – в воздухе или в чистом кислороде и почему?
Биолог 3. И снова мы вспоминаем роман Ж.. Верна, где описано воздействие чистого кислорода на живые организмы: «Едва посеянные семена мгновенно показывали свои зеленые головки и росли не по дням, а по часам. Кочаны капусты становились кустами, а грибы - зонтиками. Но, увы! Все эти растения быстро блекли и умирали, истощенные и обессиленные. То же происходило и с домашними животными, от дворового пса до свиньи в хлеву».
Учитель: Объясните этот отрывок. Прав ли Жюль Верн?
Биолог 3. Живые организмы приспособились в ходе эволюции к дыханию воздухом, а не чистым кислородом. В случае же дыхания чистым кислородом ускоряются окислительные процессы обмена веществ и человеческий организм быстрее «сгорает». Писатель в чем-то был прав.
Учитель. Все живые существа на Земле дышат кислородом. А как кислород попадает в организм человека?

Рис.12 «Газообмен в легких человека»
Биолог. Человек дышит легкими. Кислород из воздуха проникает через мембраны легочных пузырьков в кровь, а СО2 – из крови в воздух.



















