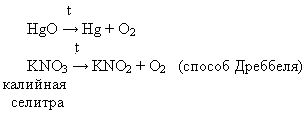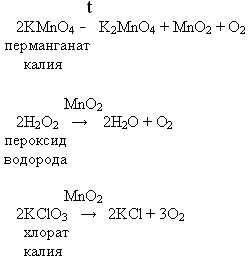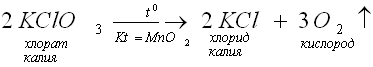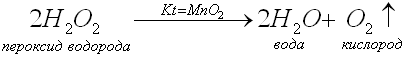Организационный момент.
Вводная часть
– Какую главу изучаем? (Простые вещества.)
– Какие вещества называются простыми? (Вещества, молекулы которых состоят из атомов одного вида.)
– На какие группы делятся простые вещества? (На металлы и неметаллы.)
Изучение нового материала.
Мы продолжаем знакомиться с простыми веществами. Сегодня узнаем больше о веществе, о котором Берцелиус сказал, что вокруг него вращается земная химия. Что это за вещество вы узнаете, выполнив следующее задание. Вместо … вставьте слово, которое соответствует элементу вещества, и запишите слово в тетради.(Приложение 2.)
1. … – самый распространенный элемент земной коры.
2. Молекула простого вещества озона образована элементом …
3. В воздухе содержится 21% …
4. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является …
5. В состав воды входят два атома водорода и один атом …
– Вы записали одно слово?
– Кто записал несколько слов?
– Какое это слово? (Кислород.)
Итак, начинаем изучать простое вещество кислород!
– Почему изучаем эту тему? Чем важен кислород? (Кислород необходимое вещество для дыхания, самый распространенный элемент земной коры, входит в состав воды.)
– В разделе простые вещества стоит жизненная задача, которая связана с кислородом. Прочитайте ее.
Жизненная задача.
Для путешествия по пещере необходим запас кислорода. Как его можно добыть в походных условиях?
– На основе жизненной задачи скажите, что должны изучать сегодня? (Как получают кислород?)
Тема урока: “Получение кислорода”.
При изучении этой темы:
вы узнаете, какие вещества и химические реакции используются для получения кислорода;
научитесь записывать соответствующие уравнения реакций;
научитесь получать кислород и доказывать его наличие.
Для решения той жизненной задачи, которая перед нами стоит, поработайте в группах.
Класс разбит на пять групп по 4 человека. Каждая группа имеет свое задание. (Приложение 1.)
– Внимательно изучите информацию, ответьте на вопросы, запишите уравнения реакций.
Работа в группах.
Затем представление выполненного задания. Один представитель от группы отвечает устно на вопросы задания, а второй записывает уравнения реакций на доске.
– Будьте внимательны, слушая друг друга. По ходу ваших выступлений будем оформлять схему – получение кислорода.
Используя кислород воздуха для дыхания, уменьшаем его количество. Но содержание в воздухе остается постоянным – 21%. Как же поддерживается необходимое нам постоянное содержание кислорода? Как получается кислород в природе?
Выступление 1 группы о получении кислорода в природе.
Уравнение реакции 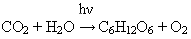
Общий вывод: кислород в природе получается благодаря процессу фотосинтеза в растениях на свету.
Оформляется часть схемы
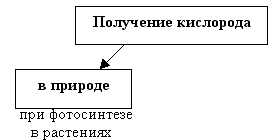
– Подходит ли данный способ для решения жизненной задачи? (Нет, для фотосинтеза необходим свет.)
Кислород необходим не только в природе. В промышленности его используют для получения металлов и других необходимых веществ. Для этого кислород необходим в больших количествах. Способы получения, которые используются при этом, так и называются – промышленные.
Выступление 2 группы о получении кислорода в промышленности.
Уравнение реакции 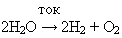
Общий вывод: кислород в промышленности получают из воздуха и воды.
– Почему для получения больших количеств кислорода используют воздух и воду? (наиболее распространенные вещества в природе, содержащие кислород)
Оформляется часть следующая часть схемы “Получение кислорода”
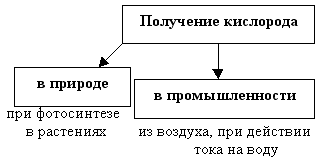
– Подходит ли данный способ для решения жизненной задачи? (нет, дорогостоящее оборудование, такие процессы занимают много времени)
В Англии на одной из площадей г. Лидса стоит памятник ученому. В правой руке он держит линзу, чтобы собрать пучок солнечных лучей, а в левой – тигель с оксидом ртути. Молодой человек сосредоточен и внимателен, ожидает результаты опыта. Это Джозеф Пристли, англ. ученый, запечатленный в момент получения кислорода в своей лаборатории.
Рассматриваем лабораторные способы получения кислорода.
Выступление 3 группы о некоторых способах получения кислорода в лаборатории.
Уравнения реакций
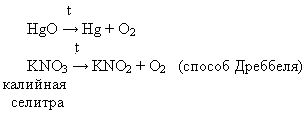
Все химические реакции разложения.
Вывод: данные способы не подходят для решения жизненной задачи, т.к. соединения ртути ядовито, а калийной селитры может и не оказаться в походных условиях.
– Этими лабораторными способами не ограничивается получение кислорода. Есть еще несколько способов получения кислорода в лаборатории.
Выступление 4 группы о наиболее распространенный способах получения кислорода в лаборатории.
Уравнения реакций
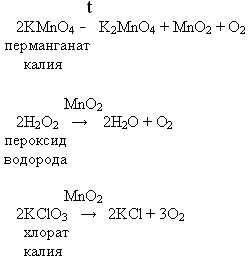
MnO2 – катализатор, ускоряет химическую реакцию, но сам при этом не расходуется.
Все химические реакции разложения.
Общий вывод: в лаборатории кислород получают реакциями разложения кислородсодержащих веществ при нагревании или действии катализатора.
Оформляется оставшаяся часть схемы.
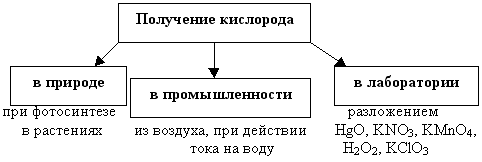
– Оцените данные вещества, условия протекания реакций для использования в походных условиях.
Учащиеся высказывают предположения.
Например, для получения кислорода в походных условиях можно использовать реакцию разложения перманганат калия, который всегда есть в аптечке. Можно использовать также разложение пероксида водорода, для данной реакции применить в качестве катализатора можно кровь, слюну, которые содержат природные катализаторы.
– Получив кислород, необходимо также определенным образом его собрать и доказать наличие.
Выступление 5 группы о способах собирания кислорода и доказательстве его присутствия.
Общий вывод: кислород собирают методом вытеснения воздуха и воды, наличие кислорода доказывают с помощью тлеющей лучинки.
Выполнение лабораторной работы “Получение кислорода разложением перманганата калия и доказательство его наличия” в парах.
Перед работой повторяются правила по технике безопасности при работе со спиртовкой и при нагревании.
Заключение.
– Достигли ли целей урока?
– Как получают кислород?
Вывод по уроку: кислород можно получить в природе, промышленности и лаборатории. Для получения кислорода используют реакции разложения кислородсодержащих веществ. Реакции протекают при нагревании или в присутствии катализатора.
Домашнее задание.
Выберете то задание, которое вам больше нравится.
Задание № 1.
Расскажите своему другу, который отсутствовал на уроке изучения темы “Получение кислорода”, используя знания о стилях речи, полученные на уроках русского языка.
Задание № 2.
Подготовить выступление для школьной конференции – Ломоносовские чтения на тему “История открытия кислорода”, используя знания о стилях речи, полученные на уроках русского языка.
Обсуждение выполнения опыта.
Поделитесь своими впечатлениями об уроке. Сформулировать предложение вам поможет рефлексивный экран. Закончите следующие предложения.
Сегодня я узнал(а) …
Было трудно …
Теперь я могу …
Я понял, что …
У меня получилось ..
Было интересно …
Меня удивило …
Мне захотелось …
Учитель: С помощью языка химии необходимо на доске записать: кислород как химический элемент и как простое вещество.
Кислород – как элемент – О .
Кислород – как простое вещество – О2.
Учитель: Сейчас на экране появится несколько фраз (изречений), вам нужно определить в каком значении упоминается в них кислород – как химический элемент или как простое вещество.
Слайд 4
Задание: Определите кислород как химический элемент или простое вещество.
Кислород входит в состав жизненно важных органических веществ: белков, жиров, углеводов.
Все живые вещества на Земле дышат кислородом.
В состав ржавчины входят железо и кислород.
Рыбы дышат кислородом, растворенным в воде.
При фотосинтезе зеленые растения выделяют кислород.
Учитель: Вам необходимо с помощью ПСХЭ им. Д.И.Менделеева дать характеристику химическому элементу “Кислород”, по следующему плану:
Слайд 5:
Порядковый номер –
Относительная атомная масса –
Период –
Группа –
Подгруппа –
Валентность –
Учитель: Проверим, внимание на экран
Слайд 6
Порядковый номер – 8
Относительная атомная масса – Ar(О) = 16
Период – второй
Группа – VI
Подгруппа – а (главная)
Валентность – II
Слайд 7
Распространение кислорода в природе:
Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород – 49%, далее следуют кремний – 26%, алюминий – 7%, железо – 5%, кальций – 4%, натрий – 2%, калий – 2%, магний – 2%, водород – 1%.
В биосфере около 65% от массы живых организмов приходится на кислород.
В гидросфере на его долю приходится 89%.
В атмосфере: 23% по массе, 21% по объему.
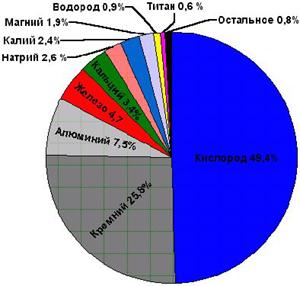
Рис. 2
Учитель: Вам необходимо с помощью ПСХЭ им. Д.И.Менделеева дать характеристику простому веществу “Кислород”.
Итак, какова же химическая формула простого вещества – 02
Относительная молекулярная масса Мг(02) = 32
Слайд 8
История открытия кислорода.
| 
Рис. 3 
Рис 5 | 
Рис. 4 
Рис. 6 |
Учитель комментирует: В 1750 году М.В. Ломоносов провел опыты и доказал, что в состав воздуха входит вещество, окисляющее металл. Он назвал егофлогистоном.
Получил кислород в 1771 году Карл Шееле. Независимо от него кислород был получен Дж. Пристли в 1774 году.
А история простая…
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета , без названья,
Ярче в нем горит свеча.
А не вреден для дыханья?
Не узнаешь у врача!
Новый газ из колбы вышел –
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит…
В 1775 году А. Лавуазье установил, что кислород – составная часть воздуха и содержится во многих веществах.
Из атомов мир создавала природа:
Два атома легких взяла водорода,
Прибавила атом один кислорода –
И получилась частица воды,
Море воды, океаны и льды…
Стал кислород
Чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
И на Земле появились растения.
Жизнь появилась:
Дыханье, горенье…
Первые птицы и первые звери,
Первые люди, что жили в пещере…
Огонь добывали при помощи трения,
Хотя и не знали причины горения.
Роль кислорода на нашей Земле
Понял великий Лавуазье.
Учитель: Теперь познакомимся с кислородом на опыте. Так как мы будем использовать нагревательный прибор (спиртовку), необходимо вспомнить ТБ при работе со спиртовкой:
Пользуясь спиртовкой, нельзя ее зажигать от другой спиртовки, так как может пролиться спирт и возникнет пожар.
Чтобы погасить пламя спиртовки, ее следует закрыть колпачком.
Налейте в химический стакан раствор Н2О2 (пероксида водорода).
Зажгите спиртовку, поднесите лучину в пламя и затушите лучину. Потом добавьте оксид марганца (IV) в химический стакан и поднесите тлеющую лучину к стакану – что наблюдается?
Ученик: Лучина – вспыхивает. Таким способом мы определили, что в химическом стакане находится кислород.
Учитель: В данном опыте оксид марганца (IV) является катализатором – веществом, которое ускоряет процесс химической реакции, но сам при этом не расходуется.
Демонстрационный эксперимент: “Получение кислорода из перманганата калия”.
Собираем прибор.
Собираем кислород методом вытеснения воздуха в коническую колбу, через некоторое время проверяем на наличие кислорода, с помощью тлеющей лучины, если она вспыхивает, то кислорода собрано достаточное количество.
Закрываем резиновой пробкой и выставляем на подъемный столик.
И предлагаем учащимся охарактеризовать физические свойства кислорода по следующим критериям.
Слайд 9
Агрегатное состояние -...
Цвет – ...
Запах – ...
Растворимость в воде – ...
t o кип. –...
Электропроводность – ...
Теплопроводность – ...
Тяжелее или легче воздуха
Учитель: Проверим, внимание на экран.
Слайд 10
Агрегатное состояние – газ.
Цвет – без цвета
Запах – без запаха
Растворимость в воде – плохо растворим
t° кип. – 183°С
Электропроводность – неэлектропроводен
Теплопроводность – плохо проводит тепло (плохая)
Тяжелее воздуха
Учитель: Ставим перед учащимися проблемный вопрос: Почему на картинке кислород в виде жидкости голубого цвета?
Слайд 11

Рис. 7
Ответ учащихся (дополняет учитель): Этот кислород в сжиженном состоянии, а жидкий кислород голубого цвета.
Теперь давайте обобщим и запишем в тетрадь разные способы получения кислорода, которые мы сегодня с вами наблюдали.
Слайд 12
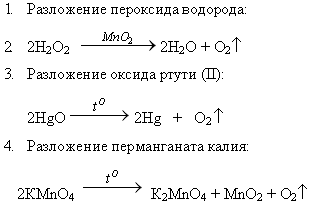
Способы получения кислорода: I. Лабораторные способы:
1. Разложение пероксида водорода:
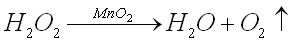
2. Разложение оксида ртути (II):
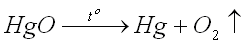
3. Разложение перманганата калия:
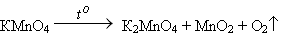
Задание для учащихся: расставьте коэффициенты в данных уравнениях реакций.
Учитель: Проверим, внимание на экран.
Слайд 13
Учитель: Вопрос для учащихся: из какого вещества еще можно получить кислород?
Ученик: Электролиз воды
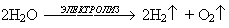
Записываем в тетрадь определение:
Электролиз – действие постоянного электрического тока.
Слайд 14
А теперь обобщаем способы собирания кислорода, которые вы сегодня видели на уроке.
| 
Рис. 8
| 
Рис. 9
|
| Собирание кислорода методом вытеснения воды | Собирание кислорода методом вытеснения воздуха |
Написание теста: Приложение 1
Учитель. Сегодня на уроке мы обобщаем и систематизируем материал по теме: “Кислород.Оксиды.Горение.”. Урок у нас не совсем обычный, мы будем играть!
Он повсюду и везде:
В камне, воздухе, в воде;
Он и в утренней росе,
И в небес голубизне.
Ребята, о каком химическом элементе идёт речь? Конечно, о кислороде!
Для того, чтобы повторить теоретический материал проведём химический диктант (5-7минут). /За диктант каждый ученик получает отметку/
1этап. /индивидуальный/. Химический диктант. /прим. Если утверждение соответствует простому веществу – кислород, то ставим “+”, если нет “-”.
В промышленности получают из воздуха.
Хорошо растворим в воде.
Взаимодействует с простыми и сложными веществами.
Применяют в качестве топлива.
Сложное вещество.
Получают при разложении оксидов.
При обычных условиях – бесцветный газ.
Взаимодействует со щелочами.
Газ, имеющий запах.
Собирают вытеснением воздуха.
Принимает участие в процессах окисления.
В природе встречается только в связанном виде.
Простое вещество.
В лаборатории получают при разложении перманганата калия.
Поддерживает горение.
Легче воздуха.
Собирают в сосуд, поставленный обычно на дно.
Горит бесцветным пламенем.
Применяют для получения минеральных удобрений.
Малорастворим в воде.
В природе встречается в свободном и связанном виде.
При обычных условиях – жидкость.
Разлагается при нагревании.
Собирают в перевёрнутый вверх дном сосуд.
Тяжелее воздуха.
При Т= -1830С превращается в жидкость.
В промышленности получают из природного газа.
Входит в состав минералов.
Необходим для дыхания.
Применяют для сварки и резки металлов.
Учитель. Мы вспомнили теорию, а теперь в путь, по станциям! Удачи!
(Капитан каждой команды берёт путевой лист, в котором консультант будет отмечать отметки участников команды). (Приложение 1 )
Каждой команде следует пройти все туры и на каждом выполнить определённое задание. В перерыве между выполнением заданий каждой команде следует решить кроссворд по теме: “Кислород”. (Приложение 2)
2 этап (командный).
Девиз урока:
Кислород – это вещество, вокруг которого вращается вся земная химия. (Я.Берцелиус)
Учитель: Сегодня мы совершим необычное путешествие в «Мир удивительного вещества».
А что это за вещество, почему именно оно, догадайтесь сами. В этом вам помогут загадочные картинки.
(На экране появляются картинки, отражающие области применения кислорода).
Рисунок 1
Рисунок 2
Рисунок 3
? Что объединяет все эти картинки?
(Учащиеся предлагают свои варианты ответов).
Учитель: Итак, мы совершаем путешествие в «Мир кислорода».
(На доске появляется девиз урока, учащиеся записывают тему урока в тетрадь).
Но прежде, чем отправляться в путешествие, давайте вспомним,
? Что вы уже знаете о кислороде?
(Фронтальная беседа с учащимися)
Учитель: Вы уже многое знаете, но этого мало. Давайте познакомимся с кислородом поближе.
Итак, в путь.
Наша первая остановка – Историко-информационная.
? Когда же и кем был открыт кислород на Земле?
(В ходе рассказа учителя на экране появляются портреты ученых-химиков)
Еще в начале XVII веке газ, позже названный кислородом, был выделен изобретателем подводной лодки К. Дреббелем, который установил его способность поддерживать дыхание.
Рисунок 4 и Рисунок 5
Однако результаты этих исследований были засекречены из-за их военной направленности, и поэтому они не были известны современникам.
В 1750 году М.В.Ломоносов на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее металл.
Рисунок 6
В 1771 году – это вещество было получено шведским химиком Карлом Вильгельмом Шееле.
Рисунок 7
В 1774 году независимо от него кислород был получен также английским химиком и философом Джозефом Пристли.
Рисунок 8
Джозеф Пристли как-то раз, нагревая оксид ртути, получил вдруг странный газ.
Газ без запаха и цвета, ярче в нем свеча горит.
А не вреден для дыханья?
О чем все это говорит?
Джозеф Пристли считал этот газ воздухом.
И все-таки главная фигура в истории открытии кислорода – великий французский химик Антуан Лоран Лавуазье, объяснивший смысл опытов, проведенных этими учеными. В 1775 году он установил, что кислород входит в состав воздуха и содержится во многих веществах.
Рисунок 9
? А откуда взялось это название?
Кислород – оксигениум – рождающий кислоты. Так решили назвать этот элемент, так как кислород встречался во многих кислотах, которые были известны к моменту открытия элемента. Хотя вначале этот элемент Лавуазье назвал «жизненным газом».
? А как вы думаете, почему?
? Где же на Земле встречается кислород?
Это мы узнаем на следующей станции «Составная»
Учащиеся предлагают свои варианты.
Учитель:
Он повсюду и везде:
В земле, в воздухе, в воде.
Он и в утренней росе,
И в небес голубизне.
Кислород – наиболее распространенный на Земле химический элемент.
(На доске «Таблица распространенности кислорода на Земле»)
Литосфера на 47% по массе состоит из кислорода, входящего в состав различных сложных веществ: оксидов и солей.
В атмосфере в воздухе содержится 23% по массе свободного молекулярного кислорода.
Гидросфера содержит 85,8% кислорода, основная доля которого приходится на воду.
Кислород также входит в состав растений (около 40%), животных (около 20%), минералов, большинства солей, кислот, органических соединений.
Тело человека примерно на 65% состоит из кислорода.
А если химического элемента на Земле много, следовательно этот элемент очень важен. А важность кислорода определяется его свойствами.
Кислород – восьмой по счету,
Если вес за меру взять.
Если ж мера – место в жизни,
Номер надо поменять.
Вся важность кислорода определяется его свойствами.
Итак, следующая станция «Свойственная»
?Какими физическими свойствами обладает кислород?
(Фронтальная беседа с учащимися о физических свойствах кислорода, которые им известны).
Учитель: Физические свойства кислорода:
(важнейшие свойства появляются на экране)
газ без цвета, вкуса, запаха, тяжелее воздуха, плохо растворим в воде (рыбы дышат кислородом, растворенном в воде, в 100 л воды растворяется 5 л кислорода при давлении 1 атмосфера и температуре 0 градусов), t кипения – 182,9 градусов, t плавления – 218,8 градусов.
Здравствуйте, ребята! Сегодня мы продолжаем изучать новую тему “Кислород”. Тема нашего урока “Получение кислорода и изучение его химических свойств”. Откройте тетради, запишите число - 19 ноября и тему урока.
– Каковы цели нашего урока? (Получение кислорода, его собирание, распознавание и изучение его свойств). Верно! Мы не только научимся получать кислород, но и собирать и распознавать, а также будем наблюдать, как он реагирует с другими веществами. Кроме этого продолжим учиться писать уравнения химических реакций и расставлять в них коэффициенты.
Актуализация знаний. На прошлом уроке мы начали рассматривать некоторые свойства кислорода. Проверим, что вы запомнили. Напишем небольшой химический диктант. Я буду называть некоторые свойства, если они соответствуют свойствам кислорода вы пишите “Да”, если нет – то ставьте прочерк. Пронумеруйте задания цифрами от 1 до 12, в столбик.
Химический диктант
1. Это газ, имеющий запах (нет).
2. Он занимает 1 место во Вселенной по распространенности (нет).
3. При обычных условиях это газ без цвета, вкуса и запаха (да).
4. В лаборатории его можно получить из марганцовки (да).
5. Он легче воздуха (нет).
6. Он может быть твердым (да).
7. Его первым получил Ломоносов (нет).
8. В природе он в свободном состоянии не встречается, только в связанном (нет).
9. При температуре минус сто восемьдесят три градуса он превращается в жидкость (да).
10. В 1000 мл воды растворяется 30 мл этого газа (да).
11. Он получен Дж. Лавуазье из оксида ртути (да).
12. Его рейтинг на планете Земля самый высокий среди других элементов (да).
4. Проверка диктанта (на доске записаны правильные ответы) и самооценка
Оценивание:
12 – 11правильных ответов “5”,
10 – 9 правильных ответов “4”,
8 – 7 правильных ответов “3”.
Поднимите руки, кто получил “5”? Кто получил – “4”? Кто получил – “3”?
Мы только начали изучать данную тему и у вас есть возможность поработать над своими ошибками и пробелами в знаниях.
5. Изучение нового материала.
В тетрадях записываем лабораторная работа, тему и цель: получить, собрать, распознать газ кислород и изучить его взаимодействие с другими веществами.
Фронтальная беседа.
- Из каких веществ можно получить кислород? (Перечислить, написать уравнения)
- Как можно собрать кислород? (Назвать два способа и обьяснить на каких свойствах кислорода они основаны)
- Как распознать кислород?
Выполняем опыт №1 “Получение кислорода из Н2О2”. В тетрадь записать:
Уравнение.
Способ собирания кислорода.
Распознавание кислорода.
Вывод.
В пробирке – кусочек Н2О2 (тв.) – закройте пробирку газоотводной трубкой, конец ее поместите в стакан, закрепите ее в держателе и нагревайте. Кислород тяжелее воздуха, он будет вытеснять воздух и займет объем стакана. Зажгите лучинку, потушите, тлеющею внесите в стакан с О2. Что мы наблюдаем? Где лучше горит лучинка? Почему?
Какой вывод сделаем? (Лучинке лучше гореть в кислородной среде, чем в воздухе, т.к. в воздухе есть другие вещества.)
Проведем опыт №2 “Получение О2 из Н2О2 в присутствии МпО2”.
Снова будем получать О2 из Н2О2 – но не твердой, а раствора. МпО2 – это оксид марганца, порошок черного цвета. Прилейте к нему раствор Н2О2, закройте пробкой с газоотводной трубкой, конец ее поместите в стакан и наблюдайте.
- Что происходит с раствором (в нем появляются пузырьки ).
- Почему появились пузырьки? Какой газ при этом выделяется? (Кислород). Как доказать, что это кислород? (Тлеющей лучинкой).
- Опустите в стакан тлеющую лучинку, что происходит? (Лучинка загорается).
Дайте лучинке погореть и добавьте раствор Са(ОН)2 - известковой воды. Что наблюдаем? (Прозрачный раствор известковой воды мутнеет, т.к. при горении лучинки образуется углекислый газ, который взаимодействует с известковой водой, образуя нерастворимую соль карбонат кальция).
Запишите в тетрадь:
Опыт № 2 “Получение кислорода из Н2О2 в присутствии МпО2”
Уравнение.
Способ собирания кислорода.
Распознавание.
Вывод:
- Как вы считаете, какой способ получения О2 более простой? Более безопасный? Обоснуйте свою точку зрения. Запишите вывод. (В присутствии МпО2 – катализатора, реакция идет быстрее. Катализаторы – вещества, которые ускоряют химические реакции).
А сейчас рассмотрим с какими веществами реагирует кислород.
Дидактический материал: учебник “Химия 8 класс” Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара; химический диктант (Приложение 1), проверочные листы (Приложение 2) и (Приложение 3).
Тип урока: комбинированный. Основная часть – формирование новых знаний и умений.
Эпиграф к уроку:
Кислород – это вещество, вокруг которого вращается земная химия.
Берцелиус
| Этап урока | Содержание деятельности учителя | Содержание деятельности учащихся | Ожидаемый результат |
| I. Организационный этап | Учитель приветствует учащихся, определяет готовность к уроку. Далее обращает внимание ребят на эпиграф, написанный на доске: “Кислород – это вещество, вокруг которого вращается земная химия”. Берцелиус – Ребята, в чём заключается роль кислорода на Земле и в жизни человека?
– Как вы понимаете этот эпиграф?
– Зачем нам нужно знать о кислороде больше информации? | Учащиеся, используя информацию прошлого урока, в устной форме проговаривают, что роль кислорода на Земле и в жизни человека глобальна. Дети определяют цели изучения темы. | После краткой беседы эмоциональное напряжение начального этапа снято, и учащиеся проявляют психологическую готовность к познавательной деятельности. |
| II. Актуализация знаний учащихся | Учитель раздаёт на каждую парту лист с химическим диктантом /приложение 1/ и даёт такие комментарии: – Ребята, я предлагаю вам выполнить это задание для того, чтобы вы вспомнили ключевые понятия прошлого урока. Многие характеристики кислорода помогут нам более детально разобраться в теме сегодняшнего урока. | Учащиеся выполняют задание по пройденной теме: “Общая характеристика кислорода, его физические свойства и способы получения” в своих тетрадях индивидуально. | Актуализируются опорные знания учащихся. Ребята подготавливаются к восприятию нового материала. |
| Далее учитель вывешивает на доску “ключ” ответов:
Знак “+” 1 3 4 7 9 10 11 12 14 15 и организует самостоятельную деятельность детей по взаимопроверке отработанных знаний. – Я прошу вас продемонстрировать результат выполненной работы; поднимите руку те дети, кто получил положительную оценку. (Если в классе окажутся дети с неудовлетворительной оценкой, учитель предложит им выполнить это задание ещё раз на следующем уроке). | Ребята обмениваются друг с другом своими тетрадями и производят проверку по “ключу” ответов, оценивают полноту знаний, выставляют оценки, обсуждают результаты. Демонстрируют результат выполненной работы. | Данная деятельность способствует развитию умений компетентно оценивать свою деятельность и деятельность друг друга, определять собственные трудности и достижения. |
| III. Целеполагание и планирование | 1. Определение темы и целей урока. – Предлагаю вашему вниманию небольшое стихотворение, внимательно его послушайте и попытайтесь назвать тему урока, а также определить, чему мы будем учиться на этом уроке. Гореть, светить и окисляться,
Со мной в оксиды превращаться.
Да, будет свет, тепло и жар,
Мой, кислорода, это дар! – Какие фразы из этого стихотворения говорят о признаках химической реакции? Учитель стимулирует учащихся к высказываниям без боязни ошибиться. – Какую цель мы поставим перед собой при изучении данной темы? Ключевые фразы учитель фиксирует на доске: узнать химические свойства кислорода; меть записать уравнения химических реакций; уметь назвать полученные вещества. | Учащиеся формулируют свои варианты темы урока, а учитель направляет их к правильному варианту. Учащиеся отвечают, что горение, выделение теплоты и света, превращение одного вещества в другое вещество – это и есть признаки химической реакции, следовательно, тема сегодняшнего урока “Химические свойства кислорода”. Записывают тему в тетрадь. Определяют цели урока, планируют свою деятельность. | Мотивация на приобретение новых знаний. Учащиеся осознают компоненты учебной деятельности и мотивы собственных действий. |
| V. Валеологическая пауза | Учитель предлагает классу выполнить несколько упражнений для пальчиковой гимнастики: – “солнечные лучи”, “ножницы” и упражнения на развитие познавательно-психических процессов: – “качание головой”, “сова” (Приложение 4) | Учащиеся выполняют упражнения, предложенные учителем. | Ребята отдохнули и готовы для дальнейшей работы. |
| VI. Закрепление изученного материала | 1. Групповая работа по закреплению полученных знаний. Учитель организует самостоятельную деятельность учащихся по нахождению соответствий предложенных явлений с реакциями горения и медленного окисления: – Для того, чтобы вы более детально разобрались в сущности реакций горения и медленного окисления, я предлагаю вам выполнить в группах следующее задание (Приложение 2). Для выполнения задания учитель делит класс на 3 группы, раздаёт каждой группе проверочный лист (Приложение 2) и перед каждой группой ставит проблемный вопрос: – Среди перечисленных явлений выберите те, которые относятся к реакциям горения и те, которые относятся к реакциям медленного окисления. Групповую работу выполните на проверочном листе, один человек от каждой группы должен подготовиться к ответу. Учитель создаёт условия для организации плодотворной работы в группе каждого учащегося, акцентирует важность участия и мнения каждого в деятельности группы. | Учащиеся выполняют задания в группах, проявляя собственные способности и возможности, обмениваются информацией друг с другом, готовятся к ответу и обоснованию его содержания. Приходят к заключению, что для выполнения задания им необходимо знать понятия реакции горения и реакции медленного окисления. Один учащийся из каждой группы выступает перед классом с пересказом содержания тех знаний, которыми обладает группа. Другие учащиеся имеют возможность контролировать ответ, задавать вопросы, ликвидировать пробелы в знаниях. | Ребята актуализируют знания, ликвидируют пробелы в знаниях. Результатом данной работы является формирование сотрудничества, понимание того, каким образом можно использовать полученные знания на практике. Мотивация достижений коллективного успеха. |
| 2. Индивидуальная дифференцированная работа по закреплению полученных знаний. Учитель организует самостоятельную деятельность детей с целью проверки полученных ими новых знаний. Для этого раздаёт на каждую парту проверочный лист /приложение 3/ и просит выполнить задание индивидуально каждого. Предложенные задания дифференцированы по сложности на 3 уровня, т.е.учитель создаёт ситуацию выбора: | Каждый ребёнок сам определяет задание, какой сложности он выполнит в своей тетради. После выполнения задания учащиеся сдают тетради учителю. | Учащиеся определяют границы известного материала путём применения для выполнения заданий полученных знаний. Результатом работы является определение достаточности собственных знаний. |
| VII. Рефлексия | Учитель совместно с учащимися оценивает урок и принимает их предложения и пожелания: – Чему каждый из вас научился на сегодняшнем уроке?
– Освоены ли понятия: реакция окисления, реакция горения, реакция медленного окисления, оксиды?
– Были ли моменты непонимания?
– Смогли ли мы их разрешить в ходе разговора?
– Назовите самые удачные ответы ваших товарищей.
– Сформулируйте советы себе и другим, над чем нужно ещё поработать.
– Что вам понравилось или не понравилось на уроке и почему?
– Что бы хотелось выполнить ещё раз, а что сделать по-другому? | Ребята отвечают на вопросы, оценивают полноту полученных знаний, производят самооценку своей работы. Выявляют наиболее интересные и полноценные ответы, обосновывают свою точку зрения. | Учащиеся выявляют степень выполнения учебных целей. |
| VIII. Задание на дом | – Ребята, что необходимо сделать для полного усвоения темы? Учитель фиксирует домашнее задание на доске и разъясняет, как следует рационально организовать свою учебную работу при выполнении домашнего задания: § 60, 61, ответить на вопросы после параграфа, отмеченные треугольником и квадратом. Составить конспект на тему “Применение кислорода”, используя информацию § 62. (это задание для всех) Задания, отмеченные кружочком и звёздочкой, выполняют желающие учащиеся. Также для желающих ребят учитель предлагает выполнить следующие творческие задания: Составить кроссворд, ключевое слово которого “кислород”; Составить плакат, листовку о вреде пожаров, об осторожном обращении с огнём; Сочинить сказку, стихи об огне. (Все творческие задания, выполненные учащимися, оцениваются учителем) В финале урока можно зачитать стихотворение: Примерно века два назад
Открыт он был случайно.
Сейчас знаком с ним стар и млад,
И он для вас не тайна.
Известно, что горят отлично
В нём сера, фосфор, углерод,
Железо, магний. Энергично
Сгорает также водород.
Без газа этого на свете
Не жили б звери и народ.
Его назвать могли бы дети,
Теперь и вам известно – это кислород! – Урок завершён, всем спасибо. |
|
|
Ход урока
Учитель: Наш урок посвящен химическому элементу и веществу им образованному, который занимает особое место в жизни человека и всего живого.
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно без …
Ученики: Без кислорода
Учитель: На уроке вы больше узнаете о химическом элементе — кислороде, о простых веществах — кислороде и озоне, выясните, что такое аллотропия и аллотропные модификации, а также узнаете, как и кем был открыт кислород. Попытаемся получить его в лаборатории, собрать и доказать его наличие в сосуде. Запишете тему урока в своих тетрадях.
Учитель: На доске составляем план характеристику химического элемента кислорода. Выйти к доске и записать этот план (по желанию). Все остальные это делают в тетради.
План характеристика химического элемента:
Символ — О
Положение в ПСХЭМ — VI Г (А)
II период
Порядковый номер — 8.
Химическая природа — неметалл.
Относительная атомная масса — Ar (O) = 16
Валентность — II.
Учитель: Как вы думаете, в каком виде кислород содержится в природе? Какие образует вещества? Ответы учащихся могут быть разными. Для того, чтобы познакомиться с этим вопросом, посмотрим презентацию учащихся. Посмотрев ее, ответьте на эти вопросы.
Примечание: Далее идет презентация учащихся: “Нахождение кислорода в природе. Аллотропия. Кислород и озон (5-6 мин.)”.
Учитель: Перед вами на столе лежит таблица. Для того, чтобы ее заполнить, немного обсудим эти вопросы.
Ученик: О2 и О3. Молекула кислорода состоит из 2-х атомов кислорода, а молекула озона из 3-х атомов кислорода.
Учитель: Какова относительная молекулярная масса кислорода и озона?
Ученик: Mr(O2) = 32; Mr (O3) = 48.
Учитель: Каковы физические свойства кислорода? Каковы физические свойства озона?
Ученик: Кислород — газ, без цвета, вкуса, запаха, малорастворим в воде, тяжелее воздуха, при t = - 1870С превращается в жидкость бледно-синего цвета, а при t = -218, 80 С в синие кристаллы.
Озон — газ, голубого цвета, имеет запах свежести, в воде лучше растворим, чем кислород, тяжелее воздуха, при t = -1120С превращается в жидкость темно-синего цвета.
Учитель: Содержится ли кислород и озон в воздухе? Как эти газы там образуются?
Ученик: Кислород содержится в воздухе (21% по объему) образуется в результате фотосинтеза. Озон также содержится в атмосфере, примерно на расстоянии 10-30 км от поверхности Земли образуется в результате грозовых разрядов.
Учитель: Входит ли химический элемент кислород в состав различных сложных веществ?
Ученик: Кислород — самый распространенный химический элемент на Земле. Он входит в состав воды, углекислого газа, многочисленного класса кислот, оксидов, оснований, солей; а также образует органические вещества — белки, жиры, углеводы.
Учитель: Итак, мы подошли к очень важному понятию “аллотропия” и “аллотропные модификации”. Химический элемент кислород образует 2 простых вещества — кислород и озон, которые отличаются друг от друга составом, строением, свойствами. Такое явление называется “аллотропия”, а вещества, образованные одним и тем же химическим элементом, - “аллотропными модификациями” или видоизменениями. Запишем это в тетрадь. Откройте учебник § 58, стр. 155 — 156, и спишите определение в тетрадь.
Примечание: учащиеся переписывают в тетрадь определения.
Учитель: Явление существования различных простых веществ, образованных атомами одного и того же химического элемента и называется аллотропией, а простые вещества — аллотропными модификациями. Таким образом, О 2 и О 3, т.е кислород и озон — это аллотропные модификации химического элемента кислорода. Переходим к следующему этапу урока.
Учитель: Как же был получен кислород? Какие ученые впервые его получили? Посмотрим презентацию, подготовленную учащимися. Ваша задача записать фамилии и имена ученых и способы получения и собирания кислорода, которые эти ученые использовали.
Примечание: Идет презентация (5 — 7 мин.).
Ученик 1: Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду. Упоминание об этом элементе вполне могло появиться уже в VIII в. Сведения о нем - косвенные, разумеется, - есть в трактате китайского алхимика Мао Хао. Китайцы знали “деятельное начало”, входящее в состав воздуха, и называли его “йын”. В XV в. следы кислорода можно обнаружить в трудах Леонардо да Винчи. Потом снова теряются - до XVII в., когда голландец Дреббель изобретает подводную лодку. Он использует селитру, чтобы ее кислородом обогатить воздух в подводной лодке. Но этот факт остался незамеченным.
Ученик 2: В 1758 году М.В.Ломоносов склонен был признать, что в процессе горения участвует воздух, и на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее металл.
Ученик 3: Открытие кислорода является одним из важнейших событий в истории, и связано с именами учёных Д. Пристли, К .Шееле и А. Лавуазье.
Когда - то в древней Англии
Великий Пристли жил.
Все соблюдая правила;
Оксид он разложил.
Под куполом сосуда
Бесцветный газ собрал.
Старательно исследуя
Его он onucaл.
Не видим и безвкусен
Всех запахов лишен.
В воде не растворяется
Свеча сгорает в нем.
Ученый в изумлении:
Ну что за чудеса?
Горят легко в нем многие
Простые вещества
Этот газ из колбы вышел
Никому он не знаком
Этим газом дышат мыши
Под стеклянным колпаком
Дрова лучистым пламенем
Сгорали в нем, понятно.
Сам пробовал дышать-
Легко дышать, приятно.
Ученик 2: Вот как об этом писал сам Джозеф Пристли: “1 августа 1774 г. Я попытался извлечь воздух из ртутной окалины (оксида ртути) и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению”.
Ученик 1: Одновременно с Пристли кислород открыл и шведский ученый Карл Шееле. Шееле даже получил его раньше, чем Пристли, но сообщение об этом было опубликовано позже, чем открытие Пристли. И все-таки главная фигура в истории открытия кислорода - не Шееле и не Пристли. Они открыли новый газ - и только. Собственно открывшим кислород остается французский химик Антуан Лавуазье. В 1775 году он исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона (теория огненной материи). За два века, прошедшие со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась. Лавуазье дал название кислороду oxygenium - рождающий кислоту
Учитель: Каким образом ученые получали кислород? Что они использовали для этого?
Ученик: Разложением оксида ртути (II) Д. Пристли получил впервые кислород. Обнаружил его с помощью горящей лучины, она ярко вспыхивала и горела в кислороде.
Учитель: Для того, чтобы выяснить, как можно получить кислород в лаборатории, как можно собрать его, и как этот газ обнаружить посмотрим опыт в “Виртуальной лаборатории.” Способ получения кислорода разложением перманганата калия при нагревании”.
Примечание: По ходу просмотра опыта учитель акцентирует внимание учащихся на ключевых моментах, а именно: 1) уравнении реакции получения кислорода разложением перманганата калия при нагревании; 2) методах собирания кислорода вытеснением воздуха или воды.
Учитель: Запишем уравнение реакции разложения перманганата калия при нагревании:
![]()
а) методом вытеснения воздуха (рис. 53 стр. 158 учебника).
б) методом вытеснения воды (рис. 53 стр. 158 учебника)
Примечание: Учащиеся рассматривают рисунки в учебнике и записывают уравнение реакции и название двух методов собирания кислорода.
Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.
Катализаторы – это вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
Реакции, протекающие с участием катализаторов, называются каталитическими реакциями. Например, разложение бертолетовой соли (хлората калия).
Примечание: Ученики записывают определение понятий в тетради.
Затем идет презентация учителя (просмотр уравнения химической реакции разложения бертолетовой соли в присутствии катализатора MnO2). Учащиеся переписывают уравнение химической реакции в свои тетради.
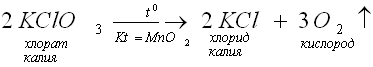
Учитель: А теперь попробуем сами получить кислород и доказать наличие газа в сосуде. У вас на столе стоит одна пробирка с оксидом марганца (IV) MnO2, в бутылочках пероксид водорода H2O2, лучинка, спички, спиртовка, пробиркодержатель.
Возьмите пробирку с черным порошком MnO2 (это катализатор), добавьте несколько миллилитров пероксида водорода. Сразу же жидкость начинает вскипать, бурно выделяя газ. Спиртовку зажгите и внесите лучинку. Тлеющую лучинку внесите в пробирку с газом. Лучинка ярко вспыхивает и горит до тех пор ,пока выделяется кислород. Кислород поддерживает горение.
Итак, мы провели каталитическую реакцию разложения пероксида водорода.
Посмотрим на презентации уравнение реакции разложения пероксида водорода в присутствии катализатора — оксида марганца (IV) и запишем его в тетрадь.
Примечание: Учитель демонстрирует уравнение реакции.
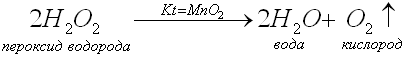
Учитель: А как же кислород получают в промышленности?
Примечание: Идет презентация учителя (просмотр уравнения реакции электролиза воды и метод получения кислорода испарением жидкого воздуха).
Учитель: Подведем итоги сегодняшнего урока. На уроке мы познакомились с химическим элементом кислородом, с его аллотропными модификациями — кислородом и озоном, их составом, строением, а так же познакомились с историей открытия кислорода, способами его получения в лаборатории и в промышленности, методами собирания и обнаружения этого газа. Узнали, что такое катализаторы, каталитические реакции.
Примечание: В конце урока целесообразно провести тестовую работу (минимум на 5-7мин).
Учитель: Для закрепления пройденного материала выполним тест.
Примечание: Учащимся раздается тестовое задание, проверка которого осуществляется просмотром слайда презентации.
Далее учитель задает домашнее задание и выставляет оценки.
Домашнее задание (написано на доске): прочитать и выучить § 53 и записи в тетрадях.