Тема. Первый закон термодинамики.
Цели:
образовательные:
сформировать знания о первом законе термодинамики: установить связь между изменением внутренней энергии системы, работой и количеством теплоты, переданной системе;
сформировать умения использовать первый закон термодинамики для описания газовых процессов;
развивающие:
развитие логического мышления,
развитие познавательного интереса;
воспитательные:
формирование коммуникативных качеств, культуры общения;
воспитание мировоззрения на основе метода научного познания природы.
Оборудование: пробирка химическая, термометр, цилиндр измерительный с холодной водой; лист бумаги, таблица «Удельная теплоемкость веществ»; проектор, экран, ноутбук.
Ход урока.
I. Оргмомент.
II.Проверка домашнего задания.
Кратковременная самостоятельная работа.
1 вариант.
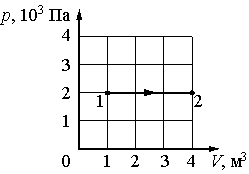
1. Какая работа совершается газом при переходе его из состояния 1 в состояние 2?
А. 6 кДж Б. 8 МДж В. 8 кДж Г. 6 Дж
2. Какую работу совершают 200 г водорода при изобарном нагревании на 100°С?
2 вариант.
1. Газ переходит из состояния 1 в состояние 2. Какую работу совершил газ в этом процессе?
А. 75 кДж Б. 45 кДж
В. -75 кДж Г. 30 кДж
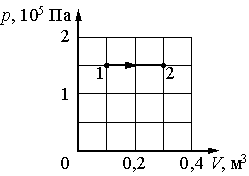
2. На сколько изменится внутренняя энергия 320 г кислорода при увеличении температуры на 100°С?
III. Мотивация учебной деятельности.
Фронтальный эксперимент.
«Вычисление изменения внутренней энергии тела при совершении работы»
Приборы и материалы: 1) пробирка химическая, закрытая пробкой; 2) термометр лабораторный от 0 до 100 °С; 3) цилиндр измерительный с холодной водой; 4) лист бумага; 5) таблица «Удельная теплоемкость веществ».
Порядок выполнения работы
1. Налейте в пробирку немного воды (8-10 г) и измерьте ее температуру.
2. Закройте пробирку пробкой и заверните в бумагу. Энергично встряхивайте воду в пробирке в течение 30-40 с.
3. Откройте пробирку и снова измерьте температуру воды.
4. Вычислите изменение внутренней энергии воды: ΔU = сm (t2-t1)
5. Ответьте на вопросы:
- Как изменялась внутренняя энергия воды во время опыта?
- Каким способом вы изменяли внутреннюю энергию воды в опыте?
- Зачем пробирку с водой необходимо было заворачивать в бумагу во время опыта?
- Что можно сказать о зависимости изменения внутренней энергии тела от совершенной работы?
IV. Сообщение темы урока.
(записали в тетрадь тему урока)
V. Изучение нового материала.
Исторический процесс изучения тепловых явлений, приведший к формулировке закона сохранения энергии, был длительным и трудным. Различны были методы исследования тепловых и механических явлений, способы измерения единиц таких величин, как количество теплоты и работа.
Прогресс в познании природы теплоты был достигнут, когда было доказано, что при теплообмене сохраняется энергия.
Нагревание тела может происходить без сообщения ему какого-либо количества теплоты, а только за счет совершения работы.
В больших масштабах такое явление наблюдал в 1798 г. Б. Румфорд. При сверлении пушечного ствола, которое производили с помощью лошадей, вращавших большое сверло, Румфорд успевал вскипятить поставленный на ствол котел с водой. Румфорд предположил, что вода нагревается в процессе совершаемой при сверлении работы.
Используя сухие кусочки дерева, можно добыть огонь, т. е. нагреть дерево до температуры, превышающей температуру его воспламенения.
Все перечисленные примеры показали, что количество теплоты сохраняется только при теплообмене, когда не совершается работа. Количество теплоты представляет собой величину, родственную работе. Повышение температуры тела может быть вызвано как совершением работы, так и передачей количества теплоты.
Количество теплоты, как и работу, надо считать мерой изменения энергии системы и выражать ее в тех же единицах, что и работу, т. е. в джоулях.
В середине XIX в. Д. Джоулем были проведены первые опыты, доказывающие эквивалентность количества теплоты, переданного телу, и работы.
В механике закон сохранения был получен из законов Ньютона. Общий закон сохранения энергии, включающий все ее формы, является опытным законом. Он был открыт немецким ученым Р. Майером в середине XIX века, английским ученым Д. Джоулем и получил наиболее полную трактовку в трудах немецкого ученого Г. Гельмгольца.
I закон термодинамики
ΔU = A + Q
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе.
Q = ΔU + А
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин, характеризующих состояние газа, остаётся неизменной (изопроцессы). При этом газ будем считать идеальным.
Изохорный процесс. При изохорном процессе объём газа не меняется, и поэтому работа газа равна нулю:
ΔU = Q.
Если газ нагревается, то Q 0 и ΔU 0, его внутренняя энергия увеличивается. При охлаждении газа Q
Изотермический процесс. При изотермическом процессе (Т = const) внутренняя энергия идеального газа не меняется. Всё переданное газу количество теплоты идёт на совершение работы:
Q = А'.
Если газ получает тепло (Q 0), то он совершает положительную работу (А' 0). Если газ отдаёт тепло окружающей среде, то Q
Изобарный процесс. При изобарном процессе согласно передаваемое газу количество теплоты идёт на изменение его внутренней энергии и на совершение им работы при постоянном давлении:
Q = ΔU + А'.
Адиабатный процесс. Газ может совершать работу и без сообщения ему теплоты.
Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным процессом.
Так, если сосуд с газом теплоизолировать от окружающей среды и предоставить возможность газу расширяться, то сила давления газа будет совершать положительную работу.
Согласно первому закону термодинамики количество теплоты, сообщенной системе (газу), идёт на изменение внутренней энергии системы и на совершение системой механической работы. В данном случае системе теплота не сообщается и работа равна изменению внутренней энергии, взятому с обратным знаком:
А' = -ΔU (Q = 0).
Если газ расширяется, то положительная работа совершается газом за счёт уменьшения внутренней энергии: А' 0, ΔU
При сжатии газа, когда внешние силы совершают положительную работу, а соответственно газ - отрицательную, внутренняя энергия газа увеличивается: А' 0. При адиабатном сжатии газ нагревается.
Адиабатный процесс вы можете наблюдать, накачивая насосом велосипедную камеру, насос быстро нагревается.
На горлышке бутылки с охлаждённой газированной водой при открывании образуется облачко тумана. При адиабатном расширении уменьшается температура, что приводит к конденсации пара.
Распространение звуковых волн, при котором происходит сжатие и разрежение воздуха, также является адиабатным процессом.
Повышение температуры при адиабатном сжатии наблюдается в дизельных двигателях. В них отсутствует система зажигания горючей смеси, необходимая для обычных карбюраторных двигателей внутреннего сгорания. В цилиндр засасывается не горючая смесь, а атмосферный воздух. К концу такта сжатия в цилиндр с помощью специальной форсунки впрыскивается жидкое топливо. К этому моменту температура воздуха так велика, что горючее воспламеняется.
Адиабатный процесс может быть реализован и при отсутствии теплоизоляции. Если процесс расширения или сжатия газа происходит настолько быстро, что за время процесса не успевает произойти теплообмен с внешней средой, то такой процесс также можно считать адиабатным.
VI. Закрепление изученного материала.
Стр. 259.
А1. Идеальный газ получил количество теплоты, равное 300 Дж, и совершил работу, равную 100 Дж. Как изменилась при этом внутренняя энергия газа?
1) увеличилась на 400 Дж 3) уменьшилась на 400 Дж
2) увеличилась на 200 Дж 4) уменьшилась на 200 Дж
А2. Идеальный газ совершил работу, равную 300 Дж. При этом его внутренняя энергия увеличилась на 300 Дж. В этом процессе газ
1) отдал 600 Дж 3) получил 600 Дж
2) отдал 300 Дж 4) получил 300 Дж
А3. В процессе эксперимента внутренняя энергия газа уменьшилась на 60 кДж, и он совершил работу 45 кДж. Следовательно, в результате теплообмена газ отдал окружающей среде количество теплоты, равное
1) 15 кДж 2) 45 кДж 3) 60 кДж 4) 105 кДж
А4. В процессе эксперимента газ получил от нагревателя количество теплоты, равное 3 кДж. При этом внутренняя энергия газа уменьшилась на 13 кДж. Следовательно, газ расширился, совершив работу
1) 3 кДж 2) 10 кДж 3) 13 кДж 4) 16 кДж
А5. Идеальный газ получил количество теплоты 100 Дж, и при этом внутренняя энергия газа уменьшилась на 100 Дж. Чему равна работа, совершённая внешними силами над газом?
1) 100 Дж 2) 200 Дж 3) -200 Дж 4) 0
VII. Домашнее задание.
§§78,79.



















