Тема: Серная кислота
Цель: изучить химические и физические свойства серной кислоты; закрепить знания о правилах техники безопасности в кабинете химии; дать представление о практическом значении серной кислоты в народном хозяйстве и жизни человека; развивать учебно-информационные навыки: умение извлекать информацию из устного сообщения, наблюдаемых процессов;
Оборудование: серная кислота, набор реактивов и оборудования для Л/О, раздаточный материал: лист А4, заготовки «цветочков», «листочков».
Тип урока: усвоение новых знаний
Методы урока: объяснение, работа в группах, фронтальный опрос, лабораторный эксперимент.
Ход урока:
1. Организационный момент. Приветствие.
Здравствуйте! Давайте поприветствуем друг друга улыбками.
2. Актуализация опорных знаний
1) Самостоятельная работа учащихся:
Закончите уравнения возможных реакций:
а) SO2 + NaOH (изб.) =
б) SO2 + O2 =
в) SO3 + Н2О =
г) SO2 + Ca(OH)2 =
д) H2S + O2 =
е) SO2 + HCl =
2) Фронтальный опрос
«Сложное вещество, состоящее из одного или нескольких атомов гидрогена и кислотного остатка» (кислота).
Молодцы! Правильно!
3) Ученики думают, заполняют таблицу. Для этого у каждой группы на столах приготовлены листы бумаги с вопросами в виде таблицы.
|
|
| Вопросы | Ответы |
| Какую формулу имеет серная кислота? |
|
| Какой тип химической связи в молекуле серной кислоты? |
|
| Чему равна валентность кислотного остатка? |
|
| Степень окисления серы в молекуле серной кислоты? |
|
По истечению времени проверяем. Ответы учащихся: 1- H2SO4 2 - Ковалентная полярная. 3 –SO4 (II). 4- +6.
3.Изучение нового материала
Серная кислота – один из основных продуктов химической промышленности. Структурная формула серной кислоты следующая:
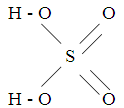
А теперь работа по учебнику: откройте §21, прочитайте, и напишите в рабочую тетрадь физические свойства серной кислоты.
Физические свойства. Серная кислота - бесцветная маслянистая тяжелая жидкость. Обладает сильным гигроскопическим (водо-отнимающим) свойством. Концентрированная серная кислота хорошо растворяется в воде и выделяется теплота.
Получение. Серную кислоту в промышленности получают из серы или сульфидов металлов контактным способом. Сырье:
1 сера-S
2 железный колчедан- FeS2 --------- SO2 --------- SO3--------- H2SO4
3 сероводород - H2S
Сейчас мы проведем опыты и докажем химические свойства серной кислоты экспериментально, но прежде давайте вспомним правила техники безопасности при работе с серной кислотой! Потому что серная кислота очень опасное вещество. При работе с ней следует особенно тщательно соблюдать правила техники безопасности. Какие? Ответы учащихся:
1.Если случайно кислота и щелочь попадает на руки или на одежду, то немедленно смойте ее большим количеством воды.
2.При разбавление кислот водой всегда надо помнить следующее правило: кислоты следует медленно тонкой струей при перемешивании наливать в воду, а не наоборот.
Химические свойства
1.Водный раствор изменяет окраску индикаторов.
(Учащиеся в 3 пробирки с 2 мл серной кислоты добавили по одной капли каждого индикатора. Полученные результаты записали в тетрадь).
2. С металлами (до водорода), например, с Zn:
Zn + H2SO4(p) = ZnSO4 + H2
(Учащиеся в пробирку с 1 гранулой металлического цинка добавили 2 мл раствора серной кислоты. Полученный результат записали в тетрадь).
3. С оксидами металлов, например, с CuO:
CuO + H2SO4(p) = CuSO4 + H2O
(Учащиеся в пробирку к 1г. оксида меди (II) добавили 2 мл раствора серной кислоты, нагрели. Полученный результат записали в тетрадь).
4. С основаниями, например, с NaOH:
2NaOH + H2SO4 = Na2SO4 + 2H2O
(Учащиеся в пробирку к 1 мл гидроксида натрия добавили 1 мл раствора серной кислоты. Полученный результат записали в тетрадь).
5. С солями, например, с BaCl2:
BaCl2 + H2SO4 = BaSO4 + 2HCl (написать полное и сокращенное ионные уравнения)
Реактивом на сульфат – ионы являются ионы бария. Выпадает осадок белого цвета.
(Учащиеся в пробирку к 1 мл хлорида бария добавили 1 мл раствора серной кислоты. Полученный результат записали в тетрадь).
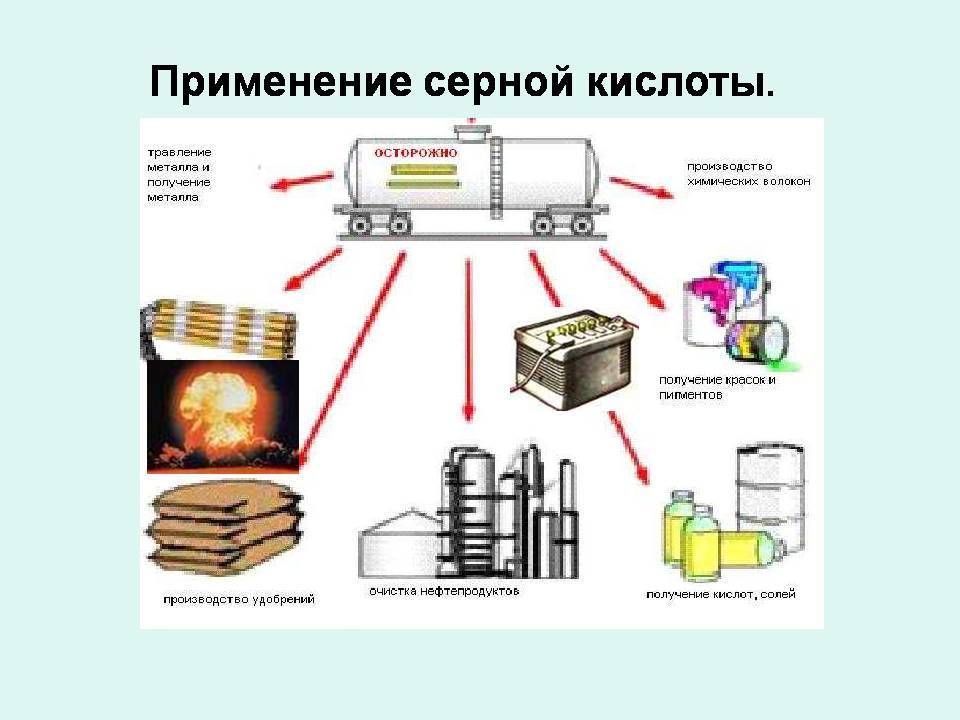
Применение и значение кислоты.
Вспоминая область применения знакомых вам кислот, попробуйте ответить, где может применяться серная кислота. Ответы учащихся.
Учитель. Всё, что вы сказали верно, но найдите стр. 76, прочитайте о применении серной кислоты. Что нового нашли?
Учащиеся делают схему в тетради.
4. Домашнее задание.
На уроке вы работали очень плодотворно, а теперь запишите домашнее задание.
Изучить §21, выполнить задания № 2, 5 на странице 78.
Оценка знаний учащихся.
5.Подведение итогов
Вот и пролетело время нашего урока. У каждого из вас есть свои впечатления от этого урока.
6. Рефлексия
Перед вами стебли и листья, но на них нет цветов. У вас на столах у каждого имеются «красный цветок» и «желтый». Если вам на сегодняшнем уроке было интересно, все понятно и комфортно – наклейте на «стебель» «красный цветок», если же нет, и осталось много вопросов – «желтый».






























