| Галогены. Кислород и сера. 9 кл.
Вариант №1
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид калия, оксид железа (II), нитрат бария, медь? Напишите уравнения осуществимых реакций в молекулярном и ионном виде. Осуществите превращения: S → SO2 → SO3 → H2SO4 → SO2 3. В какую сторону сместится равновесие реакции: 2SO2 + O2 ⇄ 2SO3 + Q при повышении температуры? Дайте обоснованный ответ.
Найти массу соли, которая получится при взаимодействии 6 г гидроксида натрия с избытком серной кислоты?
| Галогены. Кислород и сера. 9 кл.
Вариант №2
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: ртуть, гидроксид железа (III), оксид магния, цинк? Напишите уравнения осуществимых реакций в молекулярном и в ионном виде. 2. Осуществите превращения: H2S ← S → FeS → SO2 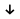 Na2S 3. В какую сторону сместится равновесие реакции: N2 + 3H2 ⇄ 2NH3 + Q при повышении давления? Дайте обоснованный ответ. 4. Найти массу соли, которая образуется при взаимодействии 121,5 г оксида цинка и серной кислоты?
|
| Галогены. Кислород и сера. 9 кл
Вариант №3
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид алюминия, золото, оксид меди (II), магний? Напишите уравнения осуществимых реакций в молекулярном и ионном виде.
Осуществите превращения: S → ZnS → SO2 → SO3 → H2SO4
В какую сторону сместится равновесие реакции: SO2 + H2O ⇄ H2SO3 + Q при повышении температуры? Дайте обоснованный ответ.
Найти массу осадка, который выделится в результате взаимодействия 4,9 г серной кислоты и хлорида бария? | Галогены. Кислород и сера. 9 кл
Вариант №4
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: железо, оксид серы (IV), оксид железа (III), хлорид калия? Напишите уравнения осуществимых реакций в молекулярном и ионном виде.
2. Осуществите превращения: S → SO2 → SO3 → H2SO4 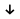 ZnSO3 3. В какую сторону сместится равновесие реакции: 2SO2 + O2 ⇄ 2SO3 + Q при понижении давления? Дайте обоснованный ответ.
4. Найти массу соли, которая получится при взаимодействии гидроксида натрия и 9,8 г серной кислоты?
|
| Галогены. Кислород и сера. 9 кл
Вариант №5
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: серебро, гидроксид железа (III), хлорид бария, оксид цинка? Напишите уравнения осуществимых реакций в молекулярном и в ионном виде. Осуществите превращения: H2S ← S → FeS → SO2 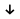 К2S В какую сторону сместится равновесие реакции: N2 + 3H2 ⇄ 2NH3 + Q при понижении температуры? Дайте обоснованный ответ.
Найти массу соли, которая образуется при взаимодействии оксида цинка и 98 г серной кислоты?
| Галогены. Кислород и сера. 9 кл
Вариант №6
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид алюминия, золото, оксид меди (II), магний? Напишите уравнения осуществимых реакций в молекулярном и ионном виде.
Осуществите превращения: S → ZnS → SO2 → SO3 → H2SO4
В какую сторону сместится равновесие реакции: SO2 + H2O ⇄ H2SO3 + Q при увеличении концентрации оксида серы (IV)? Дайте обоснованный ответ.
Найти массу осадка, который выделится в результате взаимодействия серной кислоты и 15,6 г хлорида бария?
|
| Галогены. Кислород и сера. 9 кл.
Вариант №7
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид натрия, оксид железа (II), нитрат бария, золото? Напишите уравнения осуществимых реакций в молекулярном и ионном виде. 2. Допишите уравнение реакции и уравняйте методом электронного баланса. K + H2SO4(pазб.) → … + ...
3. В какую сторону сместится равновесие реакции: 2SO2 + O2 ⇄ 2SO3 + Q при понижении температуры? Дайте обоснованный ответ.
4. Найти массу соли, которая получится при взаимодействии 16 г гидроксида натрия с раствором серной кислоты? | Галогены. Кислород и сера. 9 кл.
Вариант №8
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: ртуть, гидроксид хрома (III), бромид бария, цинк? Напишите уравнения осуществимых реакций в молекулярном и в ионном виде. Допишите уравнение реакции и уравняйте методом электронного баланса Hg + H2SO4(конц.) → … + SO2↑ + ….
В какую сторону сместится равновесие реакции: N2 + 3H2 ⇄ 2NH3 + Q при понижении давления? Дайте обоснованный ответ.
4. Найти массу соли, которая образуется при взаимодействии 120 г оксида магния и серной кислоты?
|
| Галогены. Кислород и сера. 9 кл
Вариант №9
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид меди, золото, оксид свинца (II), магний? Напишите уравнения осуществимых реакций в молекулярном и ионном виде. Осуществите превращения: S → SO2 → SO3 → H2SO4→ ZnSO4
В какую сторону сместится равновесие реакции: SO2 + H2O ⇄ H2SO3 + Q при понижении температуры? Дайте обоснованный ответ.
Найти массу осадка, который выделится в результате взаимодействия 73,5 г серной кислоты и хлорида бария?
| Галогены. Кислород и сера. 9 кл
Вариант №10
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: железо, гидроксид бария, хлорид калия, платина? Напишите уравнения осуществимых реакций в молекулярном и ионном виде. 2. Осуществите превращения: S → SO2 → SO3 → К2SO4 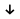 H2SO4 3. В какую сторону сместится равновесие реакции: 2SO2 + O2 ⇄ 2SO3 + Q при повышении давления? Дайте обоснованный ответ.
4. Найти массу соли, которая получится при взаимодействии гидроксида натрия и 147 г серной кислоты?
|
| Галогены. Кислород и сера. 9 кл.
Вариант №11
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид калия, оксид железа (II), хлорид бария, медь? Напишите уравнения осуществимых реакций в молекулярном и ионном виде. 2. Допишите уравнение реакции и уравняйте методом электронного баланса. Zn + H2SO4(конц) → … + H2S↑ + ...
3. В какую сторону сместится равновесие реакции: 2SO2 + O2 ⇄ 2SO3 + Q при повышении давления? Дайте обоснованный ответ. 4. Найти массу осадка, который получится при взаимодействии 17,1 г гидроксида бария с раствором серной кислоты?
| Галогены. Кислород и сера. 9 кл.
Вариант №12
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: ртуть, гидроксид железа (II), оксид магния, цинк? Напишите уравнения осуществимых реакций в молекулярном и в ионном виде. 2. Допишите уравнение реакции и уравняйте методом электронного баланса. Ag + H2SO4(конц.) → … + SO2↑ + … 3. В какую сторону сместится равновесие реакции: N2 + 3H2 ⇄ 2NH3 + Q при повышении температуры? Дайте обоснованный ответ. 4. Найти массу соли, которая образуется при взаимодействии 112 г оксида кальция и серной кислоты?
|
| Галогены. Кислород и сера. 9 кл.
Вариант № 13
Запишите уравнения реакции в молекулярном и ионном виде: а) HCl + Pb(NO3)2 → PbCl2 + HNO3; б) CaCl2 + Na2CO3 → NaCl + CaCO3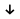 ; ; в) HCl + Mg → MgCl2 + H2.
Осуществите цепочку превращений: KBr → KCl → Cl2 → KCl → KNO3 3. Запишите уравнение реакции и уравняйте методом электронного баланса KClO3 → KCl + O2 4. Какой объём хлора (н.у.) можно получить, если взять оксид марганца (IV) и 300 г раствора соляной кислоты с массовой долей хлороводорода 15%?
| Галогены. Кислород и сера. 9 кл.
Вариант № 14
1. Запишите уравнения реакции в молекулярном и ионном виде: а) MgCl2 + KOH → Mg(OH)2 ↓+ KCl; б) NaBr + Cl2 → NaCl + Br2; в) HCl + Fe2O3 → FeCl3 + H2O.
2.Осуществите цепочку превращений: Cl2 → FeCl2 → Fe(OH)2 → FeO 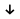 FeCl3 3. Запишите уравнение реакции и уравняйте методом электронного баланса Cl2 + NaOH 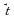 NaCl + NaClO3 + H2O NaCl + NaClO3 + H2O
4. К раствору массой 60 г с массовой долей хлороводорода 15% прилили раствор нитрата серебра. Вычислите массу выпавшего осадка.
|
| Галогены. Кислород и сера. 9 кл.
Вариант № 15
1. Запишите уравнения реакции в молекулярном и ионном виде а) HCl + Zn → ZnCl2 + H2; б) NaCl + AgNO3 → NaNO3 + AgCl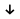 ; ; в) HCl + Al(OH)3 → AlCl3 + H2O.
2. Осуществите цепочку превращений:
BaO → BaCl2 → Ba(NO3)2 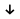 Cl2 → HCl 3. Запишите уравнение реакции и уравняйте методом электронного баланса Cl2 + Fe 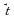 FeCl3 FeCl3
4. Весь хлороводород, полученный действием серной кислоты на хлорид калия массой 14,9 г, поглотили водой массой 200 г. Определите массовую долю хлороводорода в растворе. | Галогены. Кислород и сера. 9 кл
Вариант №16
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид алюминия, золото, оксид меди (II), магний? Напишите уравнения осуществимых реакций в молекулярном и ионном виде.
2. Осуществите превращения:
Cl2 → FeCl2 → Fe(OH)2 → FeO → FeSO4
3. Допишите уравнение реакции и уравняйте методом электронного баланса
Pb + H2SO4(конц) → … + H2S↑ + …
4. Весь сернистый газ, полученный действием серной кислоты на сульфит калия массой 11,9 г, поглотили водой массой 100 г. Определите массовую долю газа в растворе. |
| Галогены. Кислород и сера. 9 кл.
Вариант №17
С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: гидроксид калия, оксид железа (II), нитрат бария, медь? Напишите уравнения осуществимых реакций в молекулярном и ионном виде. 2. Осуществите цепочку превращений: KCl → Cl2 → FeCl2 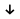 FeCl3 → Fe(OH)2 → FeO 3. Запишите уравнение реакции и уравняйте методом электронного баланса
HCl + MnO2 → MnCl2 + Cl2 + H2O
4. Найти массу соли, которая получится при взаимодействии избытка гидроксида натрия и 24,5 г серной кислоты?
| Галогены. Кислород и сера. 9 кл
Вариант №18
1. С какими из нижеперечисленных веществ будет реагировать раствор серной кислоты: железо, гидроксид бария, хлорид калия, платина? Напишите уравнения осуществимых реакций в молекулярном и ионном виде.
2. Осуществите превращения:
Cl2 → FeCl2 → Fe(OH)2 → FeO →FeCl2 3. Запишите уравнение реакции и уравняйте методом электронного баланса HBr + H2SO4(конц.) → Br2 + SO2 + H2O
4. Какой объём газа выделится при взаимодействии 36 г магния с раствором серной кислоты? |
| Галогены. Кислород и сера. 9 кл.
Вариант № 19
1. Запишите уравнения реакции в молекулярном и ионном виде: а) HCl + CaCO3 → CaCl2 + H2O +CO2↑ б) PbCl2 + Na2SO4 → NaCl + PbSO4 ; ; в) HCl + Mg → MgCl2 + H2.
2. Осуществите цепочку превращений: S → SO2 → SO3 ↓ H2SO3→ SO2 3. В какую сторону сместится равновесие реакции: Cl2 + H2 ⇄ HCl + Q при понижении температуры? Дайте обоснованный ответ.
4. Найти массу осадка, который получится при взаимодействии 17 г нитрата серебра с раствором соляной кислоты
| Галогены. Кислород и сера. 9 кл.
Вариант № 20
1. Запишите уравнения реакции в молекулярном и ионном виде: а) HCl + PbСO3 → PbCl2 + H2О+ СO2↑; б) H2SO4 + ВаCl2 → HCl +ВаSO4 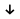 ; ; в) NaCl + AgNO3 → NaNO3 + AgCl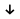 ; ;
2. Осуществите цепочку превращений:
KCl → Cl2 → FeCl2 → FeCl3 →Fe(OH)3
3. В какую сторону сместится равновесие реакции: I2 + H2 ⇄ 2HI ‒ Q при понижении температуры? Дайте обоснованный ответ.
4. Какой объём газа выделится при взаимодействии 32 г меди с концентрированной серной кислотой?
|







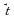 NaCl + NaClO3 + H2O
NaCl + NaClO3 + H2O









