


Ежегодно 1/ 4
всего
произведенного Fe теряется из-за коррозии

Коррозия – рыжая крыса,
Грызет металлический лом.
В. Шефнер.

Коррозией - называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды
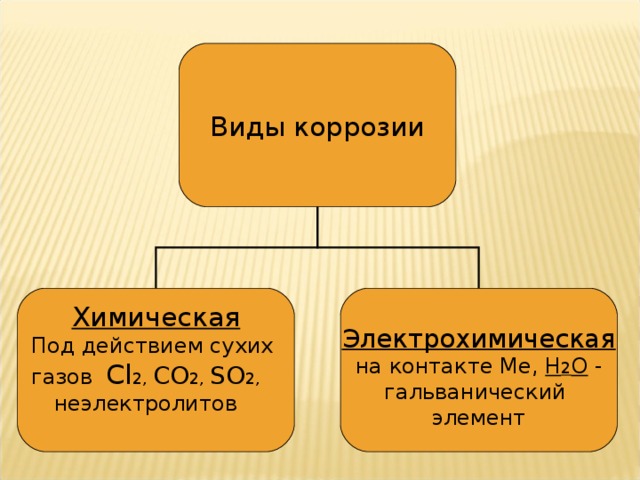
Виды коррозии
Химическая
Под действием сухих
газов С l 2, CO 2, SO 2 ,
неэлектролитов
Электрохимическая
на контакте Ме, H 2 O -
гальванический
элемент
6

Химически чистое железо не ржавеет, т.к. не содержит примесей
Индия, Новый Дели, Железный столб
1 в н.э
6

- Компоненты окружающей среды окисляют непосредственно металл.
- Протекающие при химической коррозии окислительно - восстановительные реакции осуществляются путем непосредственного перехода электронов с атомов металлов на частицы окислителя, входящего в состав среды.

Примеры химической коррозии:
Fe + O 2 Fe 3 O 4
Fe + Cl 2 FeCl 3
Cu CuO (медленно) CuSO 4
красн. черный зеленый

1813 г.
Гемфри Деви
открыл
электрохимическую
коррозию металлов
6

- Коррозия протекающая в токопроводящей среде.
- Помимо химической реакции, в системе возникает электрический ток.
- Процесс электрохимической коррозии происходит при контакте двух металлов
- Разрушается металл с более сильными восстановительными свойствами (выполняет роль анода)

Электрохимическая коррозия железа
Fe + O 2 + H 2 O Fe(OH) 3
6

Fe 0 - 2 ē Fe 2+
разрушение
на меди:
2Н + + 2 ē H 2
Zn 0 - 2 ē Zn 2+
разрушение
на железе:
2Н + + 2 ē H 2
6

- Защитное покрытие ( лак, масло, краска, покрытие некорродирующим металлом – Cr, Sn, Zn)
- Нержавеющие стали
- Ингибиторы коррозии
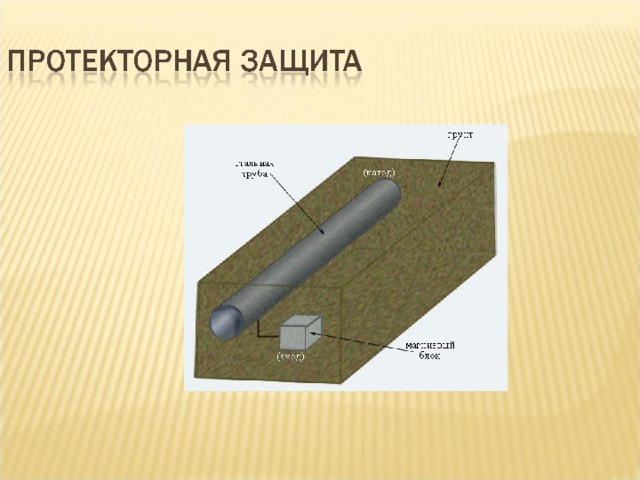
- Протекторная защита
6

6

Нержавеющая сталь
6
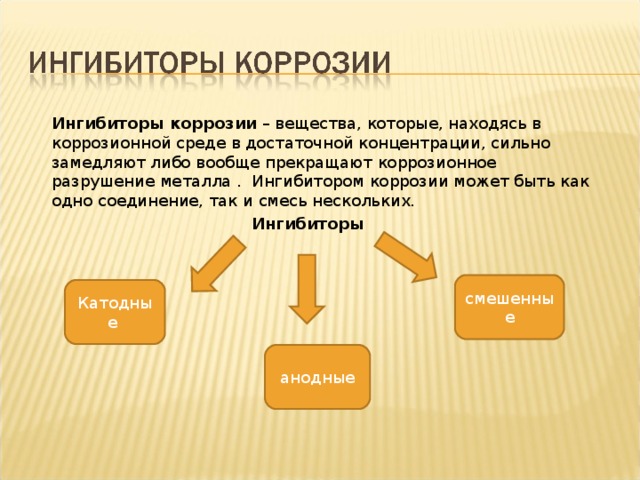
Ингибиторы коррозии – вещества, которые, находясь в коррозионной среде в достаточной концентрации, сильно замедляют либо вообще прекращают коррозионное разрушение металла . Ингибитором коррозии может быть как одно соединение, так и смесь нескольких.
Ингибиторы
смешенные
Катодные
анодные
6

- Что такое коррозия?
- Какие виды коррозии существуют? Дайте определения.
- Почему не корродируют чистые металлы?
- Какой металл будет разрушаться при контакте во влажной среде: меди и цинка, алюминия и магния? Почему?
- Назовите основные способы защиты от коррозии.
6

Спасибо за работу!
Молодцы!
6














































