Просмотр содержимого документа
«"Ковалентная связь", опорный конспект, химия, 8 класс»
Опорный конспект по теме
«Ковалентная связь» (8 класс)
Основные понятия: -электроотрицательность (ЭО)
- химическая связь
Электроотрицательность (Лайнус Полинг , 1932г) –способность атомов притягивать к себе электроны.
Относительная электроотрицательность – показывает во сколько раз электроотрица-тельность атома химического элемента отличается от электроотрицательности атома лития, которую принято считать за 1.
Изменение ЭО в периодах и группах ПСХЭ

 ЭО возрастает F( фтор)-
ЭО возрастает F( фтор)-
самый ЭО-й элемент
ЭО убывает
Fr (франций) – наименее ЭО-й элемент
ХИМИЧЕСКАЯ СВЯЗЬ (ХС) – взаимодействие атомов, приводящее к образованию молекул и кристаллов. Молекулы и кристаллы являются более устойчивыми структурами, так как входящие в них атомы приобретают завершенный внешний электронный слой.
Причина образования ХС – незавершенный внешний энергетический уровень у всех элементов, кроме инертных газов-VIII А группа.
Приобретая завершённый внешний энергетический уровень ,атом становится энергетически устойчивым.
Чтобы узнать, сколько электронов не хватает атому до завершения внешнего энергетического уровня, нужно из 8 вычесть номер группы, в которой находится химический элемент.
Типы химической связи




| ковалентная | ионная | металлическая |
| r | ковалентная | ионная | металлическая |
| полярная | неполярная |
| за счёт чего образуется | общих электронных пар | электростатического притяжения ионов | свободных электронов |
| Между какими частицами возникает | ЭО атомов одинакова (атомы одного химического элемента)- O2, H2, Cl2 , N2 и т.д. | ЭО атомов незначительно различаются (атомы неметалла и неметалла) – HCl, H2O, H2S NH3 | ЭО атомов резко отличается ( между атомами металлов и неметаллов) | атомами и ионами металла |
| Схема образования | Н2
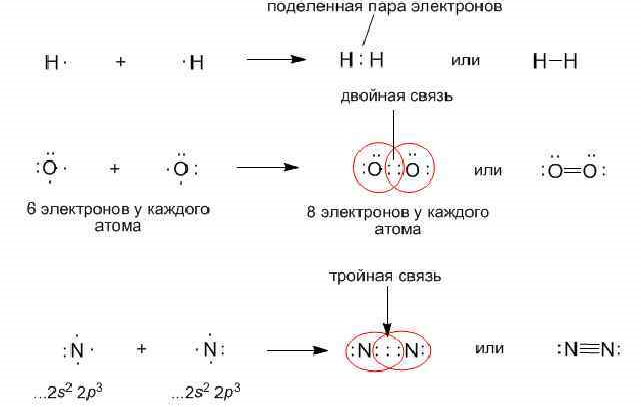
Н∙ + ∙Н → Н:Н Общая электронная пара принадлежит одинаково обоим атомам – молекула неполярна. | HCl
Н∙ + ∙Cl: → Н :Cl: Общая электронная пара смещена к атому хлора – молекула полярна. | NaCl
Na∙ + ∙Cl: →Na+[:Cl:]- Электрон атома металла переходит к атому неметалла. При этом образуются ионы.
| Na
|
Если до завершения внешнего энергетического уровня атому не хватает одного электрона, то образуется одна общая электронная пара (H2, Cl2), связь одинарная; если до завершения внешнего энергетического уровня не хватает двух электронов, образуются две пары электронов (O2) , связь двойная; если до завершения внешнего энергетического уровня не хватает трёх электронов, образуются три пары электронов (N2) ), связь тройная.








 ЭО возрастает F( фтор)-
ЭО возрастает F( фтор)- 














