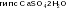Мұғалімнің аты –жөні : Битабарова Хадиша Исабековна .
Жұмыс орны «№ 19 М.Мақатаев атындағы жалпы орта мектебі .
коммуналдық мемлекеттік мекемесі».
Қызметі: Мұғалімі
Оқытатын пәні: Химия
Мекен –жайы: Онтүстік Қазақстан. облысы Мақтарал. ауданы, . Ж.Ералиев. ауыл , 8 775 240 62 67 ұялы телефон
[email protected] . E-mail
Шығармашылық тақырыбы: «Жаңа педагогикалық технология негізінде, оқушылардың өзіндік ізденісін, ойлау және шығармашылық қабілетін дамыту, ақпараттық технологиялардың мүмкіндігін қолдана отырып оқушылардың химия пәніне деген қызығушылықтарын арттыру. »
Сабақтың тақырыбы: Күкіртті қосылыстары. Күкіртсутек.
Сабақтың мақсаты: күкірттің периодтық кестедегі орнын атом құрылысы тұрғысынан қарастырып, оның аллотропиясы, физикалық және химиялық қасиеттері мен қолданылуы жайлы оқушылар білімін жүйелеу. Күкірт қосылыстарының физикалық және химиялық қасиеттерімен және оны алудың негізіне жататын химиялық реакциялармен таныстыру.
Күтінетін нәтиже: күкірттің периодтық кестедегі орнын атом құрылысы тұрғысынан қарастырып, оның аллотропиясы, физикалық және химиялық қасиеттері мен қолданылуы жайлы оқушылар білімін жүйелейді. Күкірт қосылыстарының физикалық және химиялық қасиеттерімен және оны алудың негізіне жататын химиялық реакциялармен танысады.
Сабақтың түрі : демонстрациялық сабақ.
Сабақтың әдісі : « Оқу мен жазу арқылы сын тұрғысынан ойлауды дамыту» педагогикалық технологиясының элементтері.
Көрнекілігі: Д.И. Менделеевтің периодтық жүйесі , кестелер, әр түрлі тестілер , слайдтар, тірек-сызбалар.

Сабақтың барысы:
1 - кезең. Ұйымдастыру « Сәлем – сөздің анасы»
Оқушылармен амандасу , сынып оқушыларын түгендеу . Оқушылар назарын сабаққа аудару.
2- кезең. «Үй тапсырмасын тексеру» «Қайталау - оқу анасы»
1.Танымдық сұрақтар:
Күкірттің периодтық жүйедегі орны қандай?
Күкірт қандай оксидтерден тұрады?
Күкірттің оксидтері қандай оксидтердің тобына жатады?
Әрбір оксиді сумен әрекеттескенде қандай қосылыстар түзеді?
Күкірт оксидтерінің тотығу дәрежесі қандай?
Олардың физикалық қасиеттері?
Оксидтерінің қолданылуы?
2.Кім шапшаң? (Сәйкестендіру тесті)
S+O2→ а) H2SO4
SO3 +H2O→ ә)2SO3
2SO2 +O2→ б)Н 2S
SO2 +H2O→ в)H2SO4
S +H2→ г)SO2
3 - кезең. «Жаңа сабақты түсіндіру «Білгенге – маржан»
Күкірттің қосылыстары. Күкіртсутек сипаттама
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Тұздары


Периодттық жүйедегі орны
Күкірт III периодтың, VI топтың негізгі топшасының элементі, реттік нөмірі 16. Олай болса ядро заряды +16, протон саны 16, нейтроны да 16; электрондарының жалпы саны 16. Электрондық құрылысы. Осы электрондар үш электрондық қабаттарда бөлініп орналасады, күкірттің электрондық формуласы: 1s22s22p63s23s4
Күкірт II, IV, VI - валентті бола алады, ал тотығу дәрежелері -2,0, +4, +6 болып келеді.

Табиғатта таралуы. Күкірттің табиғи қосылыстары
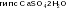
Балқаш, Шығыс Қазакстан облысында сульфидтер (ZnS, PbS, FeS2, т.б.) күйінде болса, сульфаттары (CaSО4 · 2Н2О- ғаныш (гипс), Na2SО4·10Н2О - мирабилит, FeS04 · 7Н2О - темір купоросы) т. б. болады. Күкірт қосылыстары мұнайда және тас көмірде де кездеседі. Бос күйіндегі күкіртті тау жыныстарынан балқыту арқылы алады.
Вулкан атқылағанда газбен ілесе ұшқан күкірт сыртқа шығып кристалл түрінде қатаяды. Ондай күкіртті вулканмен байланысты арасан көздерден (фумаролдардан), тау жыныстарының жарықтарынан, қуыстарынан кездестіруге болады.
Сульфид минералдардың тотығуынан пайда болатын күкірт кендері көбінесе сульфид кендерінің үстіңгі қабатында болады. Бұл жағдайда пайда болатын күкірттің реакциясын мынадай түрде көрсетейік.
RS + Fe2(SО4) 3 = 2FeSО4 + RSО4 + S.
Физикалық қасиеттері Күкірт - сары түсті, суда нашар еритін, су жұктырмайтын, жылу мен тоқ өткізбейтін, морт келетін қатты зат. Балку температурасы 119°С. Күкірт атомының сыртқы валенттілік кабатында екі дара электроны болғандыктан, олар өзара байланыса алады.
Табиғатта кездесуі

Физикалық қасиеттері
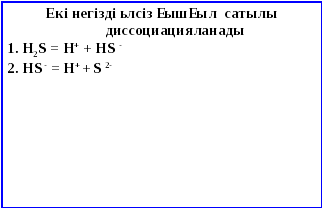
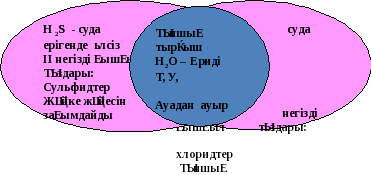
Күкіртті сутектің өзіне тән жағымсыз иісті(шіріген жұмыртка иісіндей), түссіз, улы газ.Нәруыз шіріген кезде әрдайым күкіртсутек түзіледі, ұнамсыз иіс осыдан пайда болады. Күкіртті сутек суда нашар ериді. Нәтижесінде екі негізді, әлсіз күкіртті сутек қышқылы (лакмус пен метилоранжды қызартатын) түзіледі. Оның тұздары сульфидтер деп аталады.
Күкіртті сутек қышқылы сатылы диссоциацияға түседі.Сілтілік және сілтілік жер металдары суда жақсы ериді. Ауыр металдардың сульфидтері суда аз ериді немесе ерімейді.
Күкірттің сутекті қосылысы күкіртті сутек, ол көбінесе вулкан газдарында, табиғи шипалы сулардың құрамында кездеседі (Барлық Арасан) және органикалық заттар шірігенде бөлінеді
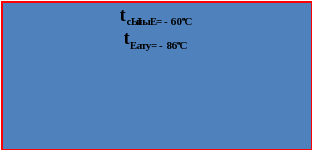
Химиялық қасиеттері.
Күкіртті сутек қышқылы қышқылдарға тән барлық қасиеттерді көрсетеді:
1) активтік қатарында сутекке дейін тұрған металдармен әрекеттесіп сутегі бөледі:
H2S +Mg = MgS + Н2↑
2) негіздік оксидтермен тұз және су түзеді:
H2S + ҒеО = FeS↓ + Н2О
3) негіздермен әрекеттесіп тұз және су түзеді:
H2S + 2NaOH = Na2S + 2Н2О
4) тұзбен әрекеттескенде суда ерімейтін жаңа тұз және жаңа қышқыл түзіледі:
H2S + Pb(N03)2 = PbSl + 2HNО3
Бұл реакцияның жүру себебі PbS ерімейтін зат болғандықтан, көбінесе әлсіз қышқыл (H2S) күшті қышқылды (HN03) оның тұзынан ығыстыра алмайды.
2Н+ + S2- + Pb2+ + 2N03 = PbS↓ + 2Н+ + 2NО3
Бұл реакцияның толық иондық теңдеуі.
Күкіртті сутек пен оның тұздарын анықтау үшін суда да, қышқылда да ерімейтін қара түсті PbS түзілу реакциясы қолданылады: Pb2+ + S2 - PbS↓ кыскартылған иондык теңдеуі. Басқа сульфидтерінің де түстері бар. Мысалы, ZnS - ақ, MnS - қызғылт.
Тотығу-тотықсыздану реакцияларында күкіртті сутек қышқылы және оның тұздары тек тотықсыздандырғыш болады. Оның себебі кұрамындағы күкірт ең төмен тотығу дәрежесінде болады.
Қолданылуы. Күкірт қышқылын -химиялық өндірістің көбінде қолданылатын негізгі өнім.
Басқа қышқылдармен салыстырғанда , химия өнеркәсібінде кең көлемде қолданылуына сәйкес күкірт қышқылы бірінші орында тұр. Металлургияда түсті металдар алу үшін мұнай өндеуде түрлі өнімдерді тазартуға , қопарылғыш заттар , жасанды талшықтар , бояулар ,дәрі –дәрмектер парфюмерия өндіруде, тері илеуде және пластмасса синтездеуде алатын орны ерекше.
Күкірт қышқылының тұздары. Күкірт қышқылының тұздары екі типті болады:орта және қышқыл тұздар. Орта тұздар –сульфаттар , қышқыл тұздар- гидросульфаттар. Көпшілік сульфаттар суда жақсы ериді ,ал ерімейтіндерге және аз еритіндерге барий сульфаты және стронций сульфаты жатады.

4 - кезең. Жаңа сабақты бекіту «Сен – оқысаң , мен – тоқығам»
І-тапсырма. Сұрақ-жауап.
1. Күкіртсутектің : а) физикалық;
ә) химиялық қасиеттерін сипаттап беріңдер.
2. Күкірт, темір және тұз қышқылы берелген. Күкіртсутекті қалай алуға болады?
3. Күкіртсутектің табиғатта таралуын айтып беріңдер.
4. Батыс Қазақстанда мұнай өндірілетін жерлерде мұнайға серіктес газдың құрамында күкіртсутек көп кездеседі. Табиғатта күкіртсутек қалай түзіледі деп ойлайсыңдар және оның себебін түсіндіріңдер.
5. Күкіртсутектің судағы ерітіндісі біраз тұрғаннан кейін лайланып кетеді. Себебін түсіндіріп, жүретін реакцияның теңдеуін жазыңдар.
2)Дұрыс жауабын тап:
1.Сұйытылған күкірт қышқылымен әрекеттесіп, сутегін ыдырататын металдар?
А)Cu ,Fe Ә)Au ,Hg
Б)Mg, Fe В)Mg, Ag
2.Сульфат иондарға сапалық реакция қай металдың тұздары көрсетеді?
А)BaSO4 Ә)AgCl
Б)NaNO3 В)CaCl2
5 - кезең. Топтастыру кластер
6 - кезең. «Ойлан, тап!» Есеп шығару.
1. 246 г күкіртті қышқыл құрамындағы күкірт атомдарының саны
Шеуші: М(Н2SO4) = 98 г/моль
М(S) = 32 г/моль
NА = 6,02 · 1023
246 г Н2SO3 ----- х г S
82 г Н2SO3 ---- 32 г S
х----- 96 г S
6,02 · 1023 ---- 32 г S
2. 320г мысты концентрлі күкірт қышқылында еріткенде түзілген мыс (ІІ) сульфатының моль саны:
Шешуі: Cu + 2Н2SO4 → CuSO4 + SO2+ 2Н2О
М(Сu) = 64 г/моль
v(CuSO4) = 1 моль
х моль CuSO4 ----- 320 г Cu
1 моль CuSO4------ 64 г Cu
3. 20 г мыс (ІІ) оксиді және 21 г күкірт қышқылын қыздырғанда түзілетін тұз массасы (г)
Шешуі: СuО + Н2SО4 → СuSО4 + Н2О
М(СuО) = 80 г/моль
М(Н2SО4) = 98 г/моль
М(СuSО4) = 160 г/моль
21 г Н2SО4 ----х г СuSО4
98 г Н2SО4 --- 160 г СuSО4
7 - кезең. Өзгерістерді жүзеге асыру.
І-нұсқа.
Мына өзгерістерді жүзеге асыратын реакция теңдеулерін жаз:
FeS2→SО2→H2SO3→H2SO4→Na2SO3→SO2 →SO3 → Na2SO4
Шешуі:
FeS2 + 11О2→ 8SO2 + 2Fe2O3
SO2 + H2O H2SO3
H2SO3 + СI + H2O H2SO4 + 2HCI
H2SO4 + 2Na Na2SO3 + 2H2↑
Na2SO3 + H2SO4Na2SO4+ SО2↑ + H2O
2SO2 + O2 2SO3
SO3 + Na2O Na2SO4
ІІ-нұсқа.
1. Мына айналуларды іске асыруға болатын реакция теңдеулерін жазыңдар.
S → ҒеS→Н2S→SО2→SO3→H2SО4
Шешуі:
Ғе + S →ҒеS
FeS + H2SO4→H2S↓ + FeSO4
H2S +3H2SO4→ 4SО2 + 4H2O
2SO2 + O2→2SO3
SO3 + H2O →H2SO4
ІІІ-нұсқа.
1. Мына айналуларды іске асыруға болатын реакция теңдеулерін жазыңдар.
H2S → S →SО2 → SО3 → H2SO4 → CuSO4 → BaSO4
Шешуі:
2H2S + О2 → 2S + 2 H2O
S + O2 → SO2
2SO2 + O2 → 2SO3
SO3 + H2O →H2SO4
Cu + H2SO4 → CuSO4 + SО2↑ + H2O
CuSO4 + BaCI2 → BaSO4 + CuCI2
- кезең. Венн диаграммасы
9 - кезең. «Бағалау»
10- кезең. Үйге тапсырма:
§12 оқу. №9. Күкірт қышқылының массалық үлесін есептеу.
9