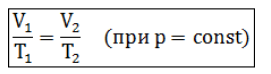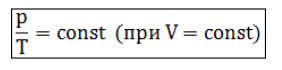Лабораторная работа № 5
Тема: Исследование изопроцессов в газах.
Цель работы: на опыте проверить изотермический, изохорический и изобарного процессов в газах.
Оборудование: пластиковый сосуд, Медицинский манометр, шприц, зажимы, тройник, трубка ПВХ, термометр, барометр, стакан.
Теория: Газовые законы.
Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа. Всякое изменение состояния газа называется термодинамическим процессом. Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами. Изопроцессы являются идеализированной моделью реального процесса в газе.
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре. Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. 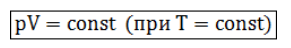
Формулу закона можно записать иначе где - параметры газа в разные моменты времени
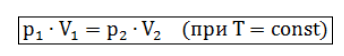
Изобарный процесс (p =const)
И зобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
зобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется. Формулу закона можно записать иначе где - параметры газа в разные моменты времени.
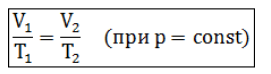
Изохорный процесс (V = const)
Изохорным процессом называются изменения состояния газа, протекающие при постоянном объеме. Изохорный процесс в идеальном газе подчиняется закону Шарля:
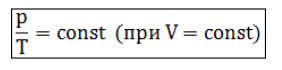
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется. Формулу закона можно записать иначе где - параметры газа в разные моменты времени
Схема установки
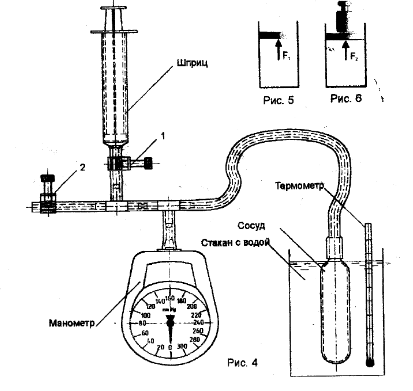
Указание к работе:
1.Изучение изотермического процесса
Открыть зажимы 1,2 и вывести поршень шприца в положение полного объема(10 мл). В этом случае воздух в сосуде сообщается с атмосферой, его температура и давление равны атмосферному.
Зафиксировать по барометру анероиду в кабинете атмосферное давление, а по показаниям термометра температуру воздуха.
Закрыть зажим 2 и, постепенно вводя поршень, зафиксировать показания приборов, занося их в таблицу
После определения объема воздуха и его давления в каждом опыте рассчитайте их произведения.
| № опыта | Объем воздуха в системе, V,мл | Давление в сосуде Р=ратм+рманом | Произведение давления воздуха на его объем, рV |
| 1 | 50+10 |
|
|
| 2 | 50+7 |
|
|
| 3 | 50+5 |
|
|
| 4 | 50+3 |
|
|
Сравните результаты расчетов и сделайте вывод о выполнении закона Бойля-Мариотта
2.Изучение изобарного процесса
Открыть зажимы 1,2 установить поршень на делении 2мл, и закрыть зажим 2. Плавным перемещением поршня установить на манометре давление , например 30 мм.рт.ст.
Измерьте температуру окружающей среды и объем воздуха в замкнутой системе, заполните таблицу:
| №опыта | Давление Р=ратм+рманом | Объем воздуха в системе, V,мл | Абсолютная температура, Т |
| 1 |
|
|
|
| 2 |
|
|
|
Поместите в стакан с горячей водой сосуд и термометр, снять показание термометра когда воздух в сосуде достаточно прогреется. Следить за показанием манометра, что бы показания оставались постоянными (регулируя штоком шприца).
По данным таблицы сделайте расчеты и убедитесь в справедливости закона Гей-Люссака.
3. Изучение изохорного процесса
Выжать воздух из шприца и пережать трубку зажимом 1. Убедится в нулевых показаниях монометра, пережать трубку зажимом 2.
Измерить температуру окружающей среды, а барометром атмосферное давление.
| №опыта | Объем, мл | Давление | Температура, Т |
| 1 |
|
|
|
| 2 |
|
|
|
Поместить в стакан с горячей водой сосуд и термометр. Снять показания термометра и манометра после прогрева воздуха в сосуде, занести результаты в таблицу.
По данным таблицы и расчетам, проделанным по формуле, убедитесь в справедливости закона Шарля





 зобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
зобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака: