Лабораторная работа№24
Изучение изотермического процесса в газах
Цель работы:экспериментальным путемпроверить верность закона Бойля – Мариотта (доказать постоянство произведения PV).
Виртуальная лаборатория «Изучение изотермического процесса в газах»- http://efizika.ru/html5/24/index.html.
Установка моделирует лабораторную работу «Изучение изотермического процесса в газах».
Краткая теория
Для реальных и идеальных газов,уравнение состояния можно описать тремя параметрами P, V, T и получить уравнение состояния идеального газа:
pVRT
mRT. (1)
M
Это соотношение может принять такой вид (с учетом для одного моля любого газа):
pVRT.
В 1834 году, физиком Бенуа Поль Эмиль Клапейрон, было открыто уравнение устанавливающее зависимость между давлением, объемом и температурой газа. Это уравнение имеет вид:
pV=(ν1 +ν2 +ν3+...)RT.
В форме (1) оно было впервые записано Дмитрием Ивановичем Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона – Менделеева.
Объединенный газовый закон для любой постоянной массы газа (азначит, и для одного моля газа) имеет вид:
или
P1V1T1
PV T
P2V2,
T2
const.
Необходимо выделить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно- кинетической модели,закономерности поведения газов в различных условиях
были хорошо исследованы опытным путем.Поэтому уравнение
PV
mRT M
можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (P, V и T). Процессы могут быть изображены на диаграмме состояний (например,в
координатах P, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров(P,Vили
остается неизменным.Такие процессы называются изопроцессами. Для пояснения приведем пример.
Возьмем цилиндрический сосуд с плотно притертым поршнем. Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако если охлаждая сосуд при сжатии газа или нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим(Т = const).
Предоставим газу возможность расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить следующим образом. Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Сообщим бутыль с внешним воздухом, дадим воздуху в бутыли возможность расширяться, выходя из небольшого отверстия наружу,и поместим в струе расширяющегося воздуха термометр. Термометр покажет температуру, заметно более низкую, чем комнатная, а что будет указывать на понижение температуры воздуха в струе.
Следовательно, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением.
Из уравнения
pVRT
состояния идеального газа следует,что при
постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления P газа на его объем V должно оставаться постоянным:
pV=const
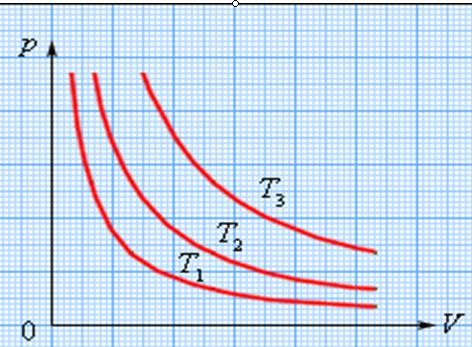
Процесс изменения давления и объема газа при постоянной температуре называется изотермическим процессом. График зависимости давления газа от его объема при изотермическом процессе называется изотермой. На плоскости (P, V) изотермы изображаются при различных значениях температуры T семейством гипербол P ~ 1 / V (рис. 1).
Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры.
| 
|
| Рис.1.Семействоизотермнаплоскости(p,V):T3T2T1 |
Уравнение изотермического процесса, выражающее зависимостьдавления от объема газа при постоянной температуре было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта
P1V1P2V2.
Однако закон Бойля-Мариотта перестает выполняться, если перейти к большим давлениям.
Ходработы
Запустить виртуальный стенд-http://efizika.ru/html5/24/index.html.

Установить начальные параметры газа:давление P0, температуру t0 и объем V0.
Выбрать для исследования газ из пяти возможных: воздух, ацетилен, метан, аргон, углекислый газ.
Нажать на кнопку«Пуск»для начала нагревания газа.
При достижении кратных температур или давлений останавливать нагрев кнопкой «Пауза».
Снять показания установившегося объема газа Viи давления Piи найти произведение РiVi.
Продолжить нагрев, нажав на кнопку«Пуск».
Вновь останавливать нагрев к нопкой«Пауза».
Записать значения конечного объемаVi при увеличении давления Pi.
Найти произведение РiViи убедиться в их примерном равенстве, т.е. в справедливости закона Бойля-Мариотта.
Определить оценку абсолютной и относительной погрешностей измерения.
Данные исследования занести в таблицу.
|
№, п/п |
газ | М, кг/моль (молярная масса) | m, кг (масса газа) | Начальные показатели |
| P0, кПа (давление) | V0,м3 (объем) | t0, С (температура по Цельсии) | T0, К (температура Кельвина) |
| 1 |
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Конечные показатели | РiVi, кПам3 | Р0V0, кПам3 | (PV), кПам3 | (PV), % |
| Рi, кПа (давление) | Vi, м3(объем) | ti, С (температура по Цельсию) | Ti,К (температура Кельвина) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сформулировать выводы.
2


















