Лабораторное занятие.
Окислительные свойства перманганата калия в различных средах и при разложении
Цель работы: изучение окислительных свойств перманганата калия в различных средах (ОК04, ОК07, ОК09)
Задачи работы: изучить окислительные свойства перманганата калия при различных значениях рН и при нагревании, продолжить овладевать методами экспериментального исследования и обработки полученных результатов.
Пояснения к работе:
В результате выполнения лабораторной работы студент должен:
знать/понимать:
- важнейшие химические понятия: вещество, степень окисления, растворы, окислитель и восстановитель, окисление и восстановление;
- важнейшие вещества и материалы: серная кислота; щелочь;
уметь:
- называть изученные вещества по "тривиальной" или международной номенклатуре;
- определять: степень окисления химических элементов, характер среды в водных растворах неорганических соединений, окислитель и восстановитель,
- объяснять: зависимость свойств веществ от их состава и строения;
- проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту и на производстве;
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
- критической оценки достоверности химической информации, поступающей из разных источников;
- понимания взаимосвязи учебного предмета с особенностями профессий и профессиональной деятельности, в основе которых лежат знания по данному учебному предмету.
Оснащение занятия:
1. Габриелян О.С. Химия для профессий и специальностей технического профиля [Текст]: учебник/О.С.Габриелян, И.Г.Остроумов.-2-е изд; стер.-М.: Издательский центр «Академия»,-2016.-с. 93-100
2. Лабораторное оборудование и реактивы: пробирки, спиртовка, штатив, лучина. растворы KMnO4, H2SO4, NaOH, твердые вещества KMnO4, Na2SO3.
Задание. Ознакомьтесь с теоретическими вопросами. Выполните опыты №24, 25. Оформите отчёт о работе в соответствии с предъявляемыми требованиями.
Методика выполнения задания.
Опыт 24. Окислительные свойства перманганата калия. В три пробирки налейте по 5-6 капель раствора KMnO4.
Затем в первую пробирку прибавьте 3-4 капли раствора H2SO4, во вторую – ничего не приливаем, а в третью - 3-4 капли раствора NaOH.
После этого в каждую пробирку прибавьте сухую соль Na2SO3. Как изменяется окраска растворов?
Запишите уравнения реакций взаимодействия перманганата калия с сульфитом натрия в кислой, нейтральной и щелочной средах.
Расставьте коэффициенты в уравнениях реакций методом электронного баланса, сделайте вывод об окислительных свойствах перманганата калия при различных значениях рН.
Опыт 25. Разложение перманганата калия при нагревании (получение, собирание и распознавание кислорода). 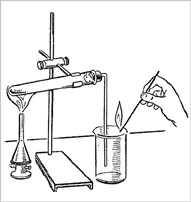
В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 , у отверстия пробирки положите рыхлый комочек ваты.
Закройте пробирку пробкой с газоотводной трубкой.
Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.
Наличие кислорода в сосуде проверьте тлеющей лучинкой,
для этого поднесите её к отверстию стакана. Что наблюдаете?
Опишите физические свойства кислорода, наблюдаемые при проведении опыта.
Запишите уравнение соответствующей реакции, Расставьте коэффициенты методом электронного баланса. Отметьте, окислителем или восстановителем является перманганат калия в данной реакции.
Предварительная подготовка. Краткие теоретические сведения
по теме «Соединения марганца (VII)»
В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMnO4, в быту называемый марганцовкой.
Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона MnO4- .
Перманганаты являются солями марганцевой кислоты HMnO4, которая устойчива только в разбавленных растворах (до 20%).
В зависимости от среды перманганат калия может восстанавливаться до различных соединений.
При нагревании сухого перманганата калия до температуры выше 2000С он разлагается по схеме: KMnO4 → K2MnO4 + MnO2 + O2↑
Этой реакцией в лаборатории пользуются для получения кислорода.
Марганцовая кислота HMnO4 и соответствующие ей соли - перманганаты, например, KMnO4, имеют в растворах характерный фиолетовый цвет.
Перманганаты являются сильными окислителями, особенно в кислой среде. Продуктами восстановления перманганат-ионов могут быть ионы Mn2+ (бесцветный раствор в кислой среде), черно-бурый осадок MnO2 (в нейтральной или слабощелочной среде) или ионы MnO42- (зеленый раствор в сильнощелочной среде):
а) KMnO4 + H2SO4 + Na2SO3 → MnSO4 + Na2SO4 + K2SO4 + Н2О
б) KMnO4 + H2O + Na2SO3 → MnO2 + Na2SO4 + KOH
в) KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O
Требования к содержанию и оформлению отчёта по лабораторной работе
Запишите в журнал лабораторно-практических занятий:
1. Название и цель работы.
2. Наименование и краткое описание опытов, наблюдения, химизм процесса (коэффициенты в уравнениях реакций расставьте методом электронного баланса)
3. Вывод к работе, в котором отразите, как изменяется окраска раствора при восстановлении перманганат-иона в различных средах.
4. Ответы к контрольным вопросам для самопроверки.
Контрольные вопросы для самопроверки
Какие реакции называются окислительно-восстановительными?
Какие вещества называются окислителями? восстановителями?
Какие из приведенных ниже веществ проявляют: а) только окислительные, б) только восстановительные, в) окислительные и восстановительные свойства: H2SO3, Zn, KI, КМnO4, NaNO2, K2Cr2O7, FeSO4, HNO3, H2S, Cl2, H2O, K2SO3, H2SO4?
Список литературы и интернет-источников
Габриелян О.С. Химия для профессий и специальностей технического профиля [Текст]: учебник/О.С.Габриелян, И.Г.Остроумов.-2-е изд; стер.-М.: Издательский центр «Академия»,-2016.-с. 97
Химия марганца и его соединений [Электронный ресурс]/ http://helpiks.org/.- Режим доступа: http://helpiks.org/5-5061.html, свободный.- Загл. с экрана



























