ЛЕКЦИЯ 7 ОСНОВНЫЕ ГЕНЕТИЧЕСКИЕ ПРОЦЕССЫ НА КЛЕТОЧНОМ И ОРГАНИЗМЕННОМ УРОВНЕ 1. Репликация ДНК. 2. Транскрипция. 3 . Трансляция.
1. Репликация ДНК
С огласно предложенной в 1953 г Уотсоном и Криком схеме репликации спиралевидная двухцепочная ДНК сначала расплетается, и цепи расходятся (рис. 6). При этом к нуклеотидам каждой цепи присоединяются комплементарные нуклеотиды, которые с помощью ферментов ДНК-полимераз связываются в новые полинуклеотидные цепи. В результате из одной образуются две дочерние двухцепочечные молекулы ДНК (рисунок 7.1). Таким образом, каждая реплицированная дочерняя молекула ДНК состоит из одной «старой» и одной «новой» цепей, вот почему такой способ репликации получил название - полуконсервативный. Два других теоретически возможных способа репликации – консервативный и дисперсный в отличии от полуконсервативного не получили экспериментального подтверждения.
огласно предложенной в 1953 г Уотсоном и Криком схеме репликации спиралевидная двухцепочная ДНК сначала расплетается, и цепи расходятся (рис. 6). При этом к нуклеотидам каждой цепи присоединяются комплементарные нуклеотиды, которые с помощью ферментов ДНК-полимераз связываются в новые полинуклеотидные цепи. В результате из одной образуются две дочерние двухцепочечные молекулы ДНК (рисунок 7.1). Таким образом, каждая реплицированная дочерняя молекула ДНК состоит из одной «старой» и одной «новой» цепей, вот почему такой способ репликации получил название - полуконсервативный. Два других теоретически возможных способа репликации – консервативный и дисперсный в отличии от полуконсервативного не получили экспериментального подтверждения.
В 1958 г М. Мезелсон и Ф. Сталь в блестящем эксперименте убеди-тельно доказали именно полукон-сервативный характер репликации ДНК предсказанный Уотсоном и Криком.
На первом этапе они выращива-ли клетки E. coli на питательной среде содержащей азот 15N – «тяже-лый» изотоп, который имеет на один нейтрон больше чем 14N. После культивирования на такой среде во все азотосодержащие молекулы E. coli, в том числе и ДНК включается тяжелый 15N. С помощью ультрацентрифугиро-вания в пробирках можно разделить ДНК содержащую 15N и 14N. Тяжелые молекулы 15N оседают ближе ко дну пробирки (рисунок 7.2).
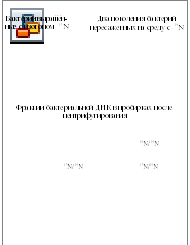
Рисунок 7.2 – Эксперименты Мезельсона-Сталя подтверждающие полуконсервативный характер репликации ДНК
На втором этапе меченные тяжелым изотопом бактерии перено-сили на новую среду, содержащую обычный 14N. Следовательно вся вновь синтезированная ДНК E. coli содержала легкий изотоп 14N. Как видно из рис. 7 выделенная из E. coli после одного поколения культи-вирования ДНК в результате центрифугирования осаждалась в пробирке одной фракцией промежуточной плотности, так как одна цепь содержала «легкий» изотоп, а вторая – «тяжелый».
После второго поколения культивирования плотность образца ДНК, взятой из E. coli разделилась на две фракции, с промежуточной (15N/14N) и легкой (14N/14N) плотностями (рисунок 7.2). Эти результаты в точности соответствуют полуконсервативному механизму репликации ДНК.
Дальнейшие исследования показали, что процесс полуконсер-вативной репликации молекул ДНК начинается в определенной точке инициации (ori). В хромосомах эукариот имеется по нескольку таких точек. Цепи ДНК в точке инициации репликации разъединяются (раскручиваются) под влиянием фермента геликазы (рисунок 7.3). Возникает репликационная вилка с одноцепочечными участками ДНК, которые становятся матрицами для репликации (рисунок 7.3). Эти участки связываются с белками SSBP (single-stranded binding proteins), которые не позволяют им вновь соединиться в двойную спираль. Возникающая суперскрученность и напряжение в нераскрученной части ДНК репликациооной вилки (рисунок 7.3) снимает ферментный комплекс топоизомераза (ДНК-гираза у прокариот).

Д
Рисунок 7.3 – Репликационная вилка с указанием лидирующей и запаздывающей цепей вновь синтезированной ДНК.
НК-полимераза, осуществляет процесс репликации в направлении 5'-3'
, она способна присоединять нуклеотиды только к 3'-ОН группе предыдущего нуклеотида и для синтеза новой цепи ей требуется затравка (праймер) со свободным 3'-концом. Поэтому сначала на ДНК-матрице с помощью
праймазы (РНК-полимеразы) синтезируется короткий (~10 нуклеотидов) фрагмент РНК. Именно к такому
РНК-праймеру ДНК-полимераза присоединяет дезоксинуклеотиды, синтезируя новую цепь (рис. 8). Затем РНК-праймер вырезается, замещаясь фрагментом ДНК.
Репликация начинается на материнской цепи, идущей от точки инициации в направлении 3'-5' и идет непрерывно в виде сплошной линии. Эта цепь называется лидирующей (рис. 8). Синтез на второй цепи идет в обратном направлении в виде отдельных коротких (200-2000 нуклеотидов) фрагментов Оказаки, названных так по имени открывшего их ученого. Эта цепь получила название запаздывающей. После завершения синтеза РНК праймеры в составе фрагментов Оказаки заменяются на ДНК и все фрагменты соединяются при помощи фермента лигазы в общую полинуклеотидную цепочку. В результате репликации образуются две идентичные молекулы ДНК, которые в хромосомах эукариот становятся двумя хроматидами.
2. Транскрипция ДНК
При рассмотрении вопроса о том как генетическая информация заложенная в ДНК реализуется в процессе синтеза белка Уотсон и Крик теоретически предсказали существование и-РНК (посредника).
РНК отличается от ДНК тем, что у нее углеводом является рибоза вместо дезоксирибозы. Кроме того, вместо нуклеотида тимина у нее урацил (рисунок 7.4). И наконец, в отличие от ДНК она имеет в основном одноцепочечное строение.
В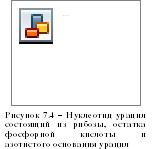 1962 г. Э. Волкин и Л. Астрохан обнаружили, что при синтезе белка в клетках E. coli, зараженных фагом Т2 резко усиливается синтез короткоживущих молекул РНК, которые были комплементарны одной из цепей фага Т2, но не ДНК E. coli. Позднее в многочисленных экспериментах было показано, что наследственная информация, записанная в ДНК (гене), точно транскрибируется (переписывается) в нуклеотидную последовательность короткоживущих и-РНК, которые определяют синтез конкретных белков у всех организмов.
1962 г. Э. Волкин и Л. Астрохан обнаружили, что при синтезе белка в клетках E. coli, зараженных фагом Т2 резко усиливается синтез короткоживущих молекул РНК, которые были комплементарны одной из цепей фага Т2, но не ДНК E. coli. Позднее в многочисленных экспериментах было показано, что наследственная информация, записанная в ДНК (гене), точно транскрибируется (переписывается) в нуклеотидную последовательность короткоживущих и-РНК, которые определяют синтез конкретных белков у всех организмов.
Транскрипция осуществляется с помощью фермента ДНК-зависимой РНК-полимеразы и всегда идет в направлении 5'-3'. Матрицей для синтеза и-РНК служит только одна цепь ДНК - 3'-5', которая (как ни странно) называется некодирующей.. Комплементарная ей цепь 5'-3', последовательность нуклеотидов в которой совпадает с последовательностью и-РНК называется кодирующей. Синтез и-РНК начинается с участка инициации транскрипции, называемого промотором. Промотор расположен перед геном и включает 40-80 нуклеотидов. В нем имеются важный участок «ТАТА-бокс» (рисунок 7.5,а). При помощи белковой σ-субъединицы РНК-полимераза соединяется с промотором и разъединяет комплементарные цепи ДНК в области ТАТА последовательности (рисунок 7.5,б). Затем

Рисунок 7.5 – Схематическое изображение этапов транскрипции
этот фермент двигается вдоль гена и по мере разъединения цепей ДНК на одной (3'-5'), ведет синтез и-РНК, согласно принципу комплементарности присоединяя аденин к тимину, урацил к аденину, цитозин к гуанину и гуанин к цитозину (рисунок 7.5,в). Те участки гена, на которых полимераза образовала и-РНК, вновь соединяются, а синтезируемая молекула и-РНК постепенно отделяется от ДНК. Конец синтеза и-РНК определяется участком остановки транскрипции – терминатором (рисунок 7.5,г). Нуклеотидные последовательности промотора и терминатора узнаются специальными белками, регулирующими активность РНК-полимеразы.
У эукариот в структурной части гена имеются отрезки ДНК, не содержащие информации, которые были названы интронами. Участки ДНК, несущие информацию, называются экзонами (рис. 11).
В ходе считывания информации с определенного участка ДНК (гена) сначала образуется первичный транскрипт всей последовательности (про-мРНК), а затем происходит процесс сплайсинга (сшивания), который заключается в том, что интроны из РНК как бы «выпетливаются» и удаляются, а информативные участки – экзоны соединяются при помощи фермента сплайсазы в одну непрерывную последовательность и-РНК. Перед выходом из ядра к начальной (5') части и-РНК присоединяется метилированный гуанин, называемый «КЭП» (колпачек), а к 3'-концу и-РНК присоединяется примерно 200 остатков аденина, образуя поли-А хвост (рисунок 7.6). В таком виде зрелая и-РНК (матричная РНК) проходит через ядерную мембрану в ци-
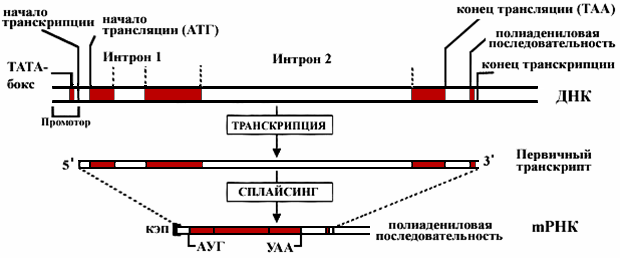
Рисунок 7.6 – Упрощенная схема β-глобинового гена человека и матричной мРНК после процесса транскрипции и сплайсинга. Этот ген состоит из более чем 2 тыс. н.п. Однако из них только около 450 н.п. несут информацию об аминокислотной последовательности β-глобина. Кроме трех кодирующих участков (экзонов), ген включает два некодирующих (интроны 1 и 2). Образующийся первичный транскрипт РНК состоит из ~1600 н.п. Во время сплайсинга РНК интроны, удаляются и оба конца РНК модифицируются.
топлазму, где соединяется с рибосомой. Считают, что у эукариот «КЭП» и поли-А хвост защищают и-РНК от разрушения в ходе ее продвижения к рибосомам в цитоплазме. Предполагается также, что «КЭП» играет определенную роль в связывании и-РНК с малой субчастицей рибосомы.
3. Трансляция
Трансляция наряду с репликацией и транскрипцией является еще одним важнейшим этапом реализации генетической информации в клетке. В самом общем виде трансляция – это процесс биосинтеза белка по матрице иРНК, который протекает на рибосомах. В этом процессе кроме информационной РНК принимают активное участие еще два типа РНК – транспортные и рибосомные.
Транспортные РНК. Роль тРНК заключается в том, что они переносят аминокислоты к рибосомам и участвуют в процессе синтеза белка. Транспортные РНК, которых насчитывается более 60-ти, состоят из 75-90 нуклеотидов и имеют структуру в виде клеверного листа (рисунок 7.7). Каждая аминокислота присоединяется к определенной тРНК. На одном конце тРНК находится акцепторный триплет ЦЦА, к аденину которого присоединяется специфическая аминокислота. На другом конце (в антикодонной петле) каждой тРНК находится антикодон – специфический триплет, с помощью которого тРНК «узнает» соответствующий комплементарный кодон в иРНК, и тем самым определяет место, куда должна быть поставлена данная аминокислота в синтезируемой молекуле белка. Боковые петли тРНК, по-видимому, используются для связывания с рибосомой и со специфической аминоацил-тРНК-синтетазой.
Р ибосомные РНК. Размер рибосомных рРНК составляет 120–3100 нуклеотидов. Они служат каркасом рибосом и способствуют первоначальному связыванию иРНК с рибосомой в ходе биосинтеза белка.
ибосомные РНК. Размер рибосомных рРНК составляет 120–3100 нуклеотидов. Они служат каркасом рибосом и способствуют первоначальному связыванию иРНК с рибосомой в ходе биосинтеза белка.
Рибосомы являются клеточными органеллами, на которых протекает процесс биосинтеза белка. Их число в клетке прокариот составляет примерно ≈ 104, а у эукариот ≈ 105. В период синтеза белка рибосомы могут объединяться в полисомы. Рибосомы состоят из двух субъединиц разного размера и формы. Размер эукариотической рибосомы составляет 80S (S – ед. Сведберга, характеризующая скорость седиментации при центрифугировании). Большая субъединица величиной 60S состоит из рРНК трех типов - 28S, 5S и 5,8S и 50 белков, а малая величиной 40S - из 18S рРНК и 33 белков. У прокариот рибосома имеет величину 70S и состоит из большой (50S) субъединицы, в состав которой входит 23S и 5S рРНК, а также 34 белка и малой (30S), состоящей из 16S рРНК и 21 белка.
Как уже отмечалось, трансляция заключается в том, что последовательность расположения кодонов в иРНК переводится в строго упорядоченную последовательность расположения аминокислот в молекуле синтезируемого белка (рисунок 7.8). Процесс
 трансляции включает два этапа: активирование аминокислот и присоединение их к «своим» тРНК и непосредственно синтез белковой молекулы.
трансляции включает два этапа: активирование аминокислот и присоединение их к «своим» тРНК и непосредственно синтез белковой молекулы.
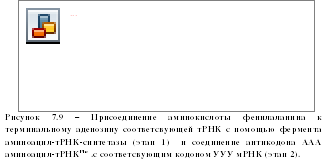 Активирование свободных аминокислот и присоединение их к тРНК осуществляется при помощи специализированных ферментов – аминоацил-тРНК-синтетаз. В молекуле каждой аминоацил-тРНК-син-тетазы имеется по крайней мере три центра связывания: для аминокислоты, тРНК и АТФ. Сначала осуществляется связь аминоацилтРНК-синтетазы с определенной аминокислотой, а затем активированная с помощью АТФ аминокислота присоединяется к аденину акцепторного триплета ЦЦА тРНК (рисунок 7.9). В результате образуется аминоацил-тРНК (аа-тРНК). Аминоацил-тРНК взаимодействует с одним из белковых факторов, который в комплексе с ГТФ необходим для транспорта и связывания аа-тРНК с рибосомой.
Активирование свободных аминокислот и присоединение их к тРНК осуществляется при помощи специализированных ферментов – аминоацил-тРНК-синтетаз. В молекуле каждой аминоацил-тРНК-син-тетазы имеется по крайней мере три центра связывания: для аминокислоты, тРНК и АТФ. Сначала осуществляется связь аминоацилтРНК-синтетазы с определенной аминокислотой, а затем активированная с помощью АТФ аминокислота присоединяется к аденину акцепторного триплета ЦЦА тРНК (рисунок 7.9). В результате образуется аминоацил-тРНК (аа-тРНК). Аминоацил-тРНК взаимодействует с одним из белковых факторов, который в комплексе с ГТФ необходим для транспорта и связывания аа-тРНК с рибосомой.
Процесс синтеза белка на рибосомах подразделяется на три стадии: инициация, элонгация и терминация (рисунок 7.10).
Инициация. Инициация синтеза полипептидной цепи начинается с присоединения малой субъединицы рибосомы к соответствующему центру связывания на иРНК (рисунок 7.10, А). Сигналом инициации трансляции служит кодон для метионина АУГ, который расположен в начале иРНК. К кодону АУГ своим антикодоном УАЦ присоединяется аа-тРНК с метионином (у бактерий с формилметионином). Затем к этому комплексу, присоединяется большая субъединица рибосомы. В результате образуется полная рибосома (80S), включающая молекулу иРНК и инициаторную аа-тРНК с метионином, которая располагается в пептидильном центре большой субъедницы (рисунок 7.10, А).

Элонгация. В свободный аминоацильный центр рибосомы со второй аминокислотой поступает следующая аа-тРНК, которая своим антикодоном соединяется со строго с комплементарным кодоном иРНК (рисунок 7.10, Б). В этот момент при помощи фермента пептидилтрансферазы предшествующая аминокислота (метионин) своей карбоксильной группой (СООН) соединяется с аминогруппой (NH2) вновь пришедшей аминокислоты. Между ними образуется пептидная связь (–СО–NH–). В результате тРНК, принесшая метионин, освобождается, а в аминоацильном центре к тРНК присоединен уже дипептид. Дипептидил-тРНК благодаря перемещению рибосомы на один кодон при участии фермента транслоказы и белкового фактора элонгации продвигается из аминоацильного центра в пептидильный. Освободившаяся тРНК и связанный с ней кодон иРНК АУГ выходят из рибосомы. (рис. 15, Б). Следующая аа-тРНК приносит новую аминокислоту в освободившийся аминоацильный центр в соответствии с поступившим туда кодоном. Эта аминокислота при помощи пептидной связи соединяется с предыдущей. При этом рибосома снова продвигается еще на один кодон, и процесс повторяется (рисунок 7.10, Б).
Терминация. Как только в аминоацильный центр рибосомы поступит один из терминирующий кодонов иРНК (УАА, УАГ или УГА), к нему присоединяется белковый фактор терминации и блокирует дальнейшую элонгацию цепи (рисунок 7.10, В). После этого синтезированная полипептидная цепь отделяется от тРНК, рибосомные субъединицы диссоциируют и освобождают тРНК и иРНК, которые могут принять участие в синтезе следующей полипептидной цепи (рисунок 7.10, В).
На одной молекуле иРНК работает не одна рибосома, а многие (до 100). На каждой из рибосом строится полипептидная цепь. У бактерий транскрипция и трансляция связаны между собой и трансляция начинается до завершения синтеза иРНК на ДНК. Образующиеся при синтезе полипептидные цепи претерпевают ряд посттрансляционных преобразований и только после этого начинают выполнять в организме свои специфические функции.
10







 огласно предложенной в 1953 г Уотсоном и Криком схеме репликации спиралевидная двухцепочная ДНК сначала расплетается, и цепи расходятся (рис. 6). При этом к нуклеотидам каждой цепи присоединяются комплементарные нуклеотиды, которые с помощью ферментов ДНК-полимераз связываются в новые полинуклеотидные цепи. В результате из одной образуются две дочерние двухцепочечные молекулы ДНК (рисунок 7.1). Таким образом, каждая реплицированная дочерняя молекула ДНК состоит из одной «старой» и одной «новой» цепей, вот почему такой способ репликации получил название - полуконсервативный. Два других теоретически возможных способа репликации – консервативный и дисперсный в отличии от полуконсервативного не получили экспериментального подтверждения.
огласно предложенной в 1953 г Уотсоном и Криком схеме репликации спиралевидная двухцепочная ДНК сначала расплетается, и цепи расходятся (рис. 6). При этом к нуклеотидам каждой цепи присоединяются комплементарные нуклеотиды, которые с помощью ферментов ДНК-полимераз связываются в новые полинуклеотидные цепи. В результате из одной образуются две дочерние двухцепочечные молекулы ДНК (рисунок 7.1). Таким образом, каждая реплицированная дочерняя молекула ДНК состоит из одной «старой» и одной «новой» цепей, вот почему такой способ репликации получил название - полуконсервативный. Два других теоретически возможных способа репликации – консервативный и дисперсный в отличии от полуконсервативного не получили экспериментального подтверждения. 

 1962 г. Э. Волкин и Л. Астрохан обнаружили, что при синтезе белка в клетках E. coli, зараженных фагом Т2 резко усиливается синтез короткоживущих молекул РНК, которые были комплементарны одной из цепей фага Т2, но не ДНК E. coli. Позднее в многочисленных экспериментах было показано, что наследственная информация, записанная в ДНК (гене), точно транскрибируется (переписывается) в нуклеотидную последовательность короткоживущих и-РНК, которые определяют синтез конкретных белков у всех организмов.
1962 г. Э. Волкин и Л. Астрохан обнаружили, что при синтезе белка в клетках E. coli, зараженных фагом Т2 резко усиливается синтез короткоживущих молекул РНК, которые были комплементарны одной из цепей фага Т2, но не ДНК E. coli. Позднее в многочисленных экспериментах было показано, что наследственная информация, записанная в ДНК (гене), точно транскрибируется (переписывается) в нуклеотидную последовательность короткоживущих и-РНК, которые определяют синтез конкретных белков у всех организмов. 

 ибосомные РНК. Размер рибосомных рРНК составляет 120–3100 нуклеотидов. Они служат каркасом рибосом и способствуют первоначальному связыванию иРНК с рибосомой в ходе биосинтеза белка.
ибосомные РНК. Размер рибосомных рРНК составляет 120–3100 нуклеотидов. Они служат каркасом рибосом и способствуют первоначальному связыванию иРНК с рибосомой в ходе биосинтеза белка.  трансляции включает два этапа: активирование аминокислот и присоединение их к «своим» тРНК и непосредственно синтез белковой молекулы.
трансляции включает два этапа: активирование аминокислот и присоединение их к «своим» тРНК и непосредственно синтез белковой молекулы. Активирование свободных аминокислот и присоединение их к тРНК осуществляется при помощи специализированных ферментов – аминоацил-тРНК-синтетаз. В молекуле каждой аминоацил-тРНК-син-тетазы имеется по крайней мере три центра связывания: для аминокислоты, тРНК и АТФ. Сначала осуществляется связь аминоацилтРНК-синтетазы с определенной аминокислотой, а затем активированная с помощью АТФ аминокислота присоединяется к аденину акцепторного триплета ЦЦА тРНК (рисунок 7.9). В результате образуется аминоацил-тРНК (аа-тРНК). Аминоацил-тРНК взаимодействует с одним из белковых факторов, который в комплексе с ГТФ необходим для транспорта и связывания аа-тРНК с рибосомой.
Активирование свободных аминокислот и присоединение их к тРНК осуществляется при помощи специализированных ферментов – аминоацил-тРНК-синтетаз. В молекуле каждой аминоацил-тРНК-син-тетазы имеется по крайней мере три центра связывания: для аминокислоты, тРНК и АТФ. Сначала осуществляется связь аминоацилтРНК-синтетазы с определенной аминокислотой, а затем активированная с помощью АТФ аминокислота присоединяется к аденину акцепторного триплета ЦЦА тРНК (рисунок 7.9). В результате образуется аминоацил-тРНК (аа-тРНК). Аминоацил-тРНК взаимодействует с одним из белковых факторов, который в комплексе с ГТФ необходим для транспорта и связывания аа-тРНК с рибосомой.




















