Просмотр содержимого документа
«Презентация на тему "Химические свойства воды"»

Составила учительница химии
МКОУ Урадинская сош
Ахмедова З . С.

Вода даёт жизнь, но если она разгневается, то может забрать жизнь у всего живого.

ВОДА
Н 2 О
М r =18 Единственное вещество в природе ,
которое в земных условиях существует во всех трех агрегатных состояниях: жидком (вода), твердом (лед) и газообразном (пар).

3/4 поверхности Земли покрыто водой

Вода в природе
океан реки ледники

ВОДА
Н 2 О Жидкость,
Mr=18 без вкуса,
без цвета,
без запаха.
(Н 2 О)=1г / см 3 при 4°С,
Т кип =100°С,Т пл =0°С (при р=1атм)

ЗАГРЯЗНИТЕЛИ ПРИРОДНЫХ ВОД
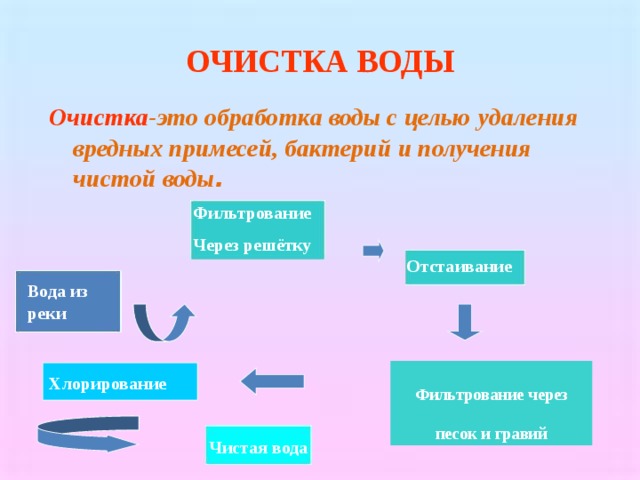
ОЧИСТКА ВОДЫ
Очистка -это обработка воды с целью удаления вредных примесей, бактерий и получения чистой воды .
Фильтрование
Через решётку
Отстаивание
Вода из реки
Фильтрование через песок и гравий
Хлорирование
Чистая вода

Какая вода называется дистиллированной?
Чем отличается природная вода от дистиллированной?

Н 2 О
Типы химических реакций на примере свойств воды

Типы химических реакций
Реакции
разложения
Реакции
соединения
Реакции
замещения
Реакции
обмена

Реакции соединения
2Н 2 + О 2 → 2Н 2 О

Реакции разложения
электрический ток
Электролиз воды

6C О 2 + 6Н 2 О → С 6 Н 12 О 6 + 6О 2 ↑

Реакция
соединения
Опыт. Взаимодействие оксида кальция с водой
CaO + H 2 O =
Ca(OH) 2

Реакции соединения
Но:
- SiO 2 + H 2 O =
- FeO + H 2 O =
+3
+3
HNO 2
2
+5
+5
2
HNO 3
гидроксиды- кислородсодержащие кислоты и основания

Реакции замещения
Опыт. Взаимодействие калия с водой
2
2
K + H 2 O = KOH + H 2
2

Реакции обмена
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
Опыт. Взаимодействие карбида кальция с водой
CaC 2 + H 2 O = C 2 H 2 + Ca(OH) 2
2

Выберите записи, представляющие собой только левую (1 вариант) или только правую(2 вариант) часть уравнения химической реакции:
- А) = 2 H 2 + O 2
- Б) CaO + H 2 O =
- В) Cu(OH) 2 =
- Г) = 2NaCl +CO 2 +H 2 O

Соотнесите:
1 вариант) соединения
2 вариант) обмена
А) 2H 2 +O 2 =2H 2 O,
Б) NaOH+HCl=H 2 O+NaCl,
В) Al 2 S 3 +6H 2 O=2Al(OH) 3 +3H 2 S,
Г) BaO+H 2 O=Ba(OH) 2

Соотнесите:
А) 2H 2 O = 2H 2 +O 2 ,
Б) 2Fe(OH) 3 = Fe 2 O 3 +3H 2 O,
В) 2K+2H 2 O=2KOH+H 2,
Г) Ca+2H 2 O =Ca(OH) 2 +H 2 .
1вариант) разложения,
2вариант) замещения .

Ответы:

Домашнее задание
§ 3 3 , упр.1,3 на стр.173

Типы химических реакций:
замещения
соединения
обмена
разложения

Вода используется в самых разных областях деятельности человека. Без воды нет жизни. Поэтому важное значение имеет забота о чистоте природных вод.

- Что мы узнали сегодня нового?
- Что было непонятно?
- Какие были затруднения?
- Что показалось самым интересным?
- Что удивило вас?

Спасибо!












































