Просмотр содержимого документа
«Презентация по теме Азот.Амииак»
Petrov. S
Азот. Аммиак

1
Structure of nitrogen
N
7
Азот
2
5
14,0067
N
2s 2 2p 3
2p 3
2s 2
2
5
1s 2

78%
Азот в составе
воздуха
21%
1%
Кислород
Углексилый
Азот
газ

Физические
свойства
азота
бесцветный газ
без запаха и вкуса
т.к. −195,8 °C
В свободном состоянии азот существует в виде двухатомных молекул N 2 . В этих молекулах два атома азота связаны очень прочной тройной ковалентной связью.
N
N
Ковалентная неполярная связь
1
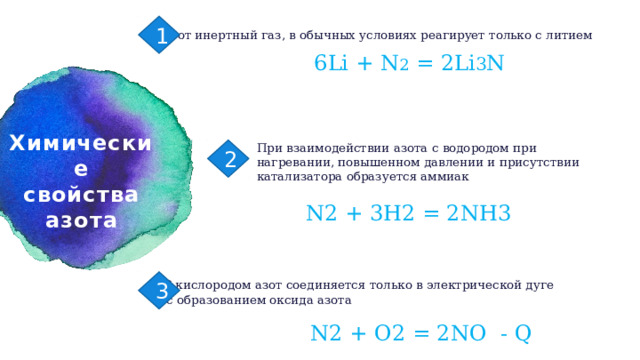
Азот инертный газ, в обычных условиях реагирует только с литием
6Li + N 2 = 2Li 3 N
Химические
свойства
азота
При взаимодействии азота с водородом при
нагревании, повышенном давлении и присутствии
катализатора образуется аммиак
2
N2 + 3H2 = 2NH3
3
С кислородом азот соединяется только в электрической дуге
с образованием оксида азота
N2 + O2 = 2NO - Q
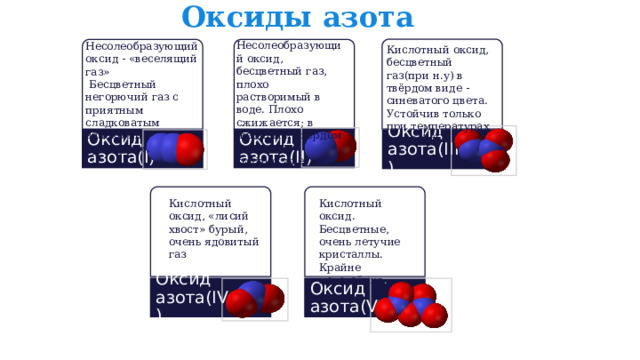
Оксиды азота
Несолеобразующий оксид, бесцветный газ, плохо растворимый в воде. Плохо сжижается; в жидком и твёрдом виде имеет голубой цвет.
Несолеобразующий оксид - «веселящий газ»
Бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Кислотный оксид, бесцветный газ(при н.у) в твёрдом виде -синеватого цвета. Устойчив только при температурах ниже-4 °C
Оксид азота(I)
Оксид азота(II)
Оксид азота(III)
Кислотный оксид, «лисий хвост» бурый, очень ядовитый газ
Кислотный оксид. Бесцветные, очень летучие кристаллы. Крайне неустойчив .
Оксид азота(IV)
Оксид азота(V)

Образование молекулы аммиака
На 4-й гибридизованной орбитали
атома N находится неподеленная
пара электронов.
Форма молекулы – пирамидальная.
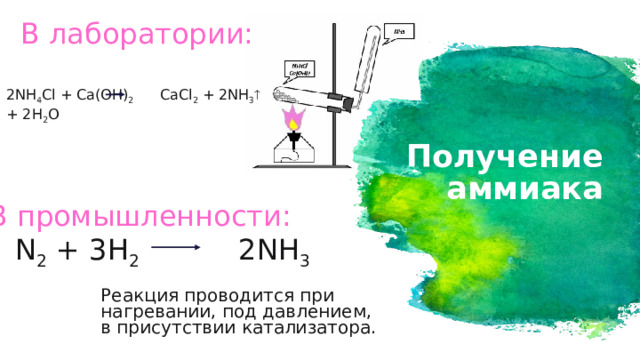
В лаборатории:
2NH 4 Cl + Ca(OH) 2 CaCl 2 + 2NH 3 + 2H 2 O
Получение аммиака
В промышленности:
N 2 + 3H 2 2NH 3
Реакция проводится при нагревании, под давлением,
в присутствии катализатора.

Физические
свойства
аммиака
Бесцветный газ с резким запахом
Очень хорошо растворяется в воде
При охлаждении до -33 0 С – cжижается

1
NH3 – сильный восстановитель .
NH3 + CuO = N2 + Cu + H2O
Химические
свойства
аммиака
2
Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H2О
3
Каталитическое окисление амииака
4NH3 + 5O2 → 4NO + 6H2O
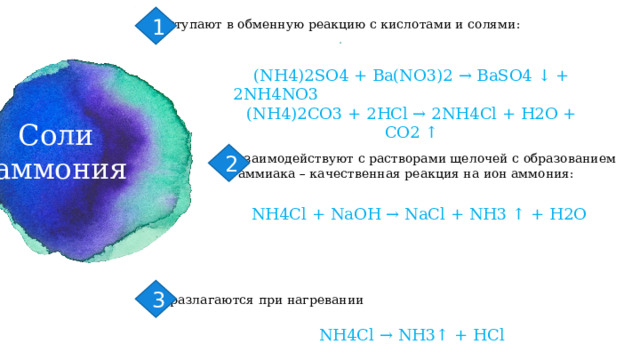
1
вступают в обменную реакцию с кислотами и солями:
.
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3 (NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
Cоли
аммония
2
взаимодействуют с растворами щелочей с образованием
аммиака – качественная реакция на ион аммония:
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
3
разлагаются при нагревании
NH4Cl → NH3↑ + HCl


Thanks!
Any questions?
You can find me at:
[email protected]





























