1. Дайте определение понятия «оксид».
2. Из перечисленных химических формул выписать формулы оксидов и дайте им названия:
СaO, Fe2O3, Na2O, SO3, СО2, Р2О5, ZnO
Просмотр содержимого документа
«Презентация к уроку химии в 8 классе "Оксиды, их классификация и свойства"»

Урок химии 8 класс (учебник Химия 8 О.С. Габриелян)
Оксиды, их классификация и свойства
Разработала учитель химии
МКОУ Гвазденская СОШ
Гайворонская Т.М.

Вопросы на повторение:
1. Дайте определение понятия «оксид».
2. Из перечисленных химических формул выписать формулы оксидов и дайте им названия:
СaO, Fe 2 O 3 , Na 2 O, SO 3 , СО 2 , Р 2 О 5 , ZnO.
3. Составьте формулы оксида серы(ΙV), оксида железа(ΙΙ), оксида лития, оксида алюминия, оксида марганца(VΙΙ).
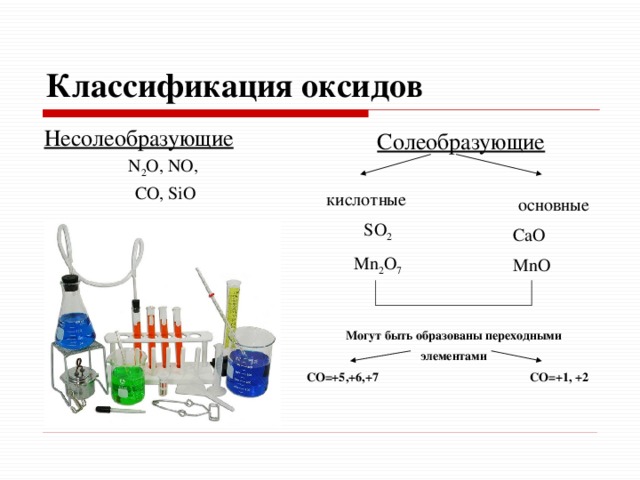
Классификация оксидов
Несолеобразующие
N 2 O, NO,
СО, SiO
Солеобразующие
кислотные
SO 2
Mn 2 O 7
основные
СаО
MnO
Могут быть образованы переходными
элементами
СО=+5,+6,+7 СО=+1, +2
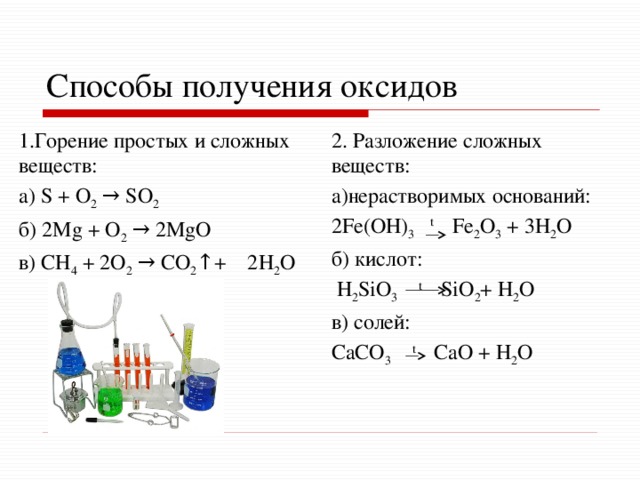
Способы получения оксидов
1.Горение простых и сложных веществ:
2. Разложение сложных веществ:
а)нерастворимых оснований:
а) S + O 2 → SO 2
б) 2Mg + O 2 → 2MgO
2Fe(OH) 3 t Fe 2 O 3 + 3H 2 O
б) кислот:
в) CH 4 + 2O 2 → CO 2 ↑+ 2H 2 O
H 2 SiO 3 t SiO 2 + H 2 O
в) солей:
CaCO 3 t CaO + H 2 O

Демонстрация опыта: горение серы в кислороде

Демонстрация опыта: горение магния в кислороде

Химические свойства оксидов
Основные:
Кислотные:
1 реагируют с водой с образованием щёлочи;
1 реагируют с водой (кроме Н 2 SiO 3 );
2 реагируют с кислотными оксидами;
2реагируют с основными оксидами;
3 реагируют со щелочами;
3 реагируют с кислотами;
4 ОВ реакции.
4 ОВ реакции.
а) СаО + Н 2 О →
а)SO 2 + Н 2 О →
СuO + Н 2 О→
SiO 2 + Н 2 О →
б) СаО + СO 2 →
б) SO 3 + Na 2 О →
в) СаО + HCl→
в) SO 3 + NaОН →
г) 2SO 2 + О 2 → 2SO 3
г) CuO + Н 2 →
2Cu 2 O + О 2 → 4СuO
SO 2 + С → СO 2 + S

Химические свойства оксидов
Взаимодействие основного оксида с кислотами

Упражнения:
Составьте уравнения реакций, схемы
которых даны ниже:
1) Са +… → СаО
2) Li + … → Li 2 O
3) Al +… → Al 2 O 3
4) PH 3 +… → Р 2 О 5 + Н 2 О
5) СuO +… → СuCl 2 + Н 2 О
6) Li 2 O +… → LiOH
7) Р 2 О 5 +…→ Н 3 РО 4
8) SO 3 +… → Na 2 SO 4 + Н 2 О

Домашнее задание:
§40, упр. 1,3, с. 163



























