

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Рабочая тетрадь по химии
Рабочая тетрадь предназначена для студентов первого курса, обучающихся по программе подготовки специалистов среднего звена
15.02.13 ТЕХНИЧЕСКОЕ ОБСЛУЖИВАНИЕ И РЕМОНТ СИСТЕМ ВЕНТИЛЯЦИИ И КОНДИЦИОНИРОВАНИЯ
Просмотр содержимого документа
«Рабочая тетрадь по химии»
Государственное бюджетное профессиональное образовательное учреждение
Самарской области
«Тольяттинский социально-экономический колледж»
ХИМИЯ
Рабочая тетрадь
Фамилия Имя (обучающегося)
Специальность
Группа
2020-2021 учебный год
Рабочая тетрадь предназначена для студентов первого курса, обучающихся по программе подготовки специалистов среднего звена
15.02.13 ТЕХНИЧЕСКОЕ ОБСЛУЖИВАНИЕ И РЕМОНТ СИСТЕМ ВЕНТИЛЯЦИИ И КОНДИЦИОНИРОВАНИЯ
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Раздел I. Общая и неорганическая химия
Тема 1.1. Основные понятия и законы химии.
Тема 1.2. Периодический закон и Периодическая система химических
элементов Д.И. Менделеева и строение атома.
Тема 1.3. Строение вещества.
Тема 1.4. Вода. Растворы. Электролитическая диссоциация.
Тема 1.5. Классификация неорганических соединений и их свойств.
Тема 1.6. Химические реакции.
Тема 1.7. Металлы и неметаллы.
Раздел II. Органическая химия
Тема: Основные понятия органической химии и теория строения органических соединений.
Тема: Углеводороды и их природные источники.
Тема: Кислородсодержащие органические соединения.
Тема: Азотсодержащие органические соединения.
ВВЕДЕНИЕ
Уважаемые студенты!
Рабочая тетрадь разработана для студентов I курса СПО и предназначена для аудиторной и самостоятельной работы по дисциплине «Химия».
Целью рабочей тетради является закрепление знаний химической терминологии и приобретение навыков в решении задач и упражнений по разделам «Общая и неорганическая химия» и «Органическая химия».
Рабочая тетрадь состоит из 11 занятий и отражает темы дисциплины «Химия».
Работая над имеющими в тетради заданиями, студент сможет проверить свои знания и практические умения, что облегчит подготовку к зачёту.
РАЗДЕЛ 1. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ.
Тема 1.1. Основные понятия и законы химии.
При проработке этой темы необходимо:
- повторить теоретический материал, используя литературу;
- усвоить понятия: моль, молярная масса, молярный объём, эквивалент, молярная масса;
- выучить основные законы химии (закон сохранения массы и энергии, постоянства состава, закон Авогадро и его следствия), пояснив их на примерах;
- уметь использовать их в химических расчетах для заполнения приведенной ниже таблицы.
Задание 1. Запишите определения:
Химия –
__________________________________________________________________
Вещество-
__________________________________________________________________
Свойства веществ–
__________________________________________________________________
Простые вещества –
__________________________________________________________________
Сложные вещества –
________________________________________________________________
Вещества постоянного состава –
__________________________________________________________________
Вещества переменного состава –
__________________________________________________________________
Задание 2. Ответьте на вопрос:
Из чего состоят молекулы, тела и вещества?
Задание 3. Запишите «Закон постоянства состава вещества»:
__________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
Задние 4. Дайте определение единицам измерения:
I.Относительная атомная масса элемента (Аr) - это величина, которая показывает_____________________________________________________________________________________________________________________________________________________________________________________________
Найдите в таблице Д.И. Менделеева и выпишите относительные атомные массы элементов (Аr) 3-го периода:
(Аr)Na=23, _____________ , _______________ , ____________ , ___________ ,
___________, _______________, ________________,
II. Количество вещества – __________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1 моль любого вещества содержит 6,02·10 23 частиц (атомов, ионов, молекул)
1 моль воды = 6,02·10 23 молекул Н2О
1 моль железа = 6,02·10 23 атомов Fe
1 моль хлора = 6,02·10 23 молекул Cl2
NA = 6,02 · 10 23 моль - Постоянная Авогадро
N = n *NA
N – число частиц, молекул; n – количество вещества, NA – постоянная Авогадро.
Запишите формулу, позволяющую вычислить количество вещества через Постоянную Авогадро:
____________________________________________________________________________________________________________________________________
Запишите Закон Авогадро -____________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________
III. Объем вещества, газа (V) - ______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
IV. Молярный объем (Vm) - ____________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________
Запишите формулу, позволяющую вычислить количество вещества через его объем:
__________________________________________________________________
Решите задачи:
1. Найдите число молекул, которое содержится в:
а) 1,5 моль Fe2O3 ; б) 0,5 моль PCl3.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Какому количеству вещества соответствует:
а) 18 · 1023 молекул MgO ; б) 3 · 1023 молекул серы
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
V. Молярная масса вещества (М) – ______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
М=m/n
М – молярная масса, г/моль; m – масса вещества; n – количество вещества, моль.
Запишите формулу, позволяющую вычислить количество вещества через молярную массу вещества:
__________________________________________________________________
VI. Относительная молекулярная масса вещества (Мr) – ______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
Атомные единицы массы Молярная масса (М) и относительная молекулярная масса (Mr) численно равны, если вещество состоит из молекул. |M| = |Mr|
Решите задачи:
Типовой пример решения задач.
Пример 1. Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr (KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 ·Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
Пример 2. Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4.
Дано:
Фосфорная кислота (H3PO4)
Найти: w%(H) ,w%(P) ,w%(O)
Решение:
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
Ar(H)=1 Ar(P)=31 Ar(O)=16
2. Вычисляем относительную молекулярную массу соединения
Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31%
Пример 3. Какую массу углекислого газа можно получить, если сжечь 3,2 г метана? Определите объем, который займет углекислый газ, образовавшийся в этой реакции при нормальных условиях.
Краткие условия в данном случае целесообразно записать, учитывая уравнение реакции сгорания метана, следующим образом:
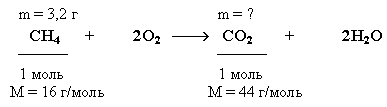
Решение:
1. Находим количество вещества метана, вступившего в реакцию:
![]()
2. Количество углекислого газа согласно уравнению реакции равно количеству метана:
ν(CO2) = ν(CH4) = 0,2 моль
3. Определяем массу CO2:
m(CO2) = ν(CO2) • M(CO2) = 0,2 моль • 44 г/моль = 8,8 г
Ответ: m(CO2) = 8,8 г
Пример 4.. Какой объем метана (н.у.) выделится при взаимодействии 10 г карбида алюминия (Al4C3) с 10 г воды?
Краткие условия:
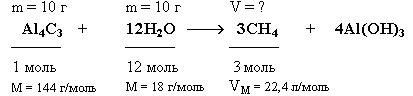
Решение:
1. Находим количества вступивших в реакцию веществ:

Так как на 1 моль Al4C3 требуется в 12 раз большее количество вещества воды, то на 0,069 моль Al4C3 необходимо 0,828 моль воды. Следовательно, 0,55 моль воды недостаточно для реакции с 0,069 моль Al4C3, который взят в избытке и прореагирует неполностью.
2. Определим ν(CH4) по веществу, взятому в недостатке:
![]()
3. Рассчитаем объем метана, образовавшегося в реакции:
V(CH4) = ν(CH4) • Vm = 0,137 моль • 22,4 л/моль = 3,07 л
Ответ: V(CH4) = 3,07 л
Задача1.Вычислите относительную молекулярную массу:
нитрата бария, сульфата меди (II), аммиака, карбоната кальция, фосфорной кислоты, сульфида натрия, азотной кислоты, гидроксида железа (III), сульфата бария, гидроксида магния, сульфата калия, хлорида цинка.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. Массовая доля элемента (ω) – __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Запишите формулу нахождения массовой доли элемента в веществе:
__________________________________________________________________
Задача 2.Рассчитайте массовую долю (%) для первого элемента в веществе:
Na2SO4, HNO3, К2СО3, Ag2O, NO2, Ва(ОН)2
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 3. В соответствии со своим вариантом решите задачи.
| № варианта | Номер задачи |
| 1 | 1,5,9,13,17,21,25 |
| 2 | 2,6,10,14,18,22,26 |
| 3 | 3,7,11,15,19,23,27 |
| 4 | 4,8,12,16,20,24,28 |
1.Рассчитайте, какое количество(n) углекислого газа получится при сгорании 6г угля С.
2.Какова масса нитрата меди, образующегося при взаимодействии оксида меди(II) массой 4г с азотной кислотой?
3.Какое количество вещества (n) воды можно получить, если сжечь 3 моль газа водорода.
4.Какой объем кислорода (н.у.) потребуется для сжигания 2,4г магния?
5.Сколько литров водорода (н.у.)можно получить при действии избытка разбавленной серной кислоты на цинк массой 24г?
6.Сколько граммов гидроксида калия потребуется для взаимодействия с 70г серной кислоты?
7.Сколько граммов водорода можно получить при взаимодействии алюминия массой 54г с соляной кислотой?
8. 4,6г натрия растворили в воде с образованием щелочи и водорода. Вычислите объем газа (н.у).
9.Какова масса соли, получившейся при взаимодействии оксида кальция массой 28 г с соляной кислотой?
10.Сколько литров оксида углерода (IV) (н.у.) можно получить при прокаливании известняка СаСО3, массой 200г?
11.Какая масса алюминия подверглась окислению кислородом, если образовалось 10,2г оксида алюминия.
12.При растворении цинка в соляной кислоте выделился газ объемом 6,72л. Вычислите массу растворившегося цинка.
13.Сколько литров водорода (н.у.) выделится при разложении электрическим током воды массой 72 г?
14.Сколько граммов серной кислоты прореагирует с цинком, если получается 4 моль сульфата цинка?
15.Сколько литров водорода (н.у.) сгорело, если образовалось 72 г воды?
16.Какое количество вещества водорода выделится при взаимодействии магния с соляной кислотой массой 146 г?
17.Сколько граммов сульфата цинка можно получить, имея 0,5 моль серной кислоты взаимодействующей с цинком?
18.Какой объем водорода в литрах выделится (н.у.) если с соляной кислотой прореагировало 3 моль магния?
19.Получают 3г ртути путем разложения оксида ртути НgО. Сколько граммов исходного вещества потребуется для этого?
21.Сколько потребуется карбоната кальция (мрамора) при взаимодействии с соляной кислотой для получения 5,6 л углекислого газа (н.у.)
22.Сколько молей кислорода необходимо для полного окисления 0,4 моль магния?
23.Сколько грамм гидроксида натрия потребуется для взаимодействия с 9,8г серной кислоты.
24.Хлорид магния реагирует с 10,6г карбоната натрия. Найти массу образовавшегося осадка.
25.Какой объем кислорода (н.у.) нужен для сжигания серы массой 6,4 г до SО2.
26.Какая масса гидроксида натрия потребуется для превращения сульфата меди (II) массой 16 г в гидроксид меди (II)?
27.Гидроксид алюминия массой 7,8 г растворили в соляной кислоте. Какая масса соли при этом образовалась?
28.Сколько грамм воды образуется при нейтрализации 8 г гидроксида натрия азотной кислотой?
РЕШЕНИЕ ЗАДАЧ:
Тема 1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома.
Строение атома и периодический закон Д.И.Менделеева являются вопросами, составляющими теоретическую основу всего курса общей химии.
При изучении этой темы следует:
- ознакомиться с протонно-нейтронной теорией строения атома;
- уяснить значения квантовых чисел для энергетической характеристики состояния электронов в атоме, принцип Паули, правило Гунда и порядок заполнения электронных уровней, подуровней и орбиталей;
- выяснить взаимосвязь между положением элемента в периодической системе и строением его атома;
- рассмотреть изменение свойств элементов в периодах и группах с точки зрения строения их атомов;
- приобрести навыки в составлении моделей атомов, электронных формул, определения числа валентных электронов и возможных степеней окисления.
Задание1. Запишите определения:
Атом ____________________________________________________________________________________________________________________________________
Молекула-______________________________________________________________________________________________________________________________________________________________________________________________________
Задание2. Дайте формулировку Периодического закона: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
Задание3. Как, исходя из строения атома, объяснить, что при переходе от углерода к свинцу неметаллические свойства ослабевают и возрастают металлические?
______________________________________________________________________________________________________________________________________________________________________________________________________
Задание 4. Ответьте на вопрос.
Как изменяются:
а) радиус атома у галогенов в группе сверху вниз?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) электроотрицательность?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
в) металлические свойства элементов 3-го периода от Na к Cl?
__________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 5. Запишите определения:
Период-________________________________________________________________________________________________________________________________________________________________________________________________
Группа- -____________________________________________________________________________________________________________________________________
Главная подгруппа – ______________________________________________________________________________________________________________________________________________________________________________________________________
Побочная подгруппа – ______________________________________________________________________________________________________________________________________________________________________________________________________
Задание 6.Составление характеристики химического элемента.
| № варианта | Название химического элемента: |
| 1 | ванадий, железо |
| 2 | галий, бром |
| 3 | скандий, молибден |
| 4 | титан, мышьяк |
Пользуясь периодической таблицей, дайте характеристику химическим элементам по плану:
1.Название химического элемента.
2.Химический знак, относительная атомная масса (Ar) химического элемента.
3.Порядковый номер химического элемента.
4.Номер периода (большой 4-7 или малый 1-3).
5.Номер группы, подгруппа (главная «А» или побочная «Б»).
6.Состав атома: число электронов, число протонов, число нейтронов.
(Подсказка! Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.)
7. Вид элемента (s, p, d, f).
(Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.)
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
(Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы "А" - Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;)
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d- элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле: Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.)
9.Электронная и электронно-графическая формулы строения атома.
(Подсказка! Для написания электронной формулы используйте шкалу энергий:
1s
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2 )
10.Металл или неметалл
(Подсказка! К неметаллам относятся:
-2 s-элемента - водород и гелий
-20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся:
все d- и f-элементы, все s-элементы (исключения водород и гелий),некоторые p-элементы.)
11.Высший оксид (только для s, p).
(Подсказка! Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p).
(Подсказка! Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.)
Задание7.Составление электронной конфигурации атомов химических элементов.
Электроны, двигаясь вокруг ядра атома, образуют в совокупности его электронную оболочку.
Число электронов в атоме равно заряду ядра атома и порядковому номеру.
Электроны в атоме различаются своей энергией, одни из них притягиваются к ядру сильнее, другие слабее. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки, чем дальше они от ядер, тем легче их оторвать.
Электроны образуют электронные слои, каждый слой состоит из электронов с близким значением энергии; поэтому электронные слои называют еще энергетическими уровнями.
Число энергетических уровней равно номеру периода.
Например, +1Н )
Максимальное число электронов находящихся на энергетическом уровне рассчитывается по формуле 2n2, где n – номер уровня.
1 эн. уровень максимально содержит 2 ē;
2 эн. уровень максимально содержит 8 ē;
3 эн. уровень максимально содержит 18 ē;
Число электронов на внешнем энергетическом уровне равно номеру группы (для главных подгрупп).
Движущийся в пространстве вокруг атомного ядра электрон образует электронные облака, их еще называют орбиталями.
Электронные облака имеют разную форму. (s,p,d,f)
Таким образом электронная формула атомов имеет общий вид –
1s 2s2p 3s3p 4s
Максимальное число электронов на s- подуровнях 2ē, на p – 6ē.
Пример: Элемент № 3- литий.
Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. 
7.1. Напишите электронные конфигурации для элементов.
| № варианта | Порядковый номер химического элемента: |
| 1 | № 33, № 42, № 52 |
| 2 | № 31, №50, №53 |
| 3 | № 22, №39,№ 47 |
| 4 | № 38, №48, №49 |
7.2. По электронным конфигурациям найдите элемент, укажите его тип
| № варианта | электронные формулы |
| 1 | 2s1 , 2s2p4 , 3s23p6 , 4s2 , 4s24p2 , 3d14s2 |
| 2 | 3d74s2 , 5s25p5, 3s23p3 ,5s25p4, 4d55s1, 2s2p6 |
| 3 | 4d55s2 ,5s25p2 , 4f76s2 , 3s23p3 , 3d14s2 , 5s25p5 |
| 4 | 5f67s2, 4s2 , 2s2p4 , 3s23p3 ,3d14s2 , 1s1 |
Задание8. Определите количество электронов на внешнем уровне в атомах:
F___________ Ca_________ Al___________
B__________ Se__________ C____________
Задание 9. Запишите определения:
Электронная оболочка - ___________________________________________________________________________________________________________________________________________________________________________________________________
Электронный слой - __________________________________________________________________________________________________________________________________
_________________________________________________________________
Электронное облако - __________________________________________________________________________________________________________________________________
Электронная формула - ___________________________________________________________________________________________________________________________________________________________________________________________________
Задание 10. Заполните пропуски в таблице:
| Элемент | I | Na | CI- | Са+2 | F | O-2 | B | Al+3 |
| е - | | | | | | | | |
| р + | | | | | | | | |
| n0 | | | | | | | | |
| Заряд ядра | | | | | | | | |
Тема 1.3. Строение вещества.
При изучении этой темы необходимо:
- разобраться в механизме образования ионной, ковалентной и металлической связей;
- усвоить свойства и разновидности ковалентной связи;
- изучить особенности свойств соединений с различными типами химических связей;
- приобрести навыки в составлении электронных схем образования молекул с различными типами химической связи.
Химическая связь - это взаимодействие атомов, осуществляемое путем обмена электронами.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов. Ковалентная связь бывает двух видов. Различают ковалентную полярную и неполярную связи.
Ковалентная полярная связь возникает между атомами неметаллов с разными значениями электроотрицательности. То есть между разными атомами неметаллов.
Ковалентная неполярная связь возникает между атомами неметаллов с одинаковыми значениями электроотрицательности. Такое условие выполняется, если связь возникает между атомами одного химического элемента-неметалла
Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения. Ионная связь образуется в солях, оксидах и гидроксидах металлов. И в других веществах, в которых атом металла связан с атомом неметалла (Li3N, CaH2).
Металлическая связь реализуется в простых веществах – металлах.
Задание 1. Запишите определение:
Ион- __________________________________________________________________________________________________________________________________
Ковалентная связь -__________________________________________________________________________________________________________________________________
Электроотрицательность -______________________________________________________________________________________________________________________________________________________________________________________________________
Металлическая связь-______________________________________________________________________________________________________________________________________________________________________________________________________
Химическая связь-______________________________________________________________________________________________________________________________________________________________________________________________________
Задание2.Определите тип химической связи и запишите схему ее образования для веществ с формулами:
K2O-______________________________________________________________________________________________________________________________________________________________________________________________________
H2S_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
N2____________________________________________________________________________________________________________________________________________________________________________________________________
Li3N__________________________________________________________________________________________________________________________________________________________________________________________________
Cl3N__________________________________________________________________________________________________________________________________________________________________________________________________
KBr___________________________________________________________________________________________________________________________________________________________________________________________________
AlF3___________________________________________________________________________________________________________________________________________________________________________________________________
Задание3.Металлическая связь имеет черты сходства с ионной связью. Сравните эти химические связи между собой.
______________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Задание4. По формулам веществ определите тип химической связи в них:
Na2O, Mn2O7, Zn(OH)2, Al(OH)3, Na2SO4, AlCl3, Са(Н2PO4)2, Na3PO4, SO2, Pb, NH4Cl, Mg, KClO3, O3, O2, Ca(HCO3)2
______________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Задание5. Составление формул веществ по валентности и определение степени окисления.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность – определяется номером группы (число химических связей в структурной формуле вещества).
Правила определения валентности элементов в соединениях
1.Валентность водорода принимают за I (единицу).
2.Кислород в своих соединениях проявляет валентность II.
3.Высшая валентность равна номеру группы Nгруппы (исключения, N, O, F - для этих элементов характерна только низшая валентность).
4.Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент,
т.е. 8 - Nгруппы
5.Определение валентности металлов (характерны валентности – постоянная и переменная)
| Металлы главных (А) подгрупп I(А), II(А), III(А) | Характерна высшая постоянная валентность. В = Nгруппы | Металл в формуле всегда занимает первую позицию |
| Металлы побочных (Б) подгрупп I(Б)-VIII(Б) | Характерна переменная валентность. В – указывается в названии вещества. Например, оксид марганца (VII), хлорид хрома (II). |
6.Определение валентности неметаллов (характерны валентности – высшая, низшая, переменная).
| Характерны высшая валентность В = N группы | Неметалл ставится в этом случае на первое место в формуле |
| Характерна низшая валентность 8 - N группы | Неметалл ставится в этом случае на второе место в формуле |
| Характерна переменная валентность. В – указывается в названии вещества. Например, оксид серы (IV), сульфид фосфора (III). | Неметалл ставится в этом случае на первое место в формуле |
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Правила определения степени окисления атома в ПСХЭ Д.И. Менделеева:
1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1)
2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода)
3. Металлы проявляют только +n положительную СО.
4. Фтор проявляет всегда СО равную -1 (F-1).
5. Для элементов главных подгрупп:
Высшая СО (+) = номеру группы Nгруппы
Низшая СО (-) = Nгруппы–8
Правила определения степени окисления атома в соединении:
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na0, P40, O20
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду.
Например, H+1N+5O3-2 : (+1)*1+(+5)*1+(-2)*3 = 0
[S+6O4 -2]2-: (+6)*1+(-2)*4 = -2
Пример. Определите степени окисления всех атомов в формуле серной кислоты H2SO4?
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
H+1SxO4-2
2. Составим и решим уравнение, согласно правилу (II):
(+1)*1+(х)*1+(-2)*4=0
Х=6 или (+6), следовательно, у серы CО +6, т.е. S+6
5.1.Приведите примеры соединений элементов с кислородом, в которых эти элементы имеют валентности.
Валентность: II IV VI I III V
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
5.2. Укажите валентности элементов в соединениях:
СF4 ,V2O5, ZnCl2, CuO ,Cu2O, Mg3P2,CaBr2, SO2 , As2O5 , NaN3, P2O5 , BaCl2 , PbO2 ,PbO, MoO.
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
5.3. Составьте формулы соединений, которые состоят из:
марганца (II) и кислорода; марганца (IV) и кислорода; хлора (VII) и кислорода; бария и кислорода.
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
5.4. Определите все возможные степени окисления для элементов (порядковый номер химического элемента: 11,20,49,17,34,50). Ответ обоснуйте.
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5.5. Определите степени окисления каждого элемента в соединениях:
N2, N2O, NO2, N2O3, NH3, NaNO3 , Ca(NO3)2 , BaMnO4 , Ba(MnO4)2, ZnSiO3 , Cu3(AsO4)2
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Тема 1.4. Вода. Растворы. Электролитическая диссоциация.
Теория электролитической диссоциации – один из важнейших разделов химии. Она дает возможность понять обменные процессы, протекающие в почвах, в природных и технических водах, а также механизм реакций, протекающих в растворах электролитов.
При изучении этой темы студент должен:
- знать определения и разновидности растворов;
- знать способы выражения концентрации растворов;
- знать расчеты той или иной концентрации растворенного вещества;
-получить понятие об электролитах, изучить основные положения теории электролитической диссоциации С.Аррениуса и дальнейшее развитие этой теории в работах И.А.Каблукова;
- иметь ясное представление о причинах электролитической диссоциации, степени и константе диссоциации, сильных и слабых электролитах;
- получить представление о механизме реакций обмена в растворах электролитов;
- овладеть техникой составления уравнений диссоциации различных электролитов и ионно-молекулярных уравнений реакций.
Задание1. Составление реакции ионного обмена.
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов.
Молекулярное уравнение реакции :
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2NO3- = 2Na+ + CO2↑ + H2O + 2NO3-
сокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
1.1.Подберите исходные вещества к сокращенному ионному уравнению реакции.
а)Fe2+ + 2OH– = Fe(OH)2
б)Zn2+ + CO32– = ZnCO3
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1.2.Для молекулярного уравнения расставьте коэффициенты и составьте полное и сокращенное ионное уравнение.
а)FeCl3 + NaOH = Fe(ОН)3 ↓ +NaCl
б)НCl + K2CO3 = KCl + Н2О ↓ + СО2↑
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1.3.Составьте молекулярное и полное ионное уравнение, соответствующее сокращенному:
а) Ag+ + Cl- = AgCl ↓
б) Zn(OH)2 ↓+ 2H+ = Zn2+ + 2H2O
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
1.4.Составьте молекулярное, полное и cокращённое ионное уравнение по схеме:
щелочь+ раств.соль = нераств.основание + раств.соль,
раств.соль+раств.соль=нераств.соль+раств.соль
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. В соответствии со своим вариантом решите задачи.
Массовая доля растворённого вещества (wрастворённого вещества) - это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора :
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%.
Типовой пример решения задач
Пример 1.Вычисление массовой доли растворенного вещества.
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
Дано:
m(KNO3 ) = 50 г,
m(Н2О) = 200 г
ω(KNO3) – ?
Решение:
ω(в-ва) = m(в-ва) / m(р-ра)*100 (%).
m(р-ра) = m(в-ва) + m(Н2О) = = 50 (г) + 200 (г) = 250 г.
ω(KNO3) = = 50 (г) / 250 (г) * 100 (%) = 20 %.
Ответ. ω(KNO3) = 20 %.
Пример2. Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор?
Дано:
m (сахара) = 0,5 г
w(cах.) = 0,01 (1 %)
V(Н2О) = ?
1) m (р-ра) В 100 г р-ра – 1 г сахара
х - 0,5 г сахара
2) m (H2O) = 50 – 0,5 = 45,5 г
45,5 г
3) V(Н2О) = ------------ = 45,5 мл
1 г/мл
Ответ: V(Н2О) = 45,5 мл
Пример 3.Какую массу соли и объем воды необходимо взять для приготовления 50 г 0,5 %-ного раствора.
Дано:
m (р-ра) = 50 г
w(соли) = 0,005
m (соли) = ?
V (H2O)=?
Решение:
m (соли) = 50 г • 0,005 = 0,25 г соли
m (H2O) = 50 г - 0,25 г = 49,75 г
V (H2O) = 49,75 г × 1 г/мл = 49,75л
Ответ: m (соли) = 0,25 г, V (H2O) = 49,75 л
| № варианта | номер задачи |
| 1 | 1,4,7,10,13 |
| 2 | 2,5,8,11,15 |
| 3 | 3,6,9,12,14 |
1.Смешали 0,4 г соли и 200 мл воды. Какова массовая доля соли в полученном растворе?
2.Смешали 20 г сахара и 250 мл воды. Какова массовая доля сахара в полученном растворе?
3.Смешали 5 г сахара и 150 мл воды. Какова массовая доля сахара в полученном растворе?
4.Смешали 2 г соли и 140 мл воды. Какова массовая доля соли в полученном растворе?
5.Смешали 0,5 г соли и 300 мл воды. Какова массовая доля соли в полученном растворе?
6.Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе?
7. Смешали нитрат натрия NaNO3 в количестве 0,1 моль с 0,5 л воды. Какова массовая доля нитрата натрия в полученном растворе?
8.Какую массу соли надо добавить к 200 мл воды, чтобы получить 3 %-ный раствор?
9.Какую массу соли надо добавить к 120 мл воды, чтобы получить 1 %-ный раствор?
10. Какую массу соли и объем воды необходимо взять для приготовления 60 г 1 %-ного раствора.
11.Какую массу соли и объем воды необходимо взять для приготовления 70 г 2 %-ного раствора.
12.Какую массу соли и объем воды необходимо взять для приготовления 40 г 0,4 %-ного раствора.
13.Какую массу соли и объем воды необходимо взять для приготовления 200 г раствора с массовой долей соли 0,06.
14.Какую массу соли и объем воды необходимо взять для приготовления 90г раствора с массовой долей соли 0,001.
15.Какую массу соли и объем воды необходимо взять для приготовления 60 г раствора с массовой долей соли 0,002.
РЕШЕНИЕ ЗАДАЧ:
Тема 1.6. Химические реакции.
Студенты должны знать и понимать важнейшие химические понятия: степень окисления, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие.
Уметь определять: степень окисления химических элементов, окислитель и восстановитель; объяснять зависимость скорости химической реакции и положения химического равновесия от различных факторов.
Студенты должны использовать приобретенные знания и умения в практической деятельности и повседневной жизни для определения возможности протекания химических превращений в различных условиях и оценки их последствий.
Задание1. В соответствии со своим вариантом решите задачи.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
υ гомогенной реакции определяется изменением количества вещества в единицу в единице объёма: υ =Δ n / Δt ∙V
где Δ n – изменение числа молей одного из веществ (чаще всего исходного, но может быть и продукта реакции), (моль);
Δt – интервал времени (с, мин);
V – объем газа или раствора (л)
Поскольку Δ n / V = ΔC (изменение концентрации), то
υ =Δ С / Δt ( моль/л∙ с)
υ гетерогенной реакции определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ.
υ =Δ n / Δt ∙ S
где Δ n – изменение количества вещества (реагента или продукта), (моль);
Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см2, м2)
Факторы, влияющие на скорость:
1. Природа реагирующих веществ: их состав, строение = энергия активации: чем меньше Еакт, тем больше υ;
2.Температура: при ↑ t на каждые 100 С, υ ↑ в 2-4 раза (правило Вант-Гоффа).
υ2 = υ1 ∙ γ Δt/10
3.Концентрация: чем больше, тем чаще происходят соударения и υ ↑.
При постоянной температуре для реакции mA + nB = C по закону действующих масс:
υ = k ∙ СAm ∙ CBn
где k – константа скорости;
С – концентрация (моль/л)
Типовой пример решения задач.
Задача1.Реакция протекает по уравнению А+В = 2С.
Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Решение:
Используем формулу для расчёта:
υ = ± ΔС/Δτ = ± (0,215-0,22) /(10-0) = 0,0005 моль/л ∙ с
Задача 2. Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
Решение:
По правилу Вант-Гоффа
υ=υ0·γ (t2-t1)/10
По условию задачи требуется определить υ/υ0:
υ/υ0=2 (70-30)/10 = 24 = 16
Задача 3. Реакция идет по уравнению А +2В → С.
Во сколько раз и как изменится скорость реакции, при увеличении концентрации вещества В в 3 раза?
Решение:
υ = k ∙ СAm ∙ CBn
υ = k ∙ СA ∙ CB2
υ1 = k ∙ а ∙ в2
υ2 = k ∙ а ∙ 3 в2
υ1/ υ2 = а ∙ в2 / а ∙ 9 в2 = 1/9
Ответ: увеличится в 9 раз.
| № варианта | номер задачи |
| 1 | 3, 4(а),6 |
| 2 | 1, 4(б),7 |
| 3 | 2, 4(в),8 |
| 4 | 5, 4(г),9 |
1.Скорость некоторой реакции про 20 0 С составляет 0,016 моль/л∙с ,а при температуре 500 С – 0,128 моль/л∙с. Определите температурный коэффициент данной реакции.
2.При температуре 350 С реакция заканчивается за 1ч 20 мин. Какое время потребуется для завершения реакции при 650 С, если ее температурный коэффициент равен 2?
3.Температурный коэффициент реакции равен 2. На сколько градусов надо уменьшить температуру, чтобы скорость реакции уменьшилась в 16 раз?
4.Как изменится скорость гомогенной химической реакции 2А + В = С , если
а) концентрацию вещества А увеличили в 2 раза, концентрация вещества В осталась прежней.
б) концентрацию вещества В увеличили в 2 раза, концентрация вещества А осталась прежней.
в) концентрацию вещества А увеличили в 3 раза, концентрацию вещества В уменьшили в 6 раз.
г) концентрацию вещества А увеличили в 2 раза, концентрацию вещества В уменьшили в 4 раза.
5.Начальная скорость реакции при 400 С составляет 0,54 моль/л∙мин. Вычислите скорость этой реакции при температуре 100 С, если ее температурный коэффициент равен 3.
6.Некоторая масса алюминия растворяется в избытке раствора щелочи при 400 С за 36 минут, а при 300 С – за 1ч 48 мин. Сколько времени потребуется для растворения той же массы алюминия при 600 С при прочих равных условиях?
7.При 100 С реакция протекает за 8 мин., а при 600 С – за 15 сек. Определите температурный коэффициент данной реакции.
8.Как изменится скорость реакции С(ТВ)+2Н2(г)= СН4(г) , если увеличить давление системы в 3 раза?
9.Во сколько раз необходимо увеличить концентрацию сероводорода, чтобы скорость реакции: 2Н2 S (г)+ SО2(г) = 2 S (ТВ)+2Н2О (Г) возросла в 9 раз?
РЕШЕНИЕ ЗАДАЧИ:
Тема 1.7. Металлы и неметаллы.
Металлы играют исключительно важную роль в машиностроении.
Механизмы, машины, многие мелиоративные конструкции изготавливают из металлов и их сплавов. Металлы обладают многими общими физическими и химическими свойствами.
При изучении этой темы студент должен:
- обратить внимание на особенности строения атомов металлов и их кристаллическую структуру, обуславливающую электро- и теплопроводность, твердость, плотность и другие свойства металлов;
- усвоить, что атомы металлов при химических реакциях только теряют электроны, поэтому атомы металлов являются только восстановителями, а положительно заряженные ионы металлов могут быть и восстановителями и окислителями;
- изучить отношение металлов к различным окислителям, а также зависимость свойств их соединений от степени окисления металлов.
Химия неметаллов по праву может быть названа химией жизни. Ведь все растения и животные на нашей планете состоят в своей основе из небольшого числа неметаллов (С, Н, О, N, S, P), различные сочетания которых составляют колоссальное многообразие органических соединений.
К неметаллам относятся 22 элемента, т.е. 20% от всех элементов периодической системы Д.И. Менделеева. Выделение их в отдельный класс связано с их резко отличительными свойствами.
Основным критерием неметаллических свойств является их высокая электроотрицательность.
Атомы неметаллов находятся в промежуточной степени окисления и потому проявляют как окислительные (способность принимать электроны), так и восстановительные (способность отдавать электроны) свойства (кроме кислорода и фтора). Хотя неметаллов и немного. Они довольно сильно отличаются друг от друга.
При изучении темы "Неметаллы" следует рассмотреть вопросы:
- неметаллы как окислители;
- неметаллы как восстановители;
- характеристика оксидов неметаллов и соответствующих им гидроксидов;
- водородные соединения неметаллов и их химические свойства;
- химия водорода и воды;
- химические свойства и применение. Роль в живой и неживой природе углерода, кремния, азота, фосфора, серы, фтора, хлора, брома, иода, кислорода и др.
Задание1.Составление сравнительной характеристики галогенов по плану:
- положение галогенов в ПСХЭ;
- электронное строение;
-физические и химические свойства;
- нахождение в природе;
-получение галогенов;
-применение
Работа с учебной, справочной литературой и Интернет – ресурсами.
ОТВЕТ:
РАЗДЕЛ 2. ОРГАНИЧЕСКАЯ ХИМИЯ
Тема 2.1. Основные понятия органической химии и теория строения органических соединений.
Студенты должны знать классификацию органических соединений, классификацию реакций в органической химии; номенклатуру органических реакций; виды формул, используемых в органической химии; основные положения теории химического строения органических соединений А.М.Бутлерова.
Уметь составлять схемы образования и разрыва связи;
-объяснять четырехвалентность углерода в органических соединениях;
-составлять полные и краткие структурные формулы углеводородов;
-составлять формулы изомеров и гомологов для предложенного вещества;
-демонстрировать уравнениями основные типы реакций в органической химии.
Задание1. Заполните таблицу. Выпишите формулы веществ:
CuSO4, HNO3, CH4, HCl, C6H6, C2H5OH, H2SO4, CH3COOH, CO2, Na2CO3, H2S, CaCO3, NaHCO3, C2H2, C2H4O2.
| Органические вещества: | Неорганические вещества: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание2. Закончите определения.
Органическая химия – это __________________________________________________________________
__________________________________________________________________
Изомерия – это_____________________________________________________
__________________________________________________________________
Изомеры – это______________________________________________________
__________________________________________________________________
Изомерия:
1.Структурная-____________________________________________________________________________________________________________________________________
2.Пространственная-
______________________________________________________________________________________________________________________________________________________________________________________________________
Тема 2.2. Углеводороды и их природные источники.
Студенты должны знать общие формулы углеводородов, строение, гомологический ряд, изомерию и номенклатуру, физические и химические свойства; получение, применение и механизмы реакций.
Уметь давать названия, составлять их формулы по названиям веществ; составлять структурные формулы гомологов и изомеров для предложенных веществ; составлять уравнения реакций.
Решать расчетные задачи на нахождение молекулярной формулы вещества по массовым долям элементов и по массе (объему) продуктов сгорания.
Задание1. Составление структурных формул гомологов и изомеров органических соединений.
1.1.Составление структурных формул гомологов и изомеров алканов.
Алканы -углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле CnH2n+2.
Гомологический ряд алканов
Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.

Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия.
Структурные изомеры отличаются друг от друга строением углеродного скелета.
Простейший алкан, для которого характерны структурные изомеры, — это бутан.

Основы номенклатуры
1.Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера.
Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б).
Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г).
Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (-СН3), затем этил (-СН2-СН3), пропил (-СН2-СН2-СН3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс —ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи.
Главная цепь называется как углеводород — член гомологического ряда метана ( метан СН4, этан С2Н6, пропан C3H8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан C7H16, октан C8H18, нонан С9Н20, декан С10Н22).

1. Закончите определения.
Углеводородами называют органические соединения,
___________________________________________________________
___________________________________________________________
___________________________________________________________
Алканами называют алифатические углеводороды_______________________________________________
___________________________________________________________
___________________________________________________________
Гомологический ряд – это
___________________________________________________________
___________________________________________________________
___________________________________________________________
___________________________________________________________
2. Из перечня формул, приведенных в задании, выберите формулы, соответствующие алканам:
С5Н12, С8Н16, С9Н16, С7Н8, С4Н8, С7Н14, С5Н8, С3Н8
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Составьте структурную формулу 2,3-диметилпентана.Напишите молекулярную формулу этого вещества и составьте структурные формулы трех-четырех его изомеров. Дайте им названия по номенклатуре IUPAC.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Для вещества, имеющего строение
CH3 – CH(СН3)– CH2 – CH(СН3) – CH3, составьте формулы 5 изомеров и двух гомологов. Дайте всем веществам названия по систематической номенклатуре.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Напишите формулы всех структурных изомеров гептана С7Н16 (девять формул изомеров).
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
6. Напишите структурные формулы алканов и назовите их по рациональной номенклатуре.
а) 2,2,3,4-тетраметилпентан
б) 2,3,6-триметил-3-этилгептан
в) 2,4-диметил-3-этилгексан
г) 3-изопропил-2,4-диметил-3-этилгексан
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1.2.Составление структурных формул гомологов и изомеров алкенов.
Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь.
Общая формула – CnH2n.
Гомологический ряд этена
Первый член ряда – этилен (этен) C2H4:

Неразветвленные алкены составляют гомологический ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета.
Простейший алкен, для которого характерны структурные изомеры, — это бутен:

Особым видом структурной изомерии является изомерия положения двойной связи:
![]()
Алкены изомерны циклоалканам (межклассовая изомерия), например:
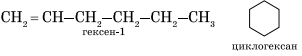
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму.
Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.
Номенклатура алкенов
Двойную связь обозначают с помощью суффикса -ен.
Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
CH3-CH2-CH2-CH=CH-CH3 гексен-2 (гексен-4)
 2-этилпентен-1
2-этилпентен-1
1.Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле.
В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например, правильное название соединения:
![]() 5-метилгексен-2
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
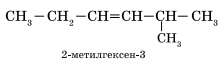
3. Формирование названия.
В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов.
Например:

1. Закончите определение.
Алкенами называют_______________________________________________
_________________________________________________________________
_________________________________________________________________
2. Дайте характеристику класса алкенов.
ХАРАКТЕРИСТИКА АЛКЕНОВ
1. Особенности строения:
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
____________________________________________________________________________________________________________________________________
__________________________________________________________________
__________________________________________________________________
2. Общая формула:
__________________________________________________________________
__________________________________________________________________
3.Номенклатура:___________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
4. Физические свойства. Перечислите свойства этилена.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
5. Способы получения. Запишите уравнения реакций:
а) промышленного; б) лабораторного способов получения этилена.
__________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
3.Как называются по систематической номенклатуре следующие алкены:

________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Напишите структурные формулы следующих алкенов.
а)2-метил-бутен-2
б)2,3-диметил-гексен-3
в)2-метил-пропен-1
г)2,5,5-триметил-гексен-2
д)2,2,6-триметил-4-этилгептен-3
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Напишите структурные формулы 7 изомеров разных видов для вещества состава С7Н14 и назовите их.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
6. Назовите алкены: СН2=СНСН2СН3, СН3СН=СНСН2СН3, (СН3)2С=СНСН3, СН2=СН(СН2)3СН3.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
7. Укажите вещества изомеры и вещества гомологи:
1) СН2=СН-СН2-СН3 4) СН3-СН2-СН2-СН3
2) СН2=СН2 5) СН3-СН-СН2-СН3
 3) СН3-СН2-СН2-СН2-СН3
3) СН3-СН2-СН2-СН2-СН3
СН3
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
8. Перечислите, какие типы изомерии характерны для соединения: гексен-2. Приведите формулы изомеров. Назовите.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
9.Напишите структурные формулы изомеров, которые могут быть у вещества С5Н10.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1.3. Составление структурных формул гомологов и изомеров алкадиенов.
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи.
Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах.
По этому признаку различают три типа двойных связей в диенах:
1) изолированные двойные связи разделены в цепи двумя или более s-связями: СН2=СН–СН2–СН=СН2
(разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах);
2) кумулированные двойные связи расположены у одного атома углерода:
СН2=С=СН2
(подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
3) сопряженные двойные связи разделены одной s-связью:
СН2=СН–СН=СН2.
Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи.
Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера.
Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания –диен.
Виды изомерии алкадиенов:
Структурная изомерия:
1) изомерия положения сопряженных двойных связей;
2) изомерия углеродного скелета;
3) межклассовая (изомерны алкинам)
Пространственная изомерия — диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.

1.Напишите структурные формулы следующих диеновых углеводородов:
а)2-метилбутадиен-1,3
б)3,3-диметилгесадиен-1,5
в)2,4-диметилпентадиен-2,4
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
2.Напишите структурные формулы изомеров диеновых углеводородов состава С5Н8. Назовите их.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
3. Напишите общую формулу гомологического ряда диеновых углеводородов. Какие виды изомерии характерны для диеновых углеводородов? Ответ иллюстрируйте структурными формулами веществ.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
4. Напишите структурную формулу для вещества
2 - метилбутадиена - 1,3 , составьте формулы изомеров и двух гомологов. Дайте всем веществам названия по систематической номенклатуре. Определите тип алкадиенов.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Какие виды алкадиенов вы знаете? Приведите примеры.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
6. Напишите формулы изомеров углеводорода С6Н10, относящегося к классу алкадиенов.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1.4. Составление структурных формул гомологов и изомеров алкинов.
Алкины -ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СпН2n-2.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена): С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Изомерия и номенклатура алкинов
Для алкинов характерна структурная изомерия:
изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
![]()
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:

Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:
Алкинам изомерны соединения некоторых других классов.
Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
1. Закончите определение.
Алкинами называют___________________________________________
________________________________________________________________
________________________________________________________________
_____________________________________________________________
2. Напишите общую формулу для алкинов:
_____________________________________________________________
3.Напишите все возможные формулы изомеров углеводорода состава С5Н8, относящихся к классу алкинов.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
4.Какие вещества относятся к углеводородам ряда ацетилена? Даны молекулярные формулы следующих углеводородов: С2Н2, С3Н4, С4Н6. Составьте их структурные формулы и подпишите названия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Составьте структурные формулы трёх алкинов, которые изомерны 2-метилбутадиену-1,3. Дайте им названия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
6. Напишите структурные формулы первых пяти веществ, составляющих гомологический ряд ацетиленовых углеводородов, включая изомеры бутина. Назовите их.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
7. Напишите структурные формулы четырёх изомеров, которые отвечают формуле С4Н6. Назовите все вещества.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
8.Напишите структурные формулы соединений:
а) 4-метилпентин-2; б) бутин-2; в) 3,3-диметилбутин-1; г) 2,5-диметил гексин-3.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. Решение задач на нахождение молекулярной формулы.
Необходимые теоретические сведения:
Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна: Мr(С2Н4) = 2 • 12 + 4 • 1 = 28
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества.
Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
| Массовая доля атома Э в веществе = | Атомная масса атома Э | • | число атомов Э в | молекуле |
| Аr(Э) • n | | |||
| —————— | | |||
| Mr (вещ.) | | |||
| Молекулярная масса вещества | | |||
Молекулярная и простейшая формула вещества.
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе Например, С6Н6 — истинная формула бензола..
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
Примеры
| Вещество | Молекулярная формула | Соотношение атомов | Простейшая формула |
| Этанол | С2Н6О | С:Н:О = 2:6:1 | С2Н6О |
| Бутен | С4Н8 | С:Н = 1:2 | СН2 |
| Уксусная кислота | С2Н4О2 | С:Н:О = 1:2:1 | СН2О |
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества.
Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У.
Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому: Dпо возд. = М(газа Х) / 29
Абсолютная плотность газа при нормальных условиях.
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда: ρ = М / Vm, а молярную массу газа можно найти, умножая плотность на молярный объём.
Общие формулы веществ разных классов
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
| Класс органических веществ | Общая молекулярная формула |
| Алканы | CnH2n+2 |
| Алкены | CnH2n |
| Алкины | CnH2n−2 |
| Диены | CnH2n−2 |
| Гомологи бензола | CnH2n−6 |
| Предельные одноатомные спирты | CnH2n+2O |
| Многоатомные спирты | CnH2n+2Ox |
| Предельные альдегиды | CnH2nO |
| Кетоны | CnH2nO |
| Фенолы | CnH2n−6O |
| Предельные карбоновые кислоты | CnH2nO2 |
| Сложные эфиры | CnH2nO2 |
| Амины | CnH2n+3N |
| Аминокислоты (предельные одноосновные) | CnH2n+1NO2 |
Типовой пример решения задач.
Задача 1. Относительная плотность углеводорода по водороду, имеющего состав w(C) = 85,7% ,w(Н) = 14,3%,равна 21. Выведите молекулярную формулу углеводорода.
Дано:
w (C) = 85,7 %
w(Н) = 14,3 %
D H2(CxHy)=21
CxHy = ?
Решение:
1.Определяем относительную молекулярную массу углеводорода, исходя из величины его относительной плотности.
Mr(CxHy) =D(H2)•Mr(H2)
Mr(CxHy) = 21•2 = 42
2.По формуле : n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M.
n(C)=(0,857· 42) / 12 = 3
n(H)=(0,143 · 42) / 1 = 6
Получаем x:y =3 : 6 ,следовательно, вещество C3H6.
3. Ответ: истинная формула углеводорода С3Н6.
Задача2. Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле :n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M.
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8.
Проверка, Mr(C3H8)= 44
Ответ: истинная формула углеводорода С3Н8
Задачи для самостоятельного решения
Задача 1. Найдите молекулярную формулу вещества, содержащего 92,3% углерода и 7,7% водорода. Плотность паров этого соединения по водороду равна 39. Определить название вещества. Построить структурную формулу.
Задача2. Найдите молекулярную формулу вещества, содержащего 75% углерода и 25% водорода. Плотность его паров по воздуху равна 0,55. Определить название вещества. Построить структурную формулу.
Задача3. Найдите молекулярную формулу вещества, содержащего 82,75% углерода и 17,25% водорода. Плотность его паров по воздуху равна 2. Определить название вещества. Построить структурную формулу.
Задача4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода. Определить название вещества. Построить структурную формулу.
РЕШЕНИЕ ЗАДАЧИ:
Тема 2.3 Кислородосодержащие органические соединения.
Студент должен знать основные классы кислородсодержащих органических соединений;
-физические и химические свойства кислородсодержащих органических соединений;
-получение и применение кислородсодержащих органических соединений.
Студент должен уметь решать задачи с участием кислородсодержащих органический соединений.
Задание 1.Составление структурных формул гомологов и изомеров органических веществ.
1.1 Составление структурных формул гомологов и изомеров спиртов.
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп - ОН), соединенных с углеводородным радикалом.
Классификация спиртов
По числу гидроксильных групп (атомности) спирты делятся на:
Одноатомные, например:
Двухатомные (гликоли), например:
Трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
Предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
Непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
Ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.
Например:
Существуют и полиатомные (многоатомные спирты), содержащие более трех гидроксильных групп в молекуле.
Например, простейший шестиатомный спирт гексаол (сорбит)
Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту, добавляют (родовой) суффикс-ол.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-,тетра- и т.д.-их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам:
Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан.
3. Число групп –ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2,4.
Название спирта: гептандиол-2,4
1. Закончите определения.
Спиртами называются _____________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Фенолы – это ___________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Функциональная группа -___________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Предельные одноатомные спирты-__________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Многоатомные спирты-___________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
2. Назовите вещества, структурные формулы которых приведены ниже:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
3. Сколько спиртов имеют молекулярную формулу С5Н12O? Составьте структурные формулы этих веществ и назовите их. Только ли спиртам может соответствовать эта формула? Составьте структурные формулы двух веществ, имеющих формулу С5Н12O и не относящихся к спиртам.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
4. Составьте структурные формулы четырех спиртов состава С5Н9(ОН)3 и дайте им названия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Составьте структурную формулу вещества 3,3-диметилпентанол-2. Напишите его молекулярную формулу и составьте структурные формулы трех его изомеров, один из которых принадлежит к другому классу органических веществ. Дайте им названия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
6. Составьте по одному изомеру спиртов молекулярной формулы С6Н13ОН с главной углеродной цепью: а) С6, б) С5, в) С4, г) С3
Назовите их.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
7. Исходя из общей формулы насыщенных одноатомных спиртов CnH2n+1OH,CnH2n+1OH,составьте формулы спиртов с числом атомов углерода в молекулах, равным 6 и 7.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
8. Назовите по номенклатуре ИЮПАК спирты, формулы которых:
C2H5OH
CH3−CH2−CH2OH
CH3−CH(OH)−CH3
CH3−CH2−CH2−CH2OH
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1.2.Составление структурных формул гомологов и изомеров альдегидов.
Альдегиды – органические вещества, молекулы которых содержат карбонильную группу С=O, соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид:
В простейшем альдегиде – формальдегиде роль углеводородного радикала играет другой атом водорода:
Карбонильную группу, связанную с атомом водорода, часто называют альдегидной:
Кетоны – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне – ацетоне – карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия альдегидов и кетонов
В зависимости от строения углеводородного радикала, связного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль.
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы.
Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи).
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов также и изомерия положения карбонильной группы.
Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
1.Продолжите определение:
Альдегиды – это органические вещества, в молекулах которых_____________________________________________________________________________________________________________________________
__________________________________________________________________
2. Какие вещества называются кетонами?
______________________________________________________________________________________________________________________________________________________________________________________________________
3.Составьте как можно больше возможных изомеров вещества, брутто-формула которого С4Н8О.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
4. Назовите вещества, формулы которых:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________5. Составьте формулу и название альдегида с n = 3. Имеет ли он изомеры?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________6.. Составьте структурные формулы: 3-метилбутаналя, 2,4-диметилпентанона-3. Приведите формулы одного гомолога и одного изомера каждого вида для обоих веществ. Назовите все вещества. Укажите вид изомерии.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1.3Составление структурных формул гомологов и изомеров карбоновых кислот.
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Классификация карбоновых кислот
По числу карбоксильных групп кислоты подразделяются на:
-одноосновные (монокарбоновые) СН3СООН (уксусная);
-многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН (малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CH-COOH);
ароматические (C6H5COOH).
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса —овая и слова кислота:
HCOOH — метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота.
Изомерия карбоновых кислот
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
1. Что такое карбоновые кислоты?
________________________________________________________________
______________________________________________________________
______________________________________________________________
2.Какие две кислоты имеют общую молекулярную формулу С4Н8O2? Назовите их.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
3. Сколько изомерных карбоновых кислот соответствует формуле С5Н10О2? Напишите их структурные формулы и назовите эти вещества.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
4.Из веществ, формулы которых приведены, выпишите отдельно:
а) гомологи; б) изомеры.
Под формулами подпишите названия веществ:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Напишите структурные формулы следующих кислот:
а) 2-метилпропановая кислота; б) 2,3,4-трихлорбутановая кислота; в) 3,4-диметилгептановая кислота.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
6. Назовите вещества, формулы которых:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. Решение задач.
Задача1.Установить молекулярную формулу предельного трехатомного спирта, массовая доля водорода в котором равна 10%. Составить структурную формулу, определить название вещества.
Задача2. Установить молекулярную формулу диена, относительная плотность паров которого по воздуху 1,862. Составить структурную формулу, определить название вещества.
Задача3. Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93. Составить структурную формулу, определить название вещества.
Задача4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
Задание5.Этиловый спирт содержит 52,18% углерода, 13,04% водорода, 34,78% кислорода. Плотность паров спирта по водороду 23. Определить формулу этилового спирта. Составить структурную формулу.
Задача 6. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
РЕШЕНИЕ ЗАДАЧИ:












