Просмотр содержимого документа
«Самостоятельная работа: "Углеводороды"»
1 .Алканы - это
.Алканы - это


Валентный угол в алканах длина связи

Структурная формула пропана (гибридизация атомов углерода)
2 . Структурная формула циклопентана ,количество сигма-связей , пи-связей
. Структурная формула циклопентана ,количество сигма-связей , пи-связей


3 . Пи – связь - это
. Пи – связь - это

4. Гидрирование – это

Пример:
5. Вычислить объем водорода (н.у), полученного при взаимодействии 0,1 моль этанола с избытком металлического натрия.
6. Написать следующие уравнения реакций:
С7Н16 + О2 =
С2Н4 + Н2 =
С5Н12 + О2 =
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО → С2Н6 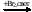 Х1 → СН3СН2СН2СН3 → бутадиен-1,3
Х1 → СН3СН2СН2СН3 → бутадиен-1,3 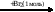 Х2
Х2
Укажите условия протекания реакций.
8. Относительная плотность паров алкадиена по кислороду равна 2,125. Установите молекулярную формулу алкадиена.
9. Дописать уравнение. Методом электронного баланса уравнять:
Пропен-1 + KMnO4 + H2SO4 =
10. Алкен массой 12,6 г может присоединить 6,72 л (н.у.) водорода. Установите молекулярную формулу алкена.
1 .Алканы - это
.Алканы - это


Валентный угол в алканах длина связи

Структурная формула пропана (гибридизация атомов углерода)
2 . Структурная формула циклопентана ,количество сигма-связей , пи-связей
. Структурная формула циклопентана ,количество сигма-связей , пи-связей


3 . Пи – связь - это
. Пи – связь - это

4. Гидрирование – это

Пример:
5. Вычислить объем водорода (н.у), полученного при взаимодействии 0,1 моль этанола с избытком металлического натрия.
6. Написать следующие уравнения реакций:
С7Н16 + О2 =
С2Н4 + Н2 =
С5Н12 + О2 =
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО → С2Н6 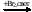 Х1 → СН3СН2СН2СН3 → бутадиен-1,3
Х1 → СН3СН2СН2СН3 → бутадиен-1,3 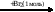 Х2
Х2
Укажите условия протекания реакций.
8. Относительная плотность паров алкадиена по кислороду равна 2,125. Установите молекулярную формулу алкадиена.
9. Дописать уравнение. Методом электронного баланса уравнять:
Пропен-1 + KMnO4 + H2SO4 =
10. Алкен массой 12,6 г может присоединить 6,72 л (н.у.) водорода. Установите молекулярную формулу алкена.







 .Алканы - это
.Алканы - это


 . Структурная формула циклопентана ,количество сигма-связей , пи-связей
. Структурная формула циклопентана ,количество сигма-связей , пи-связей

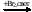 Х1 → СН3СН2СН2СН3 → бутадиен-1,3
Х1 → СН3СН2СН2СН3 → бутадиен-1,3 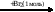 Х2
Х2









