Просмотр содержимого документа
«Сульфат меди.Медный купорос»

Исследование взаимодействия раствора сульфат меди (II) c металлами
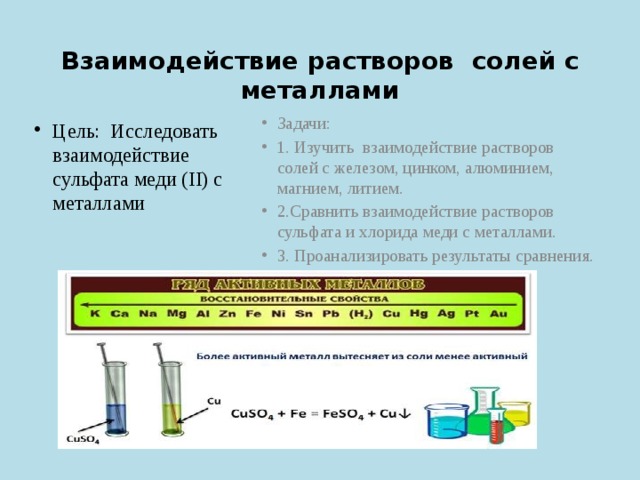
Взаимодействие растворов солей с металлами
- Задачи:
- 1. Изучить взаимодействие растворов солей с железом, цинком, алюминием, магнием, литием.
- 2.Сравнить взаимодействие растворов сульфата и хлорида меди с металлами.
- 3. Проанализировать результаты сравнения.
- Цель: Исследовать взаимодействие сульфата меди (II) с металлами

Гипотеза:
Согласно электрохимическому ряду напряжений металлов,
более активные металлы вытесняют менее активные из растворов их солей

Ход работы
- Взаимодействие раствора сульфата меди (II) с металлами
- Взаимодействие раствора хлорида меди (II) с металлами

Железо
Fe + CuSO 4 → FeSO 4 + Cu
Реакция значительно ускорилась за счет подкисления серной кислотой

Цинк
Zn + CuSO 4 → ZnSO 4 + Cu
С цинковой пылью реакция шла гораздо быстрее

Алюминий
Алюминий реагирует с раствором соли сульфата меди (II) только при подкислении, за счет удаления оксидной пленки с поверхности алюминия
2 Al + 3 CuSO 4 → Al 2 (SO 4 ) 3 + 3Cu

Магний
Наблюдали изменение окраски, образование медного осадка не наблюдалось. Раствор приобрел зеленоватый оттенок
![Взаимодействие раствора сульфата меди (II) с магнием 2CuSO 4 + 2HOH ↔ [Cu(OH)] 2 SO 4 + H 2 SO 4 Cu 2+ + HOH ↔ CuOH + + H + зеленый Mg + H 2 SO 4 → MgSO 4 + H 2 + Q Равновесие гидролиза смещается в сторону образования ионов водорода и основной соли меди, которая имеет зеленый цвет. Гидролиз становится необратимым, в результате выпадает осадок гидроксида меди (II), который за счет выделяющейся теплоты разлагается Cu(OH) 2 → CuO + H 2 O черный](https://fsd.multiurok.ru/html/2019/03/25/s_5c987884c5372/img8.jpg)
Взаимодействие раствора сульфата меди (II) с магнием
2CuSO 4 + 2HOH ↔ [Cu(OH)] 2 SO 4 + H 2 SO 4
Cu 2+ + HOH ↔ CuOH + + H +
зеленый
Mg + H 2 SO 4 → MgSO 4 + H 2 + Q
Равновесие гидролиза смещается в сторону образования ионов водорода и основной соли меди, которая имеет зеленый цвет. Гидролиз становится необратимым, в результате выпадает осадок гидроксида меди (II), который за счет выделяющейся теплоты разлагается
Cu(OH) 2 → CuO + H 2 O
черный

Литий
2Li + H 2 O → 2LiOH + H 2 + Q
CuSO 4 + 2LiOH → Cu(OH) 2 + Li 2 SO 4
Cu(OH) 2 → CuO + H 2 O
Выделяется газ, выпадает черный осадок. Медь не образуется

Результаты
С раствором хлорида меди (II) металлы реагировали активнее в связи с тем, что хлорид-анион является активатором коррозии – растворяет оксидную пленку металлов

Выводы:
- Данное учебное исследование можно использовать в 11 классе в темах «Металлы», «Гидролиз солей», «ОВР»














![Взаимодействие раствора сульфата меди (II) с магнием 2CuSO 4 + 2HOH ↔ [Cu(OH)] 2 SO 4 + H 2 SO 4 Cu 2+ + HOH ↔ CuOH + + H + зеленый Mg + H 2 SO 4 → MgSO 4 + H 2 + Q Равновесие гидролиза смещается в сторону образования ионов водорода и основной соли меди, которая имеет зеленый цвет. Гидролиз становится необратимым, в результате выпадает осадок гидроксида меди (II), который за счет выделяющейся теплоты разлагается Cu(OH) 2 → CuO + H 2 O черный](https://fsd.multiurok.ru/html/2019/03/25/s_5c987884c5372/img8.jpg)













