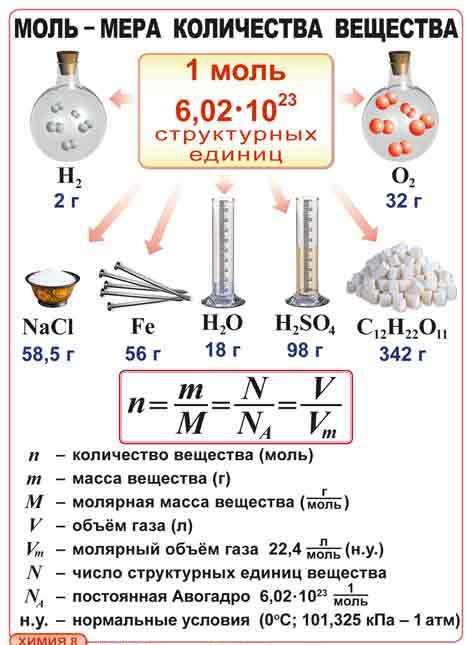
| 3.Моль, молярная масса В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль. Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро 
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С: 
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества. Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 1023молекул. Следовательно, количество вещества в этом образце составляет: 
В общем виде: 
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро). Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом: Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16 M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул. Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле: 
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей: 
или найти массу вещества по числу молей и молярной массе: m = ν • M Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m. 
Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого. Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда: m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г. Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе. 
n(CH4) = n(С2Н6), но m(CH4) (С2Н6)Вычисление ν используется практически в каждой расчетной задаче. Образцы решения задач | Задача №1. Вычислите массу (г) железа, взятого количеством вещества 0, 5 моль? Дано: ν(Fe)=0,5 моль Найти: m(Fe) — ? Решение: m = M · ν M(Fe) = Ar(Fe) = 56 г/моль (Из периодической системы) m (Fe) = 56 г/моль · 0,5 моль = 28 г Ответ: m (Fe) =28 г | | Задача №2. Вычислите массу (г) 12,04 · 1023 молекул оксида кальцияCaО? Дано: N(CaO)= 12,04 * 1023 молекул Найти: m(СaO) — ? Решение: m = M · ν, ν= N/Na, следовательно, формула для расчёта m = M · (N/Na) M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г/моль m= 56 г/моль · (12,04 * 1023/6.02 · 1023 1/моль) = 112 г Ответ: m= 112 г | |
|
|