ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
КАМЧАТСКОГО КРАЯ
«КАМЧАТСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ЛЕКЦИИ
По дисциплине «Химия»
По теме: «Дисперсные системы. Растворы.
Процессы, происходящие в растворах»
Для специальности: 31.02.03 Лабораторная диагностика
Уровень подготовки базовый
| Рассмотрена на заседании цикловой комиссии общепрофессиональных дисциплин Протокол № ____ «__» ___________ 2025 г. Председатель ЦМК ____________/ Г.В. Яковишин | СОГЛАСОВАНО Заместитель директора по УПР __________/Н.В. Вострикова «___» ______ 2025 г. |
Составитель:
Потапова Елена Витальевна – преподаватель высшей квалификационной категории ГБПОУ КК «Камчатский медицинский колледж»
Петропавловск-Камчатский, 2025
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка лекции по теме «Дисперсные системы. Растворы. Процессы, происходящие в растворах» разработана в соответствии с ФГОС СПО специальности 31.02.03 «Лабораторная диагностика» и рассчитано на одно занятие (2 часа) в соответствии с календарно-тематическим планом программы учебной дисциплины.
Данная тема входит в изучение общеобразовательной дисциплины профильного уровня «Химия». Преподавание реализовано с учётом профессиональной направленности обучающихся по специальности 34.02.01 «Сестринское дело».
Актуальность темы:
В природе чаще всего встречаются смеси различных веществ. Большинство веществ, находящихся в окружающем нас мире находится в раздробленном (диспергированном) состоянии, то есть состоит из дисперсных систем. Дисперсные системы широко распространены в природе и участвуют во многих технологических процессах. Дисперсные системы активно применяют в медицине: это в первую очередь коллоидные растворы, аэрозоли, кремы, мази. Биохимические процессы в организме протекают также в дисперсных системах. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Поэтому будущему медицинскому работнику необходимо иметь представление о дисперсных системах и их классификации.
Тип учебного занятия: лекция
Цели занятия:
Учебные:
дать представление о дисперсных системах и их классификации;
показать значение дисперсных систем в природе и жизни человека, относительность деления растворов на истинные и коллоидные;
дать понятие о свертывании крови как биологическом синерезисе, его значении.
Развивающие:
способствовать развитию клинического и логического мышления, медицинской наблюдательности;
способствовать развитию умения сравнивать и выделять различия;
развивать познавательную и поисковую активность;
Воспитательная:
повышение интереса к предмету, формирование положительного отношения к образовательному процессу, к самостоятельной работе;
содействие личностному самоопределению обучающихся в отношении их будущей профессии
Обучающийся должен обладать общими компетенциями, включающими в себя способность:
ОК 01. Выбирать способы решения задач профессиональной деятельности применительно к различным контекстам;
ОК 04. Эффективно взаимодействовать и работать в коллективе и команде;
ОК 05. Осуществлять устную и письменную коммуникацию на государственном языке Российской Федерации с учетом особенностей социального и культурного контекста;
ОК 08. Использовать средства физической культуры для сохранения и укрепления здоровья в процессе профессиональной деятельности и поддержания необходимого уровня физической подготовленности.
Занятие способствует формированию у обучающихся следующих личностных результатов:
ЛР.12 Способный искать нужные источники информации и данные, воспринимать, анализировать, запоминать и передавать информацию с использованием цифровых средств; предупреждающий собственное и чужое деструктивное поведение в сетевом пространстве.
ЛР.13 Проявляющий навыки сотрудничества со сверстниками, детьми младшего возраста, взрослыми в образовательной, общественно полезной, учебно-исследовательской, проектной деятельности.
ЛР.14 Развивающий творческие способности, способный креативно мыслить.
ЛР.21 Соблюдающий и пропагандирующий правила здорового и безопасного образа жизни, спорта; предупреждающий либо преодолевающий зависимости от алкоголя, табака, психоактивных веществ, азартных игр и т.д.
ЛР.26 Готов к выполнению поставленной задачи, направленной на помощь пациенту в любой ситуации.
Обучающийся (базовый уровень) должен обладать профессиональными компетенциями, соответствующими видам деятельности:
ПК 1.1. Организовывать рабочее место.
ПК 1.2. Обеспечивать безопасную окружающую среду.
ПК 3.2. Пропагандировать здоровый образ жизни.
После изучения данной темы обучающийся должен:
уметь:
- называть: дисперсные системы;
– характеризовать: общие химические свойства металлов, неметаллов;
–объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева;
– называть: изученные вещества;
– определять: принадлежность веществ к разным классам неорганических соединений; типы реакций в неорганической химии
– характеризовать: общие химические свойства основных классов неорганических соединений;
– объяснять: зависимость свойств дисперсных систем от их состава и строения.
знать:
- Классификацию дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, а также по размеру их частиц.
- Грубодисперсные системы: эмульсии и суспензии.
- Тонкодисперсные системы: коллоидные (золи и гели) и истинные (молекулярные, молекулярно-ионные и ионные).
- Эффект Тиндаля. Коагуляцию в коллоидных растворах. Синерезис в гелях.
- Значение дисперсных систем в живой и неживой природе и практической жизни человека.
- Биологические, медицинские и технологические золи.
- Свертывание крови как биологический синерезис, его значение.
Междисциплинарные связи:
ОДП.03 Биология
ОП.01 Анатомия и физиология человека
ОП.06 Фармакология
ПМ.01 Проведение мероприятий по профилактике инфекций, связанных с оказанием медицинской помощи.
Методы организации и осуществления учебно-познавательной деятельности:
словесный (лекция, объяснение, фронтальная беседа);
наглядный (демонстрация таблиц, мультимедийной презентации, видеофрагментов)
Место проведения лекции: учебная аудитория ГБПОУ КК «Камчатский медицинский колледж».
Материально-техническое оснащение занятия:
СТРУКТУРНО-ЛОГИЧЕСКАЯ СХЕМА ЗАНЯТИЯ
| Этапы занятия | Время | Действия преподавателя | Действия обучающихся |
| Организационный момент | 2 | Приветствует обучающихся, осуществляет контроль присутствия на занятии, готовности к занятию учебного кабинета и обучающихся, оценивает внешний вид обучающихся. | Занимают рабочие места, приветствуют преподавателя, слушают, отвечают |
| Сообщение темы, определение целей, плана проведения занятий. | 3 | Сообщает тему, задает вопросы, побуждающие к обсуждению актуальности изучаемой темы. Организует обсуждение. | Записывают тему, участвуют в обсуждении. |
| Актуализация опорных знаний | 5 | Проводит опрос | Отвечают на вопросы |
| Изучение нового материала | 30 | Объясняет новый материал | Конспектируют материал лекции, составляют схему |
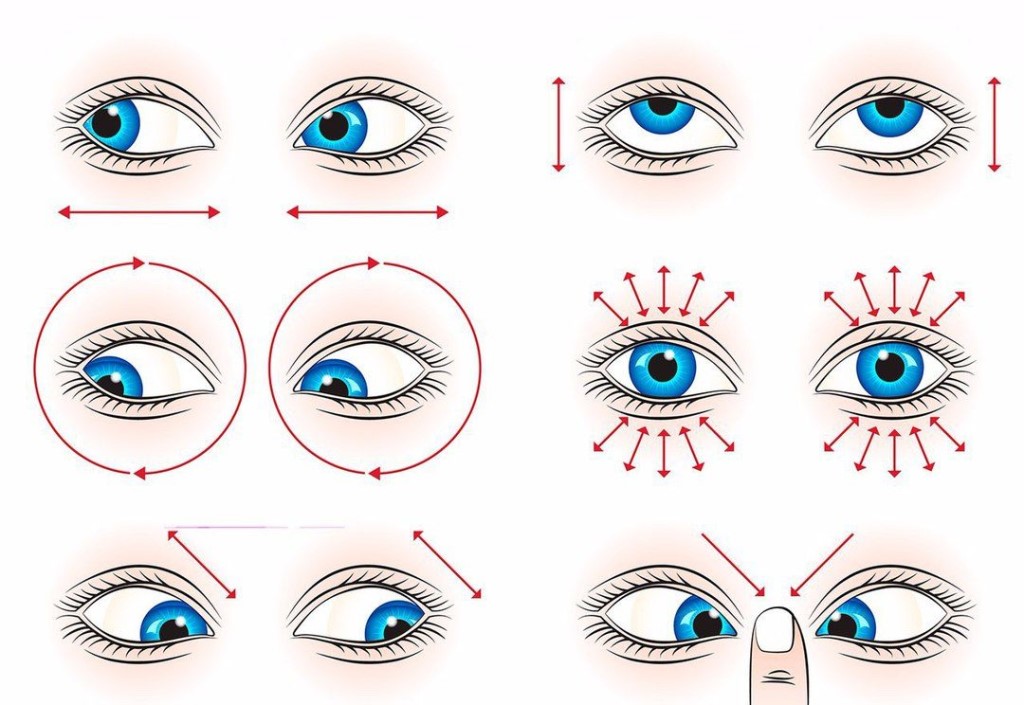
| Физкультминутка | 5 | Демонстрирует студентам технику выполнения упражнений (Приложение №А) | Выполняют упражнения |
| Просмотр видеофрагмента | 15 | Видеоурок «Дисперсные системы» (РЭШ, https://resh.edu.ru/subject/lesson/4939/main/151137/ | Конспектируют, смотрят. Разбирают задачи. |
| Решение задач | 20 | Объясняет задание | Выполняют в тетради |
| Рефлексия | 5 | Проводит рефлексию | Отвечают на вопросы: Я не знал, но теперь знаю… |
| Сообщение домашнего задания. Выставление оценок. | 5 | Объясняет выполнение домашнего задания: 1) Эксперимент по получению дисперсных систем. 2) Учить материал лекции | Записывают |
Ход занятия
Основные понятия: дисперсная система, грубодисперсная система, тонкодисперсная система; взвеси, эмульсия, суспензия, аэрозоль, коллоидная система; золь, гель, истинные растворы, эффект Тиндаля, дисперсионная среда, дисперсная фаза, чистое вещество, смесь, синерезис, мицелла.
Оборудование: препараты бытовой химии, аэрозоли; гели косметические, медицинские, пищевые; мази, пасты; чугун, сталь и изделия из них; образцы горных пород, минералы; вода, растительное масло (для демонстрации эмульсий); желатин, вода (для демонстрации желе); NaCl, бензол, одеколон, минеральная вода (для демонстрации относительности деления растворов на истинные и коллоидные: Na2SiO3, HCl, FeCl3, NH3 (р-ры); АlСl3(тв.); HCl, спирт.
Актуализация знаний:
Дайте определение понятию «вещество» (Вещество – это одна из форм материи, представляющая собой совокупность частиц (атомов, молекул или ионов), характеризующаяся при определённых условиях одними и теми же индивидуальными свойствами.).
Какие вещества бывают? (Вещества делят на простые и сложные
Простое вещество — это химическое вещество, состоящее исключительно из атомов одного химического элемента. Сложными называют вещества, состоящие из атомов разных химических элементов.)
Перечислите агрегатные состояния вещества (твердое, жидкое, газообразное)
Что такое соль? (Соль — это сложное соединение состоящая из катионов метала и кислотного остатка)
Что такое кислота? (Кислота — это сложное соединение состоящая из катиона водорода и кислотного остатка)
Состояние чистого вещества описывается так: твердое, жидкое, газообразное. Однако абсолютно чистых веществ в природе не существует. Даже незначительное количество примесей может существенно влиять на свойства вещества — температуру плавления, кипения, электро- и теплопроводимость, реакционную способность.
Получение чистых веществ — важнейшая задача современной химии: только чистое вещество проявляет свои индивидуальные свойства качественно.
Существует следующая маркировка веществ:
| Маркировка | Степень чистоты | Содержание примесей | Области применения |
| «Ч» | Чистое | 2 · 10-5—1,0 · 10-5 % | В промышленности |
| «ЧДА» | Чистое для анализа | 1,0 · 10-5—0,4 · 10-5 | Для анализа технических продуктов |
| «ХЧ» | Химически чистое вещество | 5,0 · 10-6—0,0 · 10-6 | В научно-исследовательских и лабораторных работах |
| «ОСЧ» | Особенно чистое вещество | 1,0 · 10-10—1,0 · 10-14 | В электронике, полупроводниках |
Однако в природе, и в жизни человека встречаются не отдельные вещества, а их системы.
Важнейшими из них являются дисперсные, т.е. гетерогенные системы — состоящие из двух или более фаз с сильно развитой поверхностью раздела между ними.
Фаза— часть системы, отделенная от других ее частей поверхностью раздела.
Одна из фаз раздроблена на мелкие частицы и равномерно распределена в объеме другого вещества — это дисперсная фаза, а другая — сплошная фаза — дисперсионная среда.
В зависимости от сочетания агрегатного состояния дисперсной фазы и дисперсионной среды можно выделить 9 видов таких систем.
Классификация дисперсных систем
| Дисперсионная среда | Дисперсная фаза |
| газ | жидкость | твердое вещество |
| Газ | Воздух, природный газ | Аэрозоль, туман, попутный нефтяной газ | Аэрозоль (смог), дым, пыль |
| Жидкость | Шипучие напитки, пены, газовые эмульсии | Эмульсии (плазма крови, лимфа, пищеварительный сок, цитоплазма) | Строительные растворы, суспензии, золи (кисель, сель, клей, ил) |
| Твердые в-ва | Порошки, пористое тело, почва, текстильные ткани, наст снежный | Медицинские и косметические средства (мазь, тушь, помада), влажная почва | Минералы, сплавы, горные породы, цветное стекло |
Классификация дисперсных систем по величине частиц
| Дисперсная система | Размер частиц, м |
| 1) Тонкодисперсная система а) Истинные растворы б) Коллоидные системы (золь, гель) |
≤ 10-9 ≥ 10-9 ≤ 10-7 |
| 2) Грубодисперсная система (эмульсии, суспензии) | ≥ 10-7 |
Дисперсные системы классифицируются по степени взаимодействия дисперсной фазы с дисперсионной средой:
а) взаимодействие слабое: если среда водная — система гидрофобная — галогениды серебра; система лиофобная, если среда не водная.
б) взаимодействие сильное: если среда водная — гидрофильные системы, они самопроизвольно образуются, имеют высокую дисперсность.
Если среда не водная — то лиофильные системы, они термодинамически устойчивы и не разрушаются со временем.
Для дисперсных систем важен признак гетерогенности.
Например, сплавы железа: чугун и стали — отличаются именно по этому признаку. Процентное содержание углерода в них разное. В чугуне более 0,02 %, а встали менее 0,02 %.
Избыток углерода в чугуне становится твердым раствором, выделяется в виде пластинок графита. Вследствие этого чугун хрупок, в отличие от стали: сталь — это твердый гомогенный раствор углерода в железе. Сталь можно прокатывать, ковать, штамповать, волочить. На изломе чугуна можно заметить серый цвет графита. При затвердевании чугун не сжимается, как большинство металлов, а расширяется, как вода и лед. Используется чугун только для литья.
Таким образом, чугун — дисперсная гетерогенная система.
Сталь — дисперсная гомогенная система. Это твердый, истинный раствор.
Некоторые дисперсные системы:
Грубодисперсные: размер частиц ≥ 100 нм.
Это непрозрачные системы, частицы видны невооруженным глазом, отстаиваются, у жидкостей видна граница раздела;
а) эмульсии: синтомициновая эмульсия — лекарство; молоко; лимфа (природная), водоэмульсионная краска, битумный материал, строительные эмульсии.
На основе эмульсий получают полимеры: каучук, полистирол, поливинил, ацетат.
б) суспензии: дисперсная фаза твердая, нерастворимая в дисперсионной среде она жидкая.
Пример: «известковое молоко» — Са(ОН)2 и Н2О — строительный раствор; или речной и морской ; мел и Н2О (показать).
Суспензии чаше называют взвесями.
Грубодисперсные системы очень высокой дисперсной фазы называются пастами: зубные пасты (демонстрация — пасты, помады, тушь).
2.Коллоидные системы относятся к тонкодисперсным и имеют размер частиц от 100 до 1 нм.
Коллоидная частица называется мицеллой. Она имеет довольно сложное строение, состоящее из частицы гранулы и диффузного слоя. Гранулы могут иметь и положительный, и отрицательный заряд. Это зависит от избытка одного из реагентов. В случае образования коллоидного раствора из AgNO3 и NaCl, при избытке AgNО3 гранула имеет положительный заряд, при избытке NaCl гранула отрицательно заряжена.
Коллоидные системы хорошо распространены в природе.
Почва, глина, природные воды, воздух, облака, пыль, дым, многие минералы и даже драгоценные камни — это все коллоидные системы.
Коллоидные системы имеют большое значение в биологии, медицине. Все пищевые продукты — хлеб, молоко, масло — коллоидные системы.
С химической точки зрения организм в целом — это сложнейшая совокупность многих коллоидных систем, включая жидкие коллоиды и гели.
Кровь, плазма, лимфа, спинномозговая жидкость — системы, в которых белки, холестерин, гликоген и другие вещества находятся в коллоидном состоянии.
А почему коллоидным состояниям природа отдает предпочтение?
В коллоидном состоянии вещество имеет большую поверхность раздела между фазами, а это способствует лучшему протеканию важнейшего жизненного процесса — обмену веществ.
К примеру: если взять кубик вещества с ребром 10-2 м, его поверхность составляет 6 · 10-4 м2. Если раздробить вещество до размера коллоидной частицы 10-7—10-9 м, то суммарная площадь 1 м3 вещества уже составит сотни и тысячи квадратных метров. А скорость реакций, как известно, зависит от поверхности соприкосновения.
Коллоидные системы подразделяются на золи и гели.
Золи — коллоидные растворы с изолированными друг от друга частицами фазы и дисперсионной средой.
Пример: кремниевая кислота, растворимое стекло Na2SiО3
Демонстрация эксперимента:
а) 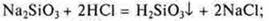
б) гидролиз АlСl3 в горячей воде дает золь.
Гели — коллоидная система с соприкасающимися частицами фазы и дисперсионной среды. Это студенистые тела. Частицы дисперсной фазы соединяются между собой в рыхлую пространственную сетку, в ячейках которой содержится дисперсионная фаза (среда). Эта система лишена текучести.
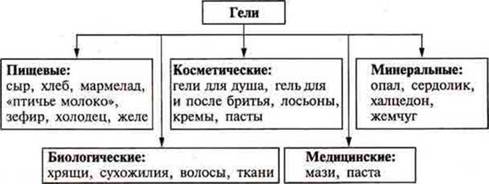
Демонстрация: желатин + Н2O, крахмальный клейстер.
Для гелей характерна реакция синирезиса — самопроизвольного выделения жидкости.
Уплотняется структура геля, уменьшается объем. Явление синирезиса определяет срок годности продукта: пищевого, косметического, медицинского.
Свертывание крови — это тоже синирезис. Идет превращение растворимого белка крови — фибриногена — в нерастворимый — фибрин. Это защитная реакция организма.
Золи могут подвергаться коагуляции. Это объединение коллоидных частиц в более крупные агрегаты и выпадение их в осадок под влиянием температуры, изменения концентрации, механического воздействия, облучения, добавления электролита, образование геля.
Внешне коллоидные растворы бывают полупрозрачными и прозрачными растворами. Их можно не отличить от тонкодисперсных систем — истинных растворов, где размеры частиц фазы ≤ 1 нм. Для коллоидных растворов характерен эффект Тиндаля.
При пропускании луча света через коллоидный раствор крупные частицы отражают свет от своей поверхности, в сосуде виден светящийся конус. Такого конуса не наблюдается при пропускании луча света через истинный раствор, тонкодисперсную систему.
Коллоидные растворы — гомогенные системы, состоящие из двух и более веществ одной фазы.
Одно вещество распределено в другом в виде атомов, молекул, ионов. Растворитель, дисперсионная среда, агрегатное состояние не изменяется при образовании дисперсной системы.
Пример: растворитель — дисперсионная среда вода; в водных растворах солей, кислот, щелочей, сахара, углекислого газа.
Воздух — это раствор кислорода, азота, благородных газов, углекислого газа.
Столовый уксус 9 % — вода растворитель.
Уксусная эссенция 80 % — растворитель уксусная кислота.
Растворы подразделяются на:
— молекулярные — водные растворы неэлектролитов (спиртовой раствор йода, растворы сахарозы, глюкозы);
— молекулярно-ионные — растворы слабых электролитов (азотистая кислота, угольная кислота, аммиачная вода);
— ионные растворы — растворы электролитов.
Растворение — физико-химический процесс, т.к. наряду с образованием обычной механической смеси веществ идет и процесс взаимодействия частиц растворенного вещества с растворителями.
К таким заключениям в 1887 году пришел Д. И. Менделеев. Точное определение раствора:
Раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Эксперимент.

Идет гидратация катиона меди (II) молекулами воды. Гидратированные ионы придают раствору голубой цвет, выделяется тепло — признак химической реакции.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ
1. Приготовление насыщенного раствора
Условие задачи: Для приготовления насыщенного раствора поваренной соли надо в 100 г воды растворить 36 г хлорида натрия. Какое количество (моль) поваренной соли будет растворено в 360 г насыщенного раствора? Ответ запишите с точностью до десятых долей.
Шаг первый: найдём массу насыщенного раствора соли, в котором растворено 36 г хлорида натрия. Для этого сложим массу растворителя и растворённого вещества:
100 + 36 = 136 (г).
Шаг второй: найдём массу хлорида натрия, которая содержится в 360 г насыщенного раствора. Для этого составим пропорцию:
В 136 г насыщенного раствора содержится 36 г хлорида натрия;
в 360 г такого же раствора содержится т г хлорида натрия.
т = (360·36) : 136 = 95,3 (г).
Шаг третий: вычислим молярную массу хлорида натрия:
М = 23 + 35 = 58 (г/моль).
Шаг четвертый: найдём, сколько моль хлорида натрия содержится в 95,3 г.
Для этого массу хлорида натрия разделим на его молярную массу:
95,3 : 58 = 1,6 (моль).
Ответ: 1,6
2. Расчёт объёма раствора, который можно приготовить из раствора известной концентрации
Условие задачи: Какой объём 0,25 М раствора NaOH можно приготовить из 200 мл раствора гидроксида натрия с массовой долей 12% и плотностью 1,13 г/см3? Ответ запишите в мл в виде целого числа.
Шаг первый: найдём массу 200 мл 12%-ного раствора.
Для этого умножим объём раствора на его плотность:
200·1,13 = 226 (г).
Шаг второй: найдём массу гидроксида натрия, которая содержится в 226 г 12%-ного раствора.
Для этого составим пропорцию:
В 100 г раствора содержится 12 г гидроксида натрия;
в 226 г раствора содержится т г гидроксида натрия.
т = (226·12) : 100 = 27,12 (г)
Шаг третий: найдём количество моль гидроксида натрия, которое содержится в 27,12 г.
Для этого вычислим молярную массу гидроксида натрия:
М = 23 + 16 + 1 = 40 (г/моль).
Теперь разделим массу гидроксида натрия на его молярную массу:
27,12 : 40 = 0,68 (моль).
Шаг четвёртый: Найдём объём раствора, в котором это количество гидроксида натрия составит концентрацию 0,5 М.
Для этого составим пропорцию:
в 1000 мл раствора содержится 0,5 моль гидроксида натрия;
в V мл раствора содержится 0,68 моль гидроксида натрия.
V = (1000·0,68) : 0,5 = 1360 (мл).
Ответ: 1360.
II. Обобщение и выводы
Мы изучили более углубленно классификацию дисперсных систем, важность их в природе, жизни человека.
Следует отметить, что резкой границы между видами дисперсных систем нет. Классификацию считать относительной. В зависимости от условий одна система может перейти в другую. Пример: кровь — коллоидный раствор и может стать грубодисперсной системой. FeCl3 — тонкодисперсная система, но при нагревании образуется коллоидный раствор.
III. Домашнее задание:
Провести эксперимент по получению дисперсных систем.
Выучить конспект.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Основная литература:
Габриелян, О. С. Химия: 11-й класс: базовый уровень: учебник / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — 5-е изд., стер. — Москва: Просвещение, 2023. — 128 с.
Урок 6. Дисперсные системы - Химия - 11 класс – Видео. // Российская электронная школа: сайт. – URL: https://resh.edu.ru/subject/lesson/4939/main/151137/ (дата обращения: 13.02.2024).
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
ПРИЛОЖЕНИЕ А
Физкультминутка для глаз