Вступление
Сегодня в педагогических изданиях активно обсуждаются вопросы обновления содержания образования, внедрения инновационных образовательных технологий, отказа от сугубо репродуктивных форм организации учебной деятельности студентов. Важность этой проблемы предопределяется и необходимостью выполнения основных положений государственных программ развития образования. Основной целью государственной политики в отрасли образования является создание условий для развития личности и творческой самореализации каждого гражданина, обновления содержания образования и организации, учебно-воспитательного процессу в соответствии с демократическими ценностями, рыночными принципами экономики, современных научно-технических достижений
Жизнь постоянно ставит перед человеком задания, которые требуют решения. По своей сложности их нельзя сравнить с ни одним, даже с самим трудным заданием из школьных учебников. В школьных заданиях вам четко отмечено, что дано и что нужно получить, рекомендованы возможные методы ее решения. Как правило, в реальной жизни человек имеет дело с заданиями, где трудно формулировать подобные указания. Поэтому важнейшим признаком грамотного специалиста является умение поставить задачу, то есть осуществить формализацию таким способом и на таком языке, чтобы ее суть однозначно понял каждый, кто будет принимать участие в ее решении. Объекты окружающего мира, даже те, которые кажутся самыми простыми, в действительности чрезвычайно сложные. Чтобы понять, как действует тот или другой объект, иногда приходится вместо реальных объектов рассматривать их модели. Модель - упрощенное представление о реальном объекте, процессе или явлении. Модель необходима для того, чтобы понять, как устроен реальный объект: какова его структура, основные свойства, законы развития и взаимодействия, с окружающим миром; научиться управлять объектом и процессом: определить наилучшие способы управления при заданных целях и критериях (оптимизация); прогнозировать прямые или непрямые последствия реализации заданных методов и форм влияния на объект. Поэтому в методической разработке открытого занятия на тему: « Изопроцессы в газах» я активно использую методы и приемы компьютерного моделирования, творческий поход , исследование с применением инноваций и внедрение интерактивных методов обучения.
Цель занятия показать элементы методики занятия изучения и закрепления новых знаний, роль инноваций в активизации познавательной деятельности студентов,
применимость таких инноваций ко всем предметам естественного цикла, индивидуальные и коллективные формы организации учебного процесса, их соответствие сути инноваций, а также целесообразность внедрения инновации в образовательную практику.
Студент должен знать определение изопроцессов, их математическую запись, уметь построить графики изопроцессов в различных координатах, в реалиях сегодняшнего дня уметь пользоваться прикладными компьютерными программами, решать расчетные задачи на тему: « Изопроцессы в газах»,
переводить величины в систему СИ. Воспитательной целью занятия является воспитание интереса к явлениям природы, научным достижениям, открытиям, гордость за мировую и отечественную науку. На занятии я конечно продолжаю этапы формирования познавательного интереса к изучению физики и стремления к наиболее полному и глубокому ее познанию, через использование интерактивных технологий, решение задач и творческой работе на занятии.
Содержание учебного материала имеет достаточный научный уровень, отвечает возрастным особенностям студентов и направлен на обобщение их знаний и умений. Это придает занятию убедительности и говорит об умении преподавателя вызывать у студента тягу к творческой активности, мотивирует его к изучению физики,что просто необходимо , при подготовке современного знающего специалиста.
На основе этого можно считать, что методическая разработка по физике «Изопроцессы в газах» отвечает требованиям современного занятия и может быть использована преподавателями естественно-математического цикла в своей работе.
Содержание
Вступление.
Организационно-методические указания.
План занятия.
Структура занятия.
Ход занятия.
Организационный етап.
Приветствие студентов и отчет старосты об отсутствующих.
Проверка готовности аудитории к занятию.
Актуализация опорних знаний.
Фронтальная беседа по проверке домашнего задания.
Объявление теми и цели занятия.
Мотивация учебной деятельности студентов.
Вступительное слово преподавателя.
Сообщения студентов биографий Бойля и Мариотта.
Постановка компъютерного эксперимента изотермического процесса.
Ответы и выводы студентов.
Решение расчетной задачи на закон Бойля-Мариотта.
Рассмотрение применения изотермического процесса в природе и технике.
Работа над компьютеным моделированием изобарного процесса.
Сообщение студента биографии Гей-Люссака.
Решение графических и расчетных задач.
Ответы и выводы студентов.
Рассмотрение применения изобарного процесса в природе и технике.
Работа над компьютерным моделированием изохорного процесса.
Сообщение студента биографии Ж.Шарля.
Решение графических и расчетных задач.
Ответы и выводы студентов.
Рассмотрение применения изохорного процесса в природе и технике.
Заключение.
Самостоятельная работа.
Итоги занятия
Слово преподавателя.
Рефлексия.
Оценивание работы студентов на занятии.
Домашнее задание.
План занятия ( поминутный)
1. Организационный момент (3 мин.).
2. Актуализация знаний: повторение (5 мин.).
3. Изучение нового материала ( 30мин.).
4. Закрепление, отработка умений (25 мин.).
5. Подведение итогов урока, повторение, контроль( сам. работа (15 мин.)).
6. Домашнее задание ( 2мин.).
План занятия. ( Методический).
Вид занятия: практическое.
Тип занятия: урок изучения и первичного закрепления новых знаний.
Методы и формы проведения занятия. Урок по физике с использованием готовых электронных образовательных ресурсов и обучающих информационных технологий, эвристическая беседа, использование интерактивных технологий, тестовые задачи.
Тема: Изопроцессы в газах.
Цель.
Дидактическая.
Изучить изопроцессы (история открытия, модель установки для изучения зависимостей между термодинамическими параметрами, графики изопроцессов, математическая запись законов, объяснение с точки зрения МКТ);
Научить учащихся решать аналитические и графические задачи, используя уравнение состояния и газовые законы.
Обобщить ранее полученные знания.
Смоделировать газовые законы в компьютерном эксперименте.
Закрепить ранее полученные знания методом решения задач.
Развивать логическое мышление и естественно - научное мировоззрение.
Сформировать умение самостоятельно добывать знания
Применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач;
Методическая
Показать элементы методики занятия изучения и закрепления нових знаний
Показать роль инноваций в активизации познавательной деятельности студентов.
Применимость таких инноваций ко всем предметам естественного цикла.
Индивидуальные и коллективные формы организации учебного процесса, их соответствие сути инноваций.
Целесообразность внедрения инновации в образовательную практику.
Воспитательная.
Воспитывать интерес к явлениям природы, научным достижениям
и открытиям.
Продолжить формирование познавательного интереса учащихся;
Продолжить формирование стремления к глубокому усвоению теоретических знаний через решение задач.
Задачи занятия.
Определение и условия осуществления процесса.
Уравнение и формулировка закона.
Историческая справка.
Экспериментальное исследование справедливости закона.
Графическое изображение процесса.
Границы применимости закона
Межпредметные связи:
Обеспечивающие: химия, математика, информатика.
Обеспечиваемые: химия, математика, информатика.
Методическое обеспечение и оборудование:
Методическая разработка занятия.
Учебная программа
Рабочая программа.
Инструктаж по технике безопасности.
Компьютерная программа: « Физика в картинках»
Лабораторное оборудование для проведения опытов для демонстрации изопроцессов: колба, стеклянная трубка, поршень.
Технические средства обучения:
Компьютерная программа « Физика в картинках».
Компьютерная презентация с использованием мультимедийного проектора
Обеспечение рабочих мест:
Литература:
Обязательная:
Мякишев, Буховцев « Физика 10 кл».2013г.
Дмитриева В. Ф. Физика. «Высшая школа.» 2000г.
Дополнительная:
Кабардин О.Ф. Физика. Справочные материалы. М. «Просвещение».1998г.
Яворский Б. М. Пинский А. А. Основы физики. М. «Наука». 2002г.
Структура занятия.
Организационный етап.
Приветствие студентов и отчет старосты об отсутствующих.
Проверка готовности аудитории к занятию.
Актуализация опорних знаний.
Фронтальная беседа по проверке домашнего задания.
Объявление теми и цели занятия.
Мотивация учебной деятельности студентов.
Вступительное слово преподавателя
Сообщения студентов биографий Бойля и Мариотта.
Постановка компъютерного эксперимента изотермического процесса.
Ответы и выводы студентов.
Решение расчетной задачи на закон Бойля-Мариотта.
Рассмотрение применения изотермического процесса в природе и технике.
Работа над компьютеным моделированием изобарного процесса.
Сообщение студента биографии Гей-Люссака.
Решение графических и расчетных задач.
Ответы и выводы студентов.
Рассмотрение применения изобарного процесса в природе и технике.
Работа над компьютерным моделированием изохорного процесса.
Сообщение студента биографии Ж.Шарля.
Решение графических и расчетных задач.
Ответы и выводы студентов.
Рассмотрение применения изохорного процесса в природе и технике.
Заключение.
Самостоятельная работа.
Итоги занятия
Слово преподавателя.
Рефлексия.
Оценивание работы студентов на занятии.
Домашнее задание.
Ход занятия.
Организационный момент.
Инструктаж по технике безопасности.
Мотивация обучения.
I.Формулирование темы и целей занятия.
Сегодня мы проведем занятие по теме :«Изопроцессы в газах». Поработаем на компьютере с программой, которая моделирует данные процессы. Знание газовых законов помогает предсказывать процессы, происходящие в газовых туманностях, предсказывать погоду, что очень важно для промышленности и сельского хозяйства.
II.Мотивация занятия. На основе уравнения Клапейрона –Менделеева сегодня мы попробуем получить формулировки газовых законов. Эту тему для открытого занятия, я выбрала потому, что вы, как будущие специалисты в области водоснабжения и водоотведения будете в своей работе сталкиваться с тем, что по трубам водоснабжения и водоотведения будет иногда накапливаться водяной пар по свои параметрам близкий к идеальному с определенным давленим и температурой и вам необходимо будет оценить его поведение и соотношение его параметров в зависимости от ситуации, а она может бать и аварийной, а потому надо быть во всеоружии. Сегодня на занятии, выступая в роли исследователей, вам самим придётся анализировать увиденное на компьютерной модели и на настоящем эксперименте, делать выводы, объяснять результаты. Итак, на нашем занятии мы объясним понятие изопроцессов, виды изопроцессов, газовые законы, графические представления газовых законов, их применимость и научимся решать расчетные задачи на использование газовых законов.
III. Актуализация опорных знаний.
Какой газ называется идеальным?
Ответ студента: идеальным газом называется газ, молекулы которого можно считать материальными точками, которые хаотически движутся и взаимодействуют между собой и со стенками сосуда только при непосредственных столкновениях (энергией взаимодействия между молекулами пренебрегают). Следовательно, идеальный газ – газ, в котором собственным объемом молекул и межмолекулярным взаимодействием можно пренебречь. Газ рассматривают как идеальный, если он достаточно нагрет и разрежен (малая плотность). С хорошей точностью могут рассматриваться как идеальные газы, в атмосфере при нормальных условиях. Особенно близки по своим свойствам к идеальному газу He и H2
Каким образом газ оказывает давление на стенки сосуда?
Ответ студента:Молекулы движутся и ударяються о стенки сосуда, кинетическая энергия молекул газа в данном случае гораздо больше потенциальной и суммарное соударение всех молекул, образует давление на стенки сосуда.
Перечислить параметры, характеризующие состояние идеального газа.
Ответ студента: основными параметрами характеризующими состояние системы идеальный газ являются давление , объем и температура.
Какое уравнение связывает между собой эти параметры?
Ответ студента: уравнение , связывающее параметры идеального газа называется уравнение Менделеева- Клапейрона: PV= 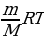 , если мы все три меняющихся параметра перенесем в левую сторону от знака =, то получится :
, если мы все три меняющихся параметра перенесем в левую сторону от знака =, то получится : 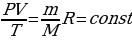 , это означает, что для данной массы газа произведение давления на объем и деленное на температура, есть величина постоянная. Это уравнение называется – уравнение состояния.
, это означает, что для данной массы газа произведение давления на объем и деленное на температура, есть величина постоянная. Это уравнение называется – уравнение состояния.
Преподаватель:
Итак, мы знаем уравнение, которое характеризует состояние идеального газа. Мы видим, что, если масса постоянна, то между оставшимися параметрами есть определённое соотношение. Учёных же давно интересовал вопрос, а существуют ли закономерности в поведении газа, если менять его состояние, как при неизменной массе, так и при неизменном каком-либо другом параметре (P,V,T). Как вы понимаете, эти задачи были успешно решены. Изменение состояния газа при неизменной массе и каком-либо другом параметре назвали изопроцессом. Сегодня на уроке нам предстоит познакомиться с газовыми законами.
1.Вводится понятие изотермического процесса. Формулируется закон Бойля-Мариотта.
Вы, наверное, замечали, что, если сжать воздушный шарик или плохо накачанный мяч, то они несколько сожмутся, однако сжатие прекратится, когда объем воздуха уменьшится до определенного значения. В 1662 году английский ученый Роберт Бойль открыл закон, названный впоследствии законом Бойля-Мариотта. Давайте познакомимся с биографиями Роберта Бойля и Мариотта.
Сообщение студента о биографии Бойля:
Роберт Бойль родился 25 января 1627 года, в городе Лисмор, графство Уотерфорд, Ирландия. Роберт родился в старинной аристократической семье Ричарда Бойля, графа Корка. Первые годы жизни ребенка были не слишком счастливыми. Трех лет от роду Роберт потерял мать, был хилым и болезненным. По существовавшей тогда в аристократических семьях традиции, когда Роберту исполнилось 8 лет, его отдали в Итонский колледж, одно из престижных закрытых учебных заведений Англии. Но отец через три года забрал его оттуда, чтобы направить для продолжения учебы в Европу, в Швейцарию. 17-ти лет Роберт Бойль возвращается в Англию. Потеряв к этому времени и отца и став круглым сиротой, он поселяется у своей сестры, но скоро переезжает в унаследованное им поместье В 1654 начинается новый период в жизни Бойля. Он переезжает в Оксфорд, один из признанных центров тогдашней науки. Будучи состоятельным человеком, Бойль оборудует лабораторию и вместе со своим ассистентом, юным Робертом Гуком, будущим прославленным ученым и членом Королевского общества, приступает в 1655 к опытам. До 1668 Роберт Бойль остается директором и научным руководителем этой лаборатории, появившаяся в 1660 книга, итог этой работы, сразу стала классической. В ней описывался воздушный насос, изобретенный Бойлем и позволивший провести многочисленные эксперименты, и один из основных результатов, вошедший в физику под названием закона Бойля — вывод о том, что давление постоянной массы газа при постоянной температуре обратно пропорционально занимаемому им объему. Этот закон также известен как «Закон Бойля-Мариотта», но Эдм Мариотт установил его лишь в 1676, а опубликовал в 1679.После 1660 интересы Роберта Бойля все больше перемещаются в сторону химии. Исследования великого ученого положили начало рождению новой химической науки. Он прекрасно понимал громадное значение химических знаний для изучения явлений природы и развития ремесел. Роберт Бойль был великолепным экспериментатором и неутомимым наблюдателем. Исследуя экстракты различных растений, он заметил, что настои фиалок, лакмусового лишайника и др. изменяют свой цвет под действием кислот и щелочей. Уже тогда Бойль назвал эти вещества индикаторами. До сегодняшнего дня для определения кислотности растворов современные химики используют изобретенную Бойлем индикаторную бумагу.При исследовании настоя дубильного орешка в воде Роберт Бойль обнаружил, что с солями железа он образует раствор черного цвета, который может быть использован в качестве чернил.Систематизируя многочисленные цветные реакции и реакции осаждения, Роберт Бойль положил начало развитию аналитической химии. Ученый обнаружил, что при обжиге металлов зола всегда была тяжелее взятого металла. Бойль сделал ряд открытий, но так и не смог дать правильного объяснения горению, так как, подобно многим ученым того времени, считал, что в огне содержится особый элемент «теплород». Он доказал, что при дыхании и при горении расходуется только часть воздухаВ 1665 Роберт Бойль избирается почетным доктором физики Оксфордского университета, а через 3 года — членом Королевского общества.Еще в Оксфорде Бойль много внимания уделял организации «Философской коллегии», где происходило общение ученых, где они делали доклады и обсуждали их. В Лондоне он принимал активное участие в использовании опыта работы этой «коллегии» в Королевском обществе и даже в 1680 был избран его президентом, но отказался от этой чести. В историю науки Роберт Бойль вошел не только как автор фундаментальных открытий, но также как первый в мире организатор науки. Его теория о корпускулярном строении веществ была шагом вперед на пути развития атомно-молекулярной теории.
Сообщение студента о биографии Эдма Мариотта:
Французский физик, член Парижской АН со дня её основания.
Родился в Дижоне. Был настоятелем монастыря Св.Мартина в окрестностях Дижона.
Его работы посвящены механике, теплоте, оптике.Мариотт провел опыты по зависимости упругости воздуха от давления при постоянной температуре и в 1676 год вторично сформулировал закон, уже опубликованный Р. Бойлем в 1662, а теперь называемый законом Бойля-Мариотта. Он предложил способ определения высоты места с помощью показаний барометра.Мариотт описал опыты о течении жидкости по трубам, экспериментально подтвердил формулу Торричелли относительно скорости истечения жидкости, исследовал действие фонтанов и составил таблицы зависимости высоты подъёма фонтана от диаметра отверстия.Мариотт изучал столкновение упругих тел и колебания маятника. В "Трактате об ударе или соударении тел" ученый обобщил исследования в этой области. Он доказал увеличение объёма воды при замерзании.Эдм Мариотт впервые описал слепое пятно в глазу, исследовал цвета, в частности цветные кольца вокруг Солнца и Луны, изучал радугу, дифракцию света, лучистую теплоту, показал отличие между тепловыми и световыми лучами.
Преподаватель. Этот закон гласит, что при постоянной температуре объем фиксированной массы идеального газа обратно пропорционален его давлению: P·V = constant или P1·V1 = P2·V2 Иными словами, с ростом давления объем газа должен уменьшаться, чтобы его температура не менялась. Процесс, в котором температура газа остается неизменной, называется изотермическим.
Механизм этого процесса можно объяснить следующим образом. Когда объем сосуда, в котором находится газ, возрастает, пространство, доступное для движения молекул увеличивается, молекулы будут реже сталкиваться со стенками сосуда. Следовательно, число ударов молекул о стенки в единицу времени уменьшится, а, значит, упадет и давление газа. Спринцовка или обычная пипетка являются практическими иллюстрациями закона Бойля. Моделирующая программа поможет вам лучше понять связь между объемом и давлением газа в изотермическом процессе.
Преподаватель Давайте обратимся к эксперименту. Рассмотрим изотермический процесс. Давайте сделаем вывод и попробуем сформулировать определение изотермического процесса?
Студент Для данной массы газа произведение давления на объем есть величина постоянная, если температура газа не меняется.
Обратить внимание на межпредметную связь с математикой.
Студент- (PV)-гипербола.
Преподаватель -Давайте подумаем, что будет происходить в данном процессе, если мы будем уменьшать объем?
Студент -Давление будет возрастать.
Преподаватель -Давайте пронаблюдаем это в эксперименте.
Студенты запускают компьютерную модель. И делают выводы.
Теперь поставим на модели разную температуру, и еще раз пронаблюдаем эксперимент. Какой можно сделать вывод? Какая зависимость P от V ?
Студент -Данная зависимость сохраняется при любой температуре. Эта зависимость называется обратно пропорциональной.
Преподаватель -А теперь давайте попробуем решить расчетные и графические задачи предложенные в презентации.
Решение задач запишите в рабочих листках.
Расчетная задача. Площадь поршня равна 24 см2, объем воздуха в цилиндре 240 см3. Давление равно атмосферному 100 кПа. Какую силу надо приложить, чтобы удержать поршень после его смещения на 2 см?
Решение.
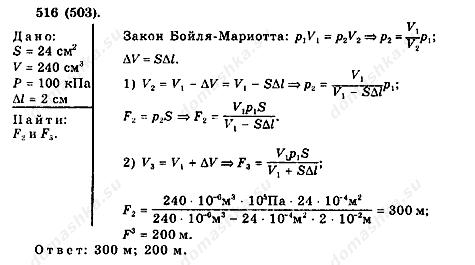
Преподаватель- Подведем небольшой итог. При неизменной температуре газа, естественно будет меняться внешний обьем цилиндра , и чтобы удержать поршень , после его смещения , необходимо приложить достаточно большую силу.
Рассмотрим где применяется изотермический процесс? Рассмотрим это на нашей презентации.
Создание теоретической модели цикла Карно позволило установить пределы развития реальных тепловых машин. Однако, цикл Карно трудно осуществим для некоторых реальных процессов, так как входящие в его состав изотермы требуют определённой скорости теплообмена. Поэтому были разработаны принципы циклов, частично сходных с циклом Карно, например, цикл Отто, цикл сжижения газа, которые были бы применимы в конкретных практических задачах.
Также, дальнейшие исследования показали, что некоторые процессы в природе, например, распространение звука в газе можно с достаточной степенью приближения описывать изотермическим процессом и выявлять их закономерности. Все процессы перехода из одного агрегатного состояния в другое- изотермические.
Еще раз ответим на вопрос.
Какой процесс называется изотермическим?
Студент. Процесс подчиняющийся закону Бойля- Мариотта: для данной массы газа произведение давления на объем есть величина постоянная, если температура газа не меняется.
Преподаватель.
Теперь перейдем к изобарному процессу.
Изобарный процесс- процесс происходящий при постоянном давлении. P- const
Закон Гей - Люссака: Для данной массы газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная: V/T=const, или V1/T1=V2/T2.
Этот закон можно записать через температуру t, измеряемую по шкале Цельсия
V=V0⋅(1+α⋅t),где V0 — объем газа при 0 °С, α = 1/273 К-1 — температурный коэффициент объемного расширения.
Другой французский ученый, физик и химик Жозеф Луи Гей-Люссак установил, что при одинаковом повышении температуры объем любого газа возрастает на одну и ту же величину.
Сообщение студента о биографии Жозефа Луи Гей-Люссака.
Французский физик и химик Жозеф Луи Гей-Люссак родился в Сен-Леонар-де-Нобла (департамент Верхняя Вьенна). Получив в детстве строгое католическое воспитание, в 15 лет он переехал в Париж; там, в пансионе Сансье, юноша продемонстрировал незаурядные математические способности. В 1797-1800 гг. Гей-Люссак учился в Политехнической школе в Париже, где химию преподавал Клод Луи Бертолле. После окончания школы Гей-Люссак был ассистентом Бертолле. В 1809 г. он почти одновременно стал профессором химии в Политехнической школе и профессором физики в Сорбонне, а с 1832 г. – ещё и профессором химии Парижского ботанического сада.
Научные работы Гей-Люссака относятся к самым разным областям химии. В 1802 г. независимо от Джона Дальтона Гей-Люссак открыл один из газовых законов – закон теплового расширения газов, позже названный его именем. В 1804 г. он совершил два полёта на воздушном шаре (поднявшись на высоту 4 и 7 км), во время которых выполнил ряд научных исследований, в частности измерил температуру и влажность воздуха. В 1805 г. совместно с немецким естествоиспытателем Александром фон Гумбольдтом установил состав воды, показав, что соотношение водорода и кислорода в её молекуле равно 2:1. В 1808 г. Гей-Люссак открыл закон объёмных отношений, который представил на заседании Философско-математического общества: «При взаимодействии газов их объёмы и объёмы газообразных продуктов соотносятся как простые числа».
Преподаватель:
Закон Гей-Люссака гласит, что при фиксированном давлении объем неизменной массы газа пропорционален его абсолютной температуре.
V/T = constant или V1/T1 = V2/T2 Иными словами, объем газа возрастает при повышении температуры. Процесс, при котором давлении газа остается постоянным, называется изобарным. Представим себе, что объем газа резко увеличивается. Это должно привести к снижению давления, так как молекулы теперь реже ударяются о стенки сосуда. Чтобы давление осталось неизменным, молекулы должны быстрее двигаться. Тогда они будут за то же время, что и раньше, пробегать уже большее расстояние (до стенок сосуда), и число ударов молекул о стенки за единицу времени не изменится. Поскольку температура характеризует скорость движения молекул, для сохранения неизменного давления увеличение объема должно сопровождаться повышением температуры.
Вышеприведенная анимация иллюстрирует, что происходит с воздушным шариком при изменении температуры газа в нем. Предполагается, что упругость стенок шара и, следовательно, давление воздуха в нем меняются незначительно.
Моделирует программа «изобарный процесс». Она поможет вам лучше понять закон Гей-Люссака. Обратите внимание, что с ростом температуры газа в закрытом сосуде молекулы газа начинают двигаться быстрее и чаще соударяются со стенками сосуда. Это означает, что давление газа в сосуде начинает возрастать. Поскольку вес поршня остается неизменным, увеличение давления на поршень и стенки сосуда заставит поршень двигаться вверх, увеличивая тем самым объем сосуда. При этом молекулы газа будут двигаться в большем объеме, что приведет к уменьшению числа ударов о поршень и стенки. Следовательно, давление в цилиндре будет уменьшаться, пока не достигнет своей прежней величины, компенсирующей вес поршня. Для запуска программы нажмите кнопку «Старт».
Студент -Для данной массы газа отношение объема к температуре есть величина постоянная, если давление газа не меняется
Преподаватель -Давайте запишем математический вид этого закона в своих рабочих листках.
Студенты записывают формулу у себя в рабочих листках, а один на доске.
Обратим внимание на монитор. На мониторе изображены графики данного процесса в разных координатах. Что представляет собой график данного процесса в различных координатах?
Студент - (V T)- прямая из начала координат. Однако в него она не доходит, так как абсолютный нуль не достижим.
Преподаватель -Давайте решим предложенную расчетную задачу.
Температура воздуха в цилиндре 7 С. На сколько переместиться поршень при нагревании на 20 К , если L= 14 см?
Решение.
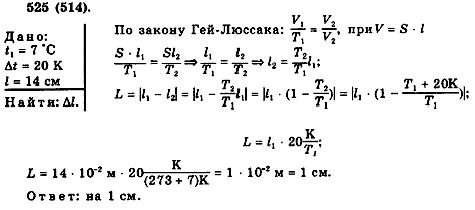
Сделаем вывод из этого решения , что увеличение температуры газа , в поршне приводит к увеличению давления в газе , но так как процесс изобарный , то есть давление должно оставаться постоянным , то при увеличении скорости движения молекул газа , передвигается поршень , тем самым увеличивая внешний обьем в котором находится газ.
Изобарный процесс применяется для проектирования двигателей в холодильных установках, в природе при нагревание песка, воды или камней под действием солнечных лучей; Рассмотрим это на нашей презентации.
Преподаватель: давайте еще раз пройдемся по вопросам.
Какой процесс называется изобарным?
Как называется кривая данного процесса?
Студенты отвечают на вопросы.
Преподаватель- Вернемся к нашей модели. У нас остался изохорный процесс.
Вводится понятие изохорного процесса. Формулируется закон Шарля.
В 1780 году французский ученый Жак Шарль установил, что в фиксированном объеме давление неизменной массы идеального газа пропорционально его абсолютной температуре.
Сообщение студента о биографии Жака Шарля.
Жак Александр Сезар Шарль (1746–1823) – французский физик и изобретатель. В молодости занимал должность канцелярского служащего в министерстве финансов, позднее – должность профессора экспериментальной физики в Консерватории искусств и ремесел в Париже. В 1816 г. Шарль был избран президентом Парижской академии наук. Пионер воздухоплавания. Сразу же после братьев Монгольфье построил воздушный шар из прорезиненной ткани и первый использовал для его наполнения водород. При проектировании воздушного шара разработал конструкцию открытой газовой горелки, которая используется до наших дней. В 1783 г. на воздушном шаре новой конструкции осуществил свой первый полет.
Научные труды Ж. Шарля были связаны с изучением теплового расширения газов. В 1787 г., исследуя свойства газов, установил зависимость объема идеального газа от температуры и давления от температуры.
Преподаватель.
Другими словами, давление газа в сосуде возрастает при увеличении температуры газа: при уменьшении температуры - уменьшается и давление газа. p/T = constant или p1/T1 = p2/T2 Процесс, в котором объем газа остается неизменным, называется изохорным процессом. Теперь этот закон для идеального газа известен под именем закона Шарля. Закон Шарля имеет следующее объяснение. При возрастании температуры газа, молекулы начинают двигаться быстрее и, чаще соударяясь со стенками сосуда, передают им больший импульс. Это приводит к увеличению давления в сосуде. Очевидно, что сосуд должен иметь жесткие стенки и не менять свою форму (объем сосуда остается неизменным). Нажмите кнопку «Старт» для запуска моделирующей программы и, следуя пошаговой инструкции, посмотрите, как протекает изохорный процесс.
Преподаватель -Что происходит с давлением при увеличении температуры, если объем остается постоянным?
Студент Давление возрастает.
Преподаватель -Давайте запишем математический вид этого закона. График закона -
прямая из начала координат, однако в начале пунктир, так как абсолютный нуль не достижим.
Эта прямая называется изохора.
Студент -При уменьшении температуры давление уменьшается.
Преподаватель -Давайте решим задачи, предложенные в эксперименте.
Давление воздуха в автомобильной камере при температуре -13С, было 160 кПа, избыточное над атмосферным, каким стало давление в камере, если в результате длительного движения автомобиля воздух в камере нагрелся до 37 С?
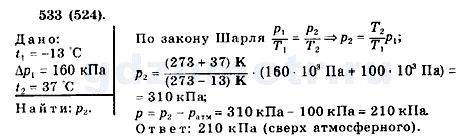
Таким образом можно сделать вывод, что при повышении температуры, чтобы остался неизменным обьем , повышается давление. Это свойство изохорного процесса используется в
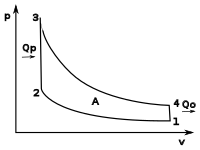
p—V диаграмме цикла Отто
Цикл Отто, Цикл Стирлинга и Адиабатический процесс
При идеальном цикле Отто, который приближённо воспроизведён в бензиновом двигателе внутреннего сгорания, такты 2—3 и 4—1 являются изохорными процессами. Работа, совершаемая на выходе двигателя, равна разности работ, которую произведёт газ над поршнем во время третьего такта (то есть рабочего хода), и работы, которую затрачивает поршень на сжатие газа во время второго такта. Так как в цикле Отто используется система принудительного зажигания смеси, то происходит сжатие газа в 7—12 раз[13].А  нимация классического двигателя Стирлинга с конфигурацией бета типа, при которой рабочий и вытеснительный поршни собраны в одном цилиндре.
нимация классического двигателя Стирлинга с конфигурацией бета типа, при которой рабочий и вытеснительный поршни собраны в одном цилиндре.
В цикле Стирлинга также присутствуют два изохорных такта. Для его осуществления в двигателе Стирлинга добавлен регенератор. Газ, проходя через наполнитель в одну сторону, отдаёт тепло от рабочего тела к регенератору, а при движении в другую сторону отдаёт его обратно рабочему тему. Идеальный цикл Стирлинга достигает обратимости и тех же величин КПД что и цикл Карно
Подведение итогов занятия. Выставление оценок.
З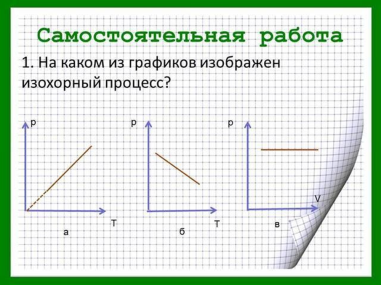
 акрепление изученного материала в виде самостоятельной работы
акрепление изученного материала в виде самостоятельной работы
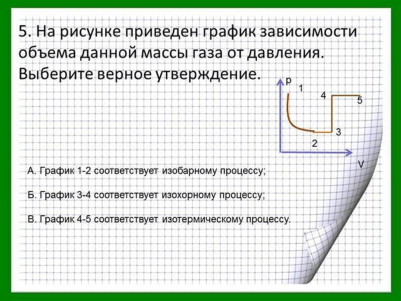

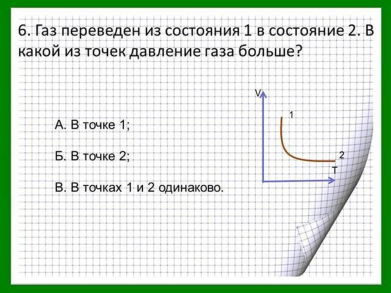
Домашнее задание §5.1-5.4, 5.6-5.9 (1), конспект, задачи в тетради .
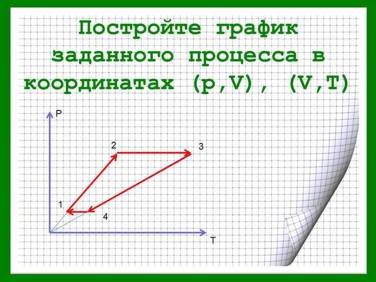
В оставшееся время студенты решают самостоятельную работу. Условие задач находятся в презентации и их рабочих листках






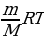 , если мы все три меняющихся параметра перенесем в левую сторону от знака =, то получится :
, если мы все три меняющихся параметра перенесем в левую сторону от знака =, то получится : 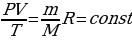 , это означает, что для данной массы газа произведение давления на объем и деленное на температура, есть величина постоянная. Это уравнение называется – уравнение состояния.
, это означает, что для данной массы газа произведение давления на объем и деленное на температура, есть величина постоянная. Это уравнение называется – уравнение состояния.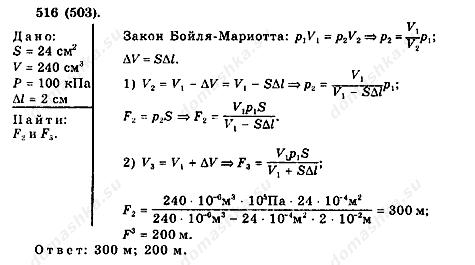
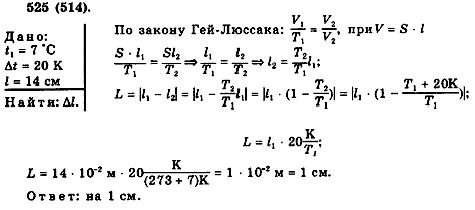
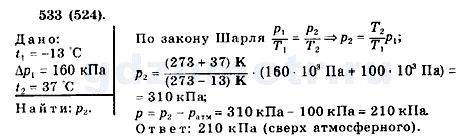
 Таким образом можно сделать вывод, что при повышении температуры, чтобы остался неизменным обьем , повышается давление. Это свойство изохорного процесса используется в
Таким образом можно сделать вывод, что при повышении температуры, чтобы остался неизменным обьем , повышается давление. Это свойство изохорного процесса используется в  нимация классического двигателя Стирлинга с конфигурацией бета типа, при которой рабочий и вытеснительный поршни собраны в одном цилиндре.
нимация классического двигателя Стирлинга с конфигурацией бета типа, при которой рабочий и вытеснительный поршни собраны в одном цилиндре.
 акрепление изученного материала в виде самостоятельной работы
акрепление изученного материала в виде самостоятельной работы












