Просмотр содержимого документа
«Методическая разработка по подготовке к ОГЭ по химии. Задание №7»

МАОУ Гимназия № 49 города Тюмени
7 задание (ОГЭ).
Классификация химических веществ
Учитель химии: Хаймоев Андрей Михайлович

Простые вещества
K 0 Ca 0 AI 0 C 0 Si 0
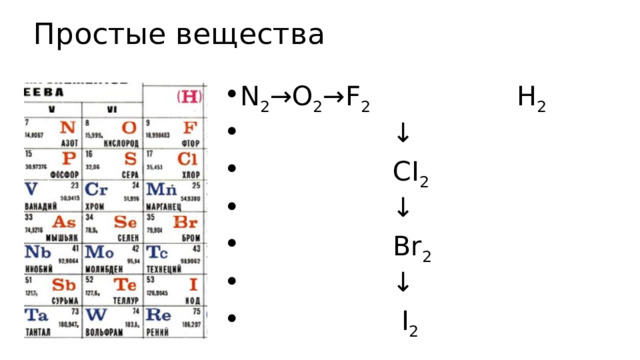
Простые вещества
- N 2 →O 2 →F 2 H 2
- ↓
- CI 2
- ↓
- Br 2
- ↓
- I 2

Оксиды –вещество из двух элементов, один из которых кислород со степенью окисления -2 .
Оксид Ме ( заряд металла берем в таблице растворимости или в скобках, в 4 задании ВПР заряд металла равен номеру группы, когда находим высший оксид )
оксид натрия NaO Na + O -2 НОК =2 Na 2 O
оксид кальция СаO Са 2+ O -2 НОК =2 СаO
оксид алюминия AIO Al 3+ O -2 НОК =6 Al 2 O 3
оксид железа (II) FeO Fe 2+ O -2 НОК =2 FeO
Оксид хрома СrO Сr +6 O -2 НОК =6 СrO 3

Оксиды –вещество из двух элементов, один из которых кислород со степенью окисления -2 .
Оксид НЕме ( заряд неметалла берем в скобках, в 4 задании ВПР заряд неметалла равен номеру группы, когда находим высший оксид )
оксид углерода (IV) CO C +4 O -2 НОК =4 CO 2
оксид углерода (II) СO С 2+ O -2 НОК =2 СO
оксид азота (V) NO N 5+ O -2 НОК =10 N 2 O 5
Оксид серы SO S +6 O -2 НОК =6 SO 3
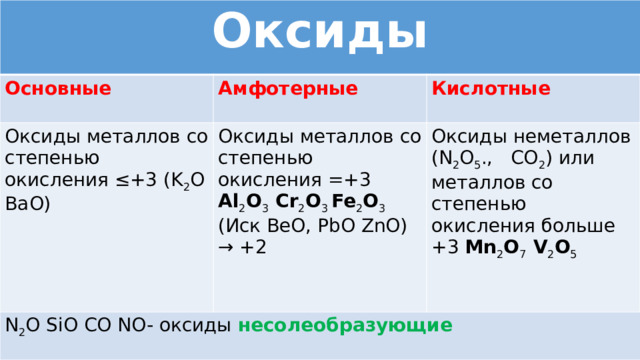
Оксиды
Основные
Амфотерные
Оксиды металлов со степенью окисления ≤+3 (K 2 O BaO)
Кислотные
Оксиды металлов со степенью окисления =+3 Al 2 O 3 Сr 2 O 3 Fe 2 O 3
N 2 O SiO CO NO- оксиды несолеобразующие
(Иск BeO, PbO ZnO) → +2
Оксиды неметаллов (N 2 O 5 ., CO 2 ) или металлов со степенью окисления больше +3 Mn 2 O 7 V 2 O 5
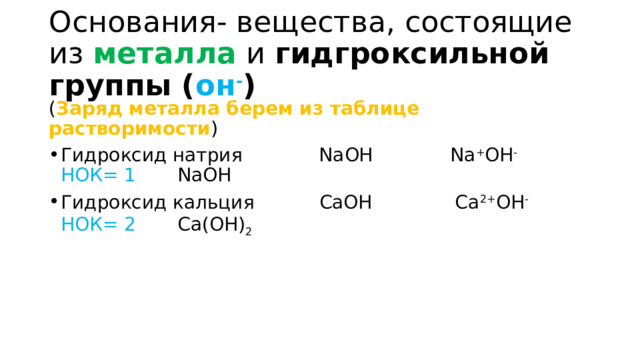
Основания- вещества, состоящие из металла и гидгроксильной группы ( он - )
( Заряд металла берем из таблице растворимости )
- Гидроксид натрия NaOH Na + OH - НОК= 1 NaOH
- Гидроксид кальция CaOH Ca 2+ OH - НОК= 2 Ca(OH) 2

Кислоты-вещества состоящие из водорода (H + ) и кислотного остатка.
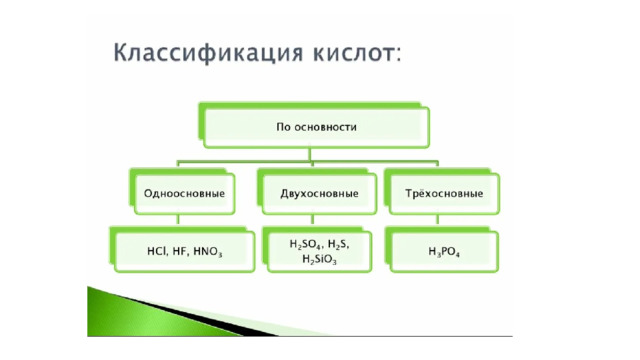

Соли-вещества, состоящие из металла и кислотного осадка
( Заряд металла берем из таблице растворимости )
Сульфат алюминия
AISO 4 AI 3+ SO 4 2- НОК=6
AI 2 (SO 4 ) 3

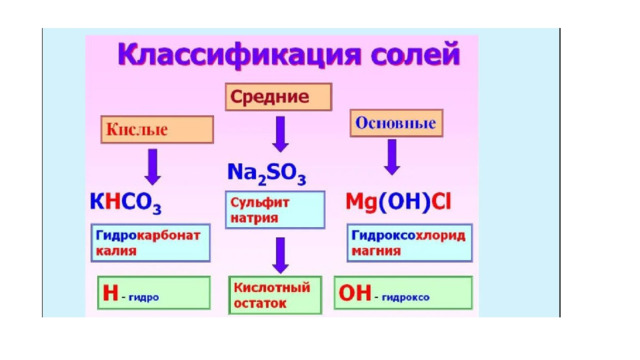
Соли-вещества, состоящие из металла и кислотного осадка
( Заряд металла берем из таблице растворимости )
хлорид алюминия
AIСI AI 3+ CI - НОК=3
AICI 3

Соли-вещества, состоящие из металла и кислотного осадка
( Заряд металла берем из таблице растворимости )
Силикат натрия
NaSiO 3 Na + SiO 3 2- НОК=2
Na 2 SiO 3
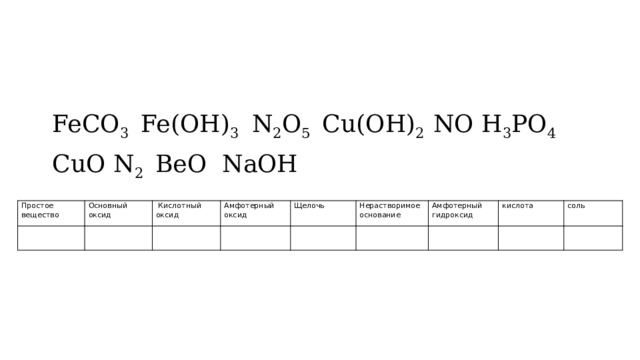
FeCO 3 Fe(OH) 3 N 2 O 5 Cu(OH) 2 NO H 3 PO 4
CuO N 2 ВeO NaOH
Простое вещество
Основный
Кислотный оксид
оксид
Амфотерный оксид
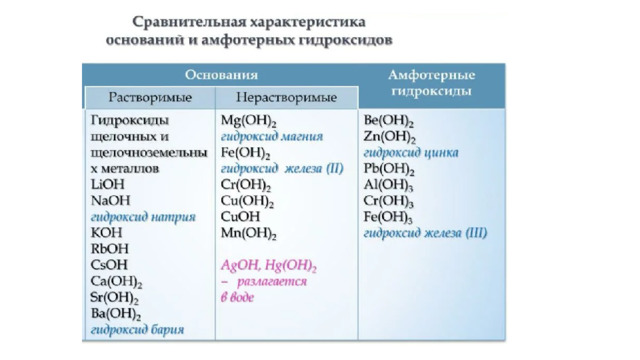
Щелочь
Нерастворимое основание
Амфотерный гидроксид
кислота
соль
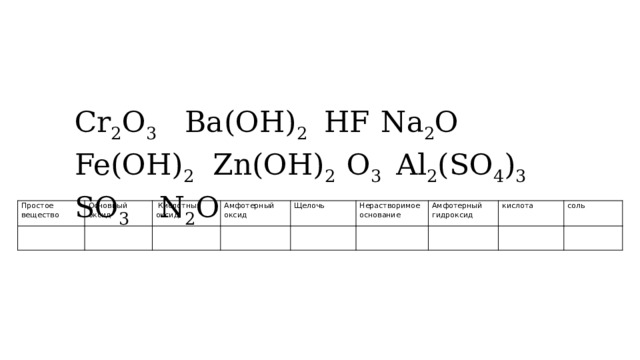
Cr 2 O 3 Ba(OH) 2 HF Na 2 O Fe(OH) 2 Zn(OH) 2 O 3 Al 2 (SO 4 ) 3 SO 3 N 2 O
Простое вещество
Основный
Кислотный оксид
оксид
Амфотерный оксид
Щелочь
Нерастворимое основание
Амфотерный гидроксид
кислота
соль

































