

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

МЕТОДИЧЕСКАЯ РАЗРАБОТКА По самоподготовке к практическому занятию Тема: «Правила работы в химической лаборатории. Химическая посуда. Очистка веществ фильтрованием и дистилляцией и перекристаллизацией»
Просмотр содержимого документа
«МЕТОДИЧЕСКАЯ РАЗРАБОТКА По самоподготовке к практическому занятию Тема: «Правила работы в химической лаборатории. Химическая посуда. Очистка веществ фильтрованием и дистилляцией и перекристаллизацией»»
Щигровский филиал областного бюджетного профессионального
образовательного учреждения
«Курский базовый медицинский колледж»
| Рассмотрена и одобрена на заседании ЦМК ООД, ОГСЭ и ЕН Протокол № ___ от «______»_________________ 20___ Зам председателя ЦМК __________ Маслова Т.А..
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
По самоподготовке к практическому занятию
Тема: «Правила работы в химической лаборатории. Химическая посуда.
Очистка веществ фильтрованием и дистилляцией и перекристаллизацией»
«Химические основы окружающего мира»
Специальность: «Сестринское дело»
Щигры – 2022
Тема занятия: «Правила работы в химической лаборатории. Химическая посуда. Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией».
Цель: формирование навыков самостоятельной работы, базовых знаний по теме.
В результате самоподготовки необходимо знать:
- роль химии в естествознании, ее связи с другими естественными науками, значение в жизни современного общества;
- основные химические понятия по теме «Правила работы в химической лаборатории. Химическая посуда. Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией».
В результате самоподготовки необходимо уметь:
- очищать вещества фильтрованием и дистилляцией, очищать вещества перекристаллизацией;
- осуществлять самостоятельный поиск химической информации по теме «Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией» с использованием различных источников; использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Литература: Химия для колледжей /О.Е. Саенко.- Ростов н / Д: Феникс, 2016. – 282с.
При подготовке к данному занятию:
Проработайте лекционный материал по данной теме и выполните предложенные задания для контроля знаний и умений.
План самоподготовки.
| Вопросы для самоподготовки | Источники информации |
| 1. Правила работы в химической лаборатории. | Конспект
|
| 2. Химическая посуда | Конспект
|
| 3. Очистка веществ фильтрованием и дистилляцией. | Конспект
|
| 4. Очистка веществ перекристаллизацией | Конспект
|
| 5. Подготовка плана – конспекта по вопросу «Роль химии в естествознании» | интернет- ресурсы. |
Теоретические аспекты
ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
Прежде чем приступить к опытам, нужно подготовить рабочее место, необходимую посуду и оборудование, а также внимательно прочитать описание опыта.
Опыты с химическими реактивами представляют дополнительную опасность. От разных веществ могут остаться трудно удаляемые пятна, а то и дырки на одежде. Реактивы могут вызвать ожог на коже; особенно надо беречь глаза. Кроме того, при смешивании некоторых вполне безобидных веществ возможно образование ядовитых соединений, которыми можно отравиться.
Надежный способ избежать неожиданных неприятностей, нежелательных реакций – это строго следовать инструкции, описанию опыта.
Нужно помнить, что вещества нельзя пробовать на вкус и брать руками. А знакомиться с запахом веществ нужно с большой осторожностью, легким движением руки направляя воздух от сосуда с веществом к носу.
Жидкость из сосуда нужно брать пипеткой. Твердые вещества – ложкой, шпателем или сухой пробиркой. Вещества не должны храниться вместе с пищевыми продуктами. Также во время опытов нельзя принимать пищу.
Пробирку с нагреваемым веществом нельзя направлять горлышком в свою сторону или сторону кого-нибудь, кто стоит рядом с вами. Нельзя наклоняться над нагреваемой жидкостью, потому что брызги могут попасть в лицо или глаза.
После окончания опыта необходимо убрать рабочее место и вымыть посуду. Оставшиеся после опыта вещества нельзя сливать в канализацию или выбрасывать в урну для мусора.
На склянках с реактивами могут находиться предупреждающие знаки безопасности. Эти знаки предупреждают о том, что надо быть особенно осторожным в обращении с растворами кислот и щелочей (это едкие и раздражающие вещества), огнеопасными и ядовитыми веществами.

Рис. 1. Предупреждающие знаки безопасности
2. Лабораторное оборудование
ЛАБОРАТОРНЫЙ ШТАТИВ
Нижняя часть штатива - подставка, в которую вкручивается стержень. На стержне закрепляется с помощью винта муфта. В муфту вставляется кольцо или лапка. В лапке можно закрепить пробирку, на кольцо удобно поместить фарфоровую чашку.

Рис. 2. Устройство лабораторного штатива
ЛАБОРАТОРНАЯ ПОСУДА
Для проведения опытов часто используют пробирки и колбы различного вида.
Выделяют колбы: круглые круглодонные, круглые плоскодонные и конические плоскодонные.
В лаборатории используются химические стаканы разных видов: малый химический стакан, большой химический стакан, мензурка.
Химический стакан имеет так называемый носик, который позволяет аккуратно переливать жидкость из стакана в другой сосуд. Мензурка - это стакан конической формы со шкалой.
Стаканы выполнены из тонкого термостойкого стекла, поэтому в них можно проводить нагревание. Мензурки для нагревания не используют, они сделаны из нетермостойкого стекла.
3. Правила нагревания веществ
ПРАВИЛА НАГРЕВАНИЯ ВЕЩЕСТВ
Нагревание веществ можно проводить с помощью электронагревательных приборов и открытым пламенем. Но во всех случаях необходимо соблюдать правила техники безопасности.
Помните, что самая горячая часть пламени – верхняя. Ее температура около 1200 С. Рассмотрим устройство спиртовки, с помощью которой можно проводить нагревание. Спиртовка состоит из резервуара со спиртом, трубки с диском, фитиля и колпачка.

Рис. 3. Устройство спиртовки
НАГРЕВАНИЕ ВЕЩЕСТВ В ПРОБИРКЕ
Нагревание пробирки проводят с помощью пробиркодержателя. Перед тем, как нагревать вещество в пробирке, необходимо прогреть всю пробирку. Пробирку нужно постоянно перемещать в пламени спиртовки. Кипятить жидкость в пробирке нельзя.
НАГРЕВАНИЕ ЖИДКОСТИ В КОЛБЕ
Жидкости можно нагревать не только в пробирках, но и в колбах. Колбы из тонкостенного стекла запрещено нагревать на открытом огне без асбестированной сетки, позволяющей избежать местных перегревов нагреваемой жидкости. Приведем пример нагревания воды в конической плоскодонной колбе. Для этого устанавливают колбу на кольцо с асбестированной сеткой, под которой расположена спиртовка. Горлышко колбы закрепляют в лапке штатива. В колбе можно кипятить нагреваемую жидкость.

Очистка веществ
Некоторые химические реактивы для выполнения аналитических работ приходится в лаборатории подвергать очистке. Очистка производится фильтрованием, перегонкой, перекристаллизацией, экстракцией, методами хроматографии и ионофореза.
Фильтрование
Фильтрование проводят для отделения твердых частиц от жидкости, например нерастворимых примесей от раствора реактива. Фильтрование основано на пропускании смеси жидкости с твердой фазой через пористый фильтр, например через фильтровальную бумагу. Поры (отверстия) в бумаге настолько малы, что через них проходит только жидкость, а все твердые частицы остаются на фильтре. Как скорость фильтрования, так и степень очистки зависят от размеров пор фильтра. На скорость фильтрования оказывает большое влияние вязкость жидкости и ее температура. Горячие жидкости всегда фильтруются быстрее, чем холодные.
Для фильтрования применяют стеклянную воронку (см. рис 4), которую укрепляют в кольце штатива или в специальной дощечке с отверстием для фильтрования. Иногда для небольших воронок делают специальный стеклянный крючок, с помощью которого можно прикрепить воронку непосредственно к стакану.
Фильтровальная бумага в отличие от обычной не проклеена, более волокниста, однородна и чиста. Выпускаются также готовые круглые фильтры из обеззоленной бумаги.
Для изготовления фильтра квадратный листок фильтровальной бумаги складывают пополам, затем вчетверо и округляют внешние края ножницами. Отделяют один слой бумаги, образуя угол, и подгоняют фильтр к воронке. Края фильтра должны быть на 3-5 мм ниже края воронки. Пространственный угол воронки должен быть равен 60°, но иногда раструб воронки несколько отклоняется от 60° в большую или меньшую сторону, и тогда фильтр не прилегает плотно к стенкам воронки. В этом случае, несколько меняя угол перегиба фильтра в ту или другую сторону, плотно подгоняют фильтр к стенкам воронки. После подгонки фильтра к воронке его смачивают чистым растворителем, для водных растворов - водой и, поглаживая чистым пальцем, прижимают фильтр к стенкам воронки так, чтобы под ним не было пузырьков воздуха.
Фильтрование проходит довольно быстро, когда в трубке воронки образуется столбик жидкости. Если столбик жидкости в трубке не образовался, тогда в воронку наливают воду выше краев фильтра, затем пальцем немного приподнимают фильтр и опускают его, стекающая жидкость почти всегда образует столбик в трубке воронки. Для этой же цели иногда удлиняют стеклянную трубку воронки резиновой трубкой.
Жидкость для фильтрования сливают в воронку по стеклянной палочке, прислонив к ней носик стакана. Палочку держат над фильтром вертикально, не прислоняя к фильтру. Если в растворе имеется осадок, то нужно дать ему отстояться, профильтровать осторожно большую часть жидкости и только под конец вылить раствор вместе с осадком. Это делается для того, чтобы осадок не забивал пор фильтра в начале фильтрования и чтобы оно не длилось слишком долго.
Для очистки растворов реактивов часто применяют плоеные (складчатые) фильтры, фильтрование через которые происходит гораздо быстрее. Плоеный фильтр делается также из квадратного листа фильтровальной бумаги. Сначала его складывают и обрезают как обычный фильтр (рис. 41). Затем отвертывают половину и правую четвертушку сгибают пополам внутрь, отгибают верхнюю восьмушку и складывают ее пополам, полученную шестнадцатую долю снова складывают пополам. По этой дольке (1/32 фильтра) складывают гармошкой весь фильтр. Готовый фильтр развертывают и вкладывают в воронку. Если фильтр большого размера, то он может прорваться во время фильтрования, для предотвращения этого в воронку вкладывают сначала небольшой обычный фильтр и плотно подгоняют к воронке. Необходимо также при складывании фильтра стремиться к тому, чтобы складки не подходили вплотную к центру фильтра.

Никогда не следует наливать жидкость до самого края фильтра. Конец трубки воронки нужно прислонить к стенке стакана для того, чтобы не было разбрызгивания фильтрата. Если фильтрат получился мутным, его фильтруют еще раз через тот же фильтр.
Концентрированные растворы кислот и щелочей, а также растворы перманганата фильтровать через бумагу нельзя, так как эти вещества разрушают ее. Их фильтруют обычно через стеклянную вату. Для этого вату обрабатывают сначала нагреванием с соляной кислотой, а затем хорошо промывают водой. Такую вату хранят в стакане с дистиллированной водой, а для фильтрования ее вкладывают в угол воронки. После конца фильтрования ее промывают водой и кладут в тот же стакан для хранения. Концентрированные растворы можно также фильтровать через стеклянные фильтрующие воронки с пористой пластинкой, применяя отсасывание.
Для отфильтровывания большой массы твердого вещества от жидкости применяют фильтрование с отсасыванием. Для этого пользуются колбой Бунзена и воронкой Бюхнера (см. рис. 6 и 29). Воронка вставляется в отверстие резиновой пробки, подобранной к горлу колбы Бунзена - толстостенной конической колбы с отростком для отсасывания; на отросток надевается резиновая трубка от водоструйного насоса (рис. 42).
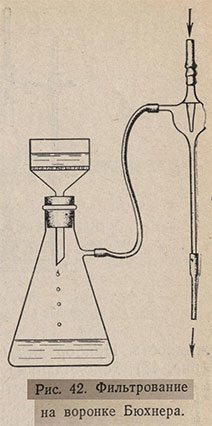
На перегородку воронки кладут два бумажных фильтра соответствующего диаметра, смачивают их дистиллированной водой и плотно прижимают к перегородке стараясь удались все пузырьки воздуха из-под фильтров. Открыв водоструйный насос, проверяют, хорошо ли приложены фильтры. Если фильтры лежат хорошо, то будет слышен спокойный шумящий звук. Если же имеется подсос воздуха, то слышится свистящий звук. В этом случае фильтры прижимают пальцем к сетчатой перегородке до тех пор, пока свист не сменится спокойным шумящим звуком.
Не закрывая водоструйного насоса, сразу же вливают в воронку фильтруемую жидкость (до половины высоты воронки) и периодически добавляют ее, не допуская оголения фильтров. В силу разрежения, создаваемого в колбе Бунзена, жидкость довольно быстро протекает через фильтры. Осадок обычно одновременно с жидкостью переносят на фильтры, хорошо размешав смесь стеклянной палочкой. Рыхлый осадок уплотняют в воронке плоской стеклянной пробкой от бутыли. Отсасывание продолжают до полного прекращения появления капель с носика воронки. Необходимо следить, чтобы колба не наполнялась фильтратом до самого отростка.
Для прекращения отсасывания отсоединяют от колбы Бунзена резиновую трубку, идущую от водоструйного насоса, а затем выключают насос. Если водоструйный насос начать закрывать сразу, не отсоединив от «сосалки», то вода из насоса может попасть в фильтрат вследствие уменьшения давления внутри насоса. Воронку вынимают из колбы, вещество вытряхивают на фильтровальную бумагу и сушат. Фильтрование с отсасыванием применяют при перекристаллизации веществ.
Иногда требуется фильтровать горячие растворы, чтобы они не остывали во время фильтрования. Для этого применяют воронки горячего фильтрования.
Перегонка
Перегонкой (дистилляцией) производят очистку жидких веществ (например, воды, соляной кислоты, спиртов, эфира) от нелетучих примесей. Перегонка основана на том, что жидкость при нагревании до определенной температуры, зависящей от состава жидкости и атмосферного давления, начинает кипеть - бурно переходить в газообразное состояние (пар). Если этот пар охладить, отводя по газоотводной трубке, то он превратится в жидкость. Прибор для перегонки состоит из перегонной колбы 1 (рис. 43), холодильника 2 и приемника 4. Все нелетучие примеси, находящиеся в жидкости в растворенном состоянии, остаются в перегонной колбе.

Для сборки аппарата для перегонки жидкости используют колбу Вюрца - круглодонную колбу с длинной шейкой, от которой отходит длинная узкая отводная трубка. Горло колбы Вюрца закрывают резиновой или корковой пробкой с термометром; пробка должна быть плотно подогнана к горлу колбы. Термометр помещают так, чтобы его резервуар со ртутью был напротив отверстия отводной трубки и не касался стенок горла колбы. Конец отводной трубки пропускают через подогнанную пробку в холодильник Либиха на 3-4 см. Это сочленение также должно быть герметичным. На другом конце холодильника укрепляют аллонж 3 (см. рис. 43) - стеклянную изогнутую трубку, насаживая ее широким концом на пробку, надетую на конец холодильника, который пропущен через пробку на 2-3 см. Суженный конец аллонжа опускается в приемник, которым может быть любая посуда (колба, склянка).
Иногда холодильник Либиха состоит из отдельных частей, не спаянных между собой: холодильной трубки и холодильной рубашки. Для сборки такого холодильника трубку пропускают в рубашку и скрепляют с нею посредством отрезков (колец) резиновой трубки. Резиновую трубку подбирают к муфтам рубашки и надевают на них, затем пропускают через них холодильную (газоотводную) трубку, хорошо смазав ее вазелином и все время поворачивая.
При включении холодильника всегда подсоединяют нижний конец его рубашки, который обращен к приемной колбе, к водопроводному крану резиновой трубкой. От верхнего конца делают отвод в сточную раковину. Нужно следить, чтобы рубашка холодильника всегда была заполнена водой.
Колбу Вюрца укрепляют в лапке штатива так, чтобы ее можно было нагревать. Лапка должна обхватывать горло колбы выше отводной трубки. Подсоединяют колбу к холодильнику, укрепленному на втором штативе. Осторожно вынимают пробку с термометром, вставляют в горло колбы воронку с трубкой, спускающейся ниже отверстия отводной трубки, и наливают в колбу на 2/3 ее объема жидкость, которую нужно перегонять. Помещают в колбу несколько стеклянных капилляров, запаянных с одного конца, чтобы обеспечить равномерное кипение жидкости. Недопустимо во время перегонки бурное вскипание жидкости, так как это может привести к попаданию капель в отводную трубку и к загрязнению дистиллята.
Закрыв колбу пробкой с термометром и проверив надежность сборки прибора, подают воду в холодильник и затем включают нагрев. Обогрев можно вести на газовой горелке через сетку, на водяной бане или другими средствами. После закипания жидкости обогрев уменьшают настолько, чтобы происходило равномерное кипение.
Никогда не следует выпаривать жидкость полностью, ее должно оставаться в перегонной колбе 10-15% от первоначально взятого объема. Для новой заправки колбы обогрев выключают, дают колбе несколько остыть, осторожно вынимают пробку с термометром и доливают жидкость через воронку. Время от времени остатки с загрязнениями следует удалять из перегонной колбы.
Изготовляют также перегонные аппараты целиком из стекла. Такой аппарат состоит из перегонной и приемной колб и холодильника на пришлифованных пробках. Для термометра в пробке перегонной колбы имеется специальный кармашек. Согнутый конец трубки холодильника перед шлифом к приемной колбе имеет отросток для отвода избытка газов.
Многие жидкости имеют свои характерные особенности, которые необходимо учитывать при перегонке. Поэтому прежде чем приступать к перегонке какого-либо вещества, нужно по руководству хорошо ознакомиться с особенностями ее проведения.
В некоторых случаях для перегонки применяют специальный прибор. Он представляет собой цилиндрический сосуд вместимостью 1л, снабженный навинчивающейся крышкой с внутренним конусом (рис. 44). Внутри цилиндра размещены треножник и чашка. Все детали сделаны из фторопласта-4.

Этот прибор используют, например, для получения особо чистой фтористоводородной кислоты для спектрального анализа кремния и его соединений.
В цилиндрический сосуд наливают 500-600 мл очищаемой фтористоводородной кислоты, добавляют 0,2 г спектрально чистого угольного порошка и тщательно перемешивают фторопластовым шпателем. На треножник ставят пустую чашку - приемник. Цилиндрический сосуд закрывают крышкой и помещают на кипящую водяную баню. Крышку сосуда с внешней стороны охлаждают сухим льдом (твердой CO2). Пары кислоты, охлаждаясь на конусообразной стороне крышки, конденсируются и стекают с вершины конуса в чашку. Перегонку ведут со скоростью 15-20 мл/ч. Первую фракцию и кубовой остаток (по 10% от загруженной кислоты) отбрасывают. Для анализа используют среднюю фракцию. Очищенную кислоту хранят во фторопластовом баллончике с хорошо завинчивающейся пробкой.
В описанном приборе кроме фтористоводородной кислоты можно перегонять соляную и азотную кислоты, а также очищать растворы аммиака, этиловый спирт, воду.
Перекристаллизация
Сущность перекристаллизации состоит в том, что очищаемое вещество растворяют в возможно малом объеме горячей воды, раствор отфильтровывают от нерастворимых примесей и фильтрат быстро охлаждают. Вследствие уменьшения растворимости при охлаждении часть вещества выделяется из раствора в виде кристаллов. Растворенные загрязняющие вещества, присутствующие в значительно меньших количествах, чем основное вещество, не выкристаллизовываются, а остаются в маточном растворе. Отделив кристаллы от маточного раствора фильтрованием, получают вещество в довольно чистом состоянии.
Иногда очистить вещество однократной перекристаллизацией не удается, тогда ее повторяют 2-3 раза. Перекристаллизацией нельзя очистить вещество от загрязнений, участвующих в построении кристаллической решетки очищаемого вещества, т.е. образующих с ним так называемые смешанные кристаллы.
Перекристаллизация щавелевой кислоты. Перекристаллизованную щавелевую кислоту состава H2C2O4-2H2O применяют для установки титра растворов перманганата калия KMnO4 или растворов щелочей NaOH или KOH.
Берут в стакан вместимостью 300 мл на лабораторных химических весах 100 г продажной щавелевой кислоты; затем отмеряют мерным цилиндром и наливают в стакан 150 мл горячей дистиллированной воды. Нагревают на газовой горелке (на асбестированной сетке) до полного растворения навески, перемешивая содержимое стакана стеклянной палочкой. На дне может остаться лишь незначительный белый аморфный нерастворимый остаток.
Горячий раствор весь сразу фильтруют через складчатый фильтр, вложенный в воронку с короткой трубкой. В длинной трубке воронки может произойти кристаллизация щавелевой кислоты, и трубка будет забита кристаллами. Во избежание кристаллизации во время фильтрования желательно пользоваться воронкой для горячего фильтрования. Фильтрат собирают в стакан, поставленный в кристаллизатор с холодной водой. После окончания фильтрования фильтрат хорошо перемешивают в течение 10 мин стеклянной палочкой.
Выделившиеся кристаллы отфильтровывают на воронке Бюхнера с отсасыванием. В воронку вкладывают два фильтра, смочив и плотно прижав их ко дну воронки, и включают водоструйный насос. Весь раствор вместе с кристаллами выливают в воронку. Остатки кристаллов очищают стеклянной палочкой со стенок стакана в воронку. Отсасывание ведут до тех пор, пока не прекратится появление капель на кончике трубки воронки, а кристаллы не приобретут снежно-белый цвет. После отсасывания сначала отсоединяют колбу от насоса, а затем закрывают кран водоструйного насоса.
Воронку вынимают из колбы и вытряхивают из нее кристаллы на сложенный вдвое лист фильтровальной бумаги. Стеклянной палочкой распределяют кристаллы ровным слоем, накрывают другим листом сложенным вдвое, и отжимают кристаллы между листами. Если бумага стала мокрой, берут новые листы и снова отжимают кристаллы до тех пор, пока бумага не перестанет увлажняться. Кристаллы «перебирают» стеклянной палочкой, и если они не пристают к ней или полностью отстают от нее при легком встряхивании, то высушивание считают законченным. Кристаллы оставляют на воздухе еще на полчаса, распределив их тонким слоем на листе фильтровальной бумаги, затем пересыпают в банку или бюкс с хорошей пробкой. Выход около 70 г.
Оуэн предложил удобный прибор для перекристаллизации органических веществ для микроанализа (рис. 45). В таком приборе, но только большего размера, можно проводить перекристаллизацию небольших проб веществ для обычного анализа.

Прибор состоит из двух одинаковых кристаллизационных трубок 1 и 5 и центральной части 3. Герметичность соединений создается фланцами 6 и 8, сжатыми пружинным зажимом. Каждую часть изготовляют из стеклянной трубки диаметром 10 мм с припаянными обычными фланцами. Удобно иметь несколько кристаллизационных трубок 1 и 5. Фильтрование проводят через один или два плотных бумажных фильтра 7 диаметром 2 см. Для удаления влаги трубки предварительно хорошо просушивают. Сушку можно проводить продуванием теплого воздуха через отростки 2 или 4, поместив в них кусочки ваты для защиты от попадания атмосферной пыли.
Для отделения нерастворимых примесей в трубке 5 растворяют навеску твердого вещества в соответствующем растворителе, заполняя трубку на 1 см ниже выхода отростка 4. Трубку закрывают пробкой, закрепляют на штативе и подогревают до полного растворения навески. Затем прибор собирают, как показано на рис. 45, вставив между фланцами бумажный фильтр, осторожно переворачивают и фильтруют горячий раствор в трубку-приемник 1. Для ускорения фильтрования можно применять слабое отсасывание через отросток 2 или слабое давление через отросток 4.
Трубку-приемник 1, содержащую чистый фильтрат, используют для кристаллизации вещества путем охлаждения или выпаривания растворителя с отсасыванием. Для кристаллизации центральную часть с трубкой отъединяют и заменяют пробкой (фланец 8). После выделения кристаллов пробку вынимают, на фланцы накладывают бумажный фильтр, прикрепляют центральную часть (трубкой вверх) к другой приемной трубке 5. Затем прибор переворачивают и маточный раствор фильтруют с отсасыванием. Приемник 5 отделяют, фильтрат выливают в сборник, а трубку ополаскивают растворителем. Приемник снова присоединяют к центральной части и прибор переворачивают. Для промывки в трубку с кристаллами через отросток 4 вводят промывную жидкость и содержимое встряхивают. Прибор переворачивают и промывную жидкость отфильтровывают с отсасыванием. Промывку можно повторять много раз.
После промывки основная часть кристаллов оказывается на фильтре. Центральную часть прибора отделяют. Кристаллы вместе с фильтром стряхивают постукиванием на чистый лист фильтровальной бумаги. Кристаллы счищают на фильтр и с фильтром сушат в сушильном шкафу. Гигроскопические вещества высушивают прямо в трубке, при этом центральную часть снимают и заменяют стеклянной крышкой. Отсасывание проводят через трубку 4.
Экстракция
Слово экстракция означает извлечение. Очистка жидкостей экстракцией основана на различной растворимости отдельных веществ в разных растворителях. Очистку экстракцией проводят, взбалтывая раствор с несмешивающейся с водой жидкостью, в которой загрязнения растворяются лучше, чем в воде. Экстракцию проводят в делительной воронке (рис. 46).
Раствор, подвергающийся очистке, наливают не более чем до половины делительной воронки. Туда же добавляют подходящий растворитель, не смешивающийся с водой, в количестве не более половины взятого для очистки раствора. Закрыв делительную воронку и придерживая одной рукой пробку, а другой кран, плавным движением перевертывают воронку несколько раз вверх и вниз. Нельзя энергично взбалтывать содержимое воронки, так как при этом может образоваться устойчивая эмульсия, на расслаивание которой потребуется много времени. Перемешивание нужно вести 15-20 мин так, чтобы слои жидкости как бы скользили один по другому. Время от времени взбалтывание прекращают и в перевернутом состоянии (когда кран приподнят кверху) осторожно приоткрывают кран для выравнивания давления газов.
По окончании экстрагирования делительной воронке дают постоять в штативе до тех пор, пока не произойдет полное расслоение жидкостей и между ними не установится резкая граница. После этого открывают пробку, а затем, осторожно открывая кран, сливают нижний слой жидкости в стакан. Для уменьшения скорости вытекания жидкости под конец истечения кран слегка прикрывают. Затем кран закрывают и выливают оставшуюся жидкость через горло воронки в другой стакан. Для полноты очистки экстракцию повторяют несколько раз.
Задания для самоконтроля
Выполните тестовые занятия:
1.Что изучает наука химия?
Это наука о веществах
Это наука о превращении веществ
Это наука о свойствах веществ
Это наука о веществах, их свойствах и превращениях.
2.Что такое простое вещество?
Вещество, образованное химическими элементами
Вещество, образованное атомами химических элементов
Вещество, образованное атомами одного химического элемента
Вещество, образованное атомами разных химических элементов.
3. В каком ряду расположены только вещества
поваренная соль, сахар, свеча
вода, железо, сера
медь, гвоздь, кислород
Кирпич, пищевая сода, керамический стакан.
4.Верныли следующие суждения?
А) Вещество-это то, из чего состоит физическое тело.
В) Химический элемент-это определенный вид атомов.
Верно только А
Верно только В
Верны оба суждения
Оба суждения неверны.
5.Тело
Графит
Полиэтилен
Свинец
Пробирка.
6 Вещество:
Медная проволока
Медная монета
Медная пластина
Медь
7.Простое вещество:
Водород
Углекислый газ
Сахар
Поваренная соль
8. Сложное вещество
Фосфор
Крахмал
Сера
Медь.
9. Говорят о водороде, как о простом веществе:
Водород – самый легкий газ
Порядковый номер водорода в Периодической таблице-1
Водород входит в состав воды
Водород входит в состав кислоты
10. Говорят о меди как о химическом элементе
Медь не реагирует с соляной кислотой
Медь окисляется при нагревании
Медная проволока
Медь входит в состав медного купороса
11. Установите ,в каком словосочетании имеется в виду элемент, а в каком –простое вещество. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Словосочетание
А) водород горит на воздухе 1.Элемент
Б) кислород входит в состав углекислого газа 2. Простое вещество
В) кислород мало растворим в воде
Г) углерод входит в состав угарного газа
Д)водород самый легкий газ
Преподаватель: ______________ Маслова Т.А.
(подпись) (ФИО)
Щигровский филиал областного бюджетного профессионального
образовательного учреждения
«Курский базовый медицинский колледж»
| Рассмотрена и одобрена на заседании ЦМК ООД, ОГСЭ и ЕН Протокол № ___ от «______»_________________ 20___ Зам председателя ЦМК __________ Маслова Т.А..
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
По самоподготовке к практическому занятию
Тема: «Моделирование построения Периодической таблицы химических элементов»
«Химические основы окружающего мира»
Специальность: «Сестринское дело»
Щигры – 2022
Тема практического занятия: «Моделирование построения Периодической таблицы химических элементов».
Цель: формирование навыков самостоятельной работы, базовых знаний по теме.
В результате самоподготовки необходимо знать:
- роль химии в естествознании, ее связи с другими естественными науками, значение в жизни современного общества;
- основные химические понятия по «Моделирование построения Периодической таблицы химических элементов».
В результате самоподготовки необходимо уметь:
- описывать строение s, p,d, f элементов на основании их положения в Периодической системе, моделирование Периодической системы.
Литература: Химия для колледжей /О.Е. Саенко.- Ростов н / Д: Феникс, 2016. – 282с.
При подготовке к данному занятию:
Проработайте лекционный материал по данной теме и выполните предложенные задания для контроля знаний и умений.
План самоподготовки
| Вопросы для самоподготовки | Источники информации |
| 1. Строение s, p,d, f элементов на основании их положения в Периодической системе | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр.33-40 |
| 2. Моделирование Периодической системы | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), 43-47 |
| 3. Подготовка плана – конспекта по вопросу «Периодический закон и периодическая система элементов Д.И. менделеева» | Интернет - ресурсы. |
Теоретические аспекты
Строение s, p,d, f элементов и их положение в Периодической системе.
Существует 4 типа орбиталей : s, p,d, f .
s – орбитали имеют сферическую форму;
p- орбитали имеют форму гантели;
d – орбитали имеют форму листа клевера;
f – орбитали – форму шести лепестного цветка.
Каждую орбиталь могут занимать 2 электрона. Следовательно, максимальное число электронов, которые могут находиться на первом уровне равно двум.
N=2 n2 ,
где n-номер энергетического уровня, N-максимальное число электронов на этом уровне. На втором -8 ( 2 – на s – орбитали и 6 на р- орбитали). На третьем - 18 электронов (2 на s, 6 на р, 10 на d и 14 на f). В зависимости от того, на какую орбиталь отправлен последний электрон, химические элементы можно разделить на семейства (блоки): s, p,d, f .
К s-элементам относятся элементы I и II групп главных подгрупп, а также гелий.
К р- элементам относятся элементы III и VIII групп главных подгрупп.
К d- элементам относятся элементы побочных подгрупп.
К f - элементам относятся лантаноиды и актиноиды.
Деление Периодической таблицы на блоки.

s- облако р-облако d -облако

Задания для самоконтроля:
1) Написать электронную формулу атома кислорода, магния и фосфора.
2) К каким элементам они относятся и где располагаются в Периодической таблице Д.И. Менделеева?
3) Какое максимальное количество электронов может находиться в IV периоде таблицы Д.И. Менделеева?
4) Сделайте вывод.
Преподаватель: ______________ ____________________________________
(подпись) (ФИО)
Щигровский филиал областного бюджетного профессионального
образовательного учреждения
«Курский базовый медицинский колледж»
| Рассмотрена и одобрена на заседании ЦМК ООД, ОГСЭ и ЕН Протокол № ___ от «______»_________________ 20___ Зам председателя ЦМК __________ Маслова Т.А..
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
По самоподготовке к практическому занятию
Тема: «Свойства оксидов, гидроксидов и солей. Идентификация неорганических веществ»
«Химические основы окружающего мира»
Специальность: «Сестринское дело»
Щигры – 2022
Тема практического занятия: «Свойства оксидов, гидроксидов и солей. Идентификация неорганических веществ».
Цель: формирование навыков самостоятельной работы, базовых знаний по теме.
В результате самоподготовки необходимо знать:
- роль химии в естествознании, ее связи с другими естественными науками, значение в жизни современного общества;
- основные химические понятия по теме «Свойства оксидов, гидроксидов и солей. Идентификация неорганических веществ».
В результате самоподготовки необходимо уметь:
- распознавать кислоты, основания, соли.
Литература: Химия для колледжей /О.Е. Саенко.- Ростов н / Д: Феникс, 2016. – 282с.
При подготовке к данному занятию:
Проработайте лекционный материал по данной теме и выполните предложенные задания для контроля знаний и умений.
План самоподготовки
| Вопросы для самоподготовки | Источники информации |
| 1. Свойства оксидов | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр.47-50 |
| 2. Свойства гидроксидов | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр. 50-56 |
| 3. Свойства солей | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр. 56-61 |
| 4. Подготовка плана – конспекта по вопросу «Основные классы неорганических соединений» | Интернет - ресурсы. |
Теоретические аспекты
Простые вещества образованы атомами одного химического элемента. Все простые вещества можно разделить на неметаллы и металлы. К неметаллам относят только 22 элемента: благородные газы, галогены, а также O, S, Se, Te, N, P, As, C, Si, B, H. Почти все они обладают плохой тепло- и электропроводностью, при обычных условиях большинство из них находится в газообразном состоянии, немногие – в твёрдом, и только бром - жидкость. Остальные элементы относят к металлам. Они обладают характерным "металлическим" блеском, хорошими тепло- и электропроводностью, пластичностью, ковкостью. При обычных условиях металлы, кроме Hg и Fr, - твердые вещества.
Сложные вещества (химические соединения) состоят из атомов разных химических элементов. В зависимости от состава их подразделяют на классы, основные из которых - оксиды, гидроксиды, соли.
Оксиды - вещества, состоящие из какого-либо элемента и кислорода: ЭnOm. Различают солеобразующие и несолеобразующие оксиды. Последние немногочисленны, к ним относят CO, NO, N2O, OF2. Эти оксиды не образуют солей, не реагируют с другими оксидами и водой. Солеобразующие оксиды, в зависимости от свойств делят на оснóвные, кислотные и амфотерные. Оснóвные - оксиды металлов (М) со степенью окисления +1, +2 (не всегда). Кислотные - оксиды неметаллов, а также оксиды металлов со степенью окисления +6, +7. Амфотерные – оксиды металлов со степенью окисления +3 (за редкими исключениями), +4, +5 и иногда +2 (например, BeO, ZnO, SnO, PbO),
Гидроксиды - соединения, в состав которых входят элемент (Э), кроме фтора и кислорода, и гидроксогруппа OH. Общая формула гидроксидов – Э(OH)n. Это, по существу, гидратные формы оксидов, поэтому их тоже три соответствующих типа: оснóвные (основания), кислотные (кислородсодержащие кислоты) и амфотерные. У основных гидроксидов связь Э-О слабее, чем О-Н, в водном растворе они диссоциируют с образованием гидроксид-ионов: Э ¾ О-Н Û Э+ + ОН—, у кислотных связь Э-О сильнее, чем О-Н, они диссоциируют с образованием ионов водорода: Э-О ¾ Н Û ЭО— + Н+, у амфотерных гидроксидов химические связи почти равноценны: ЭО— + Н+ Û Э-О-Н Û Э+ + ОН—.
Соли - продукты полного или частичного замещения атомов водорода у кислот (или амфотерных гидроксидов) на атомы металлов или продукты замещения гидроксогрупп у оснований (или амфотерных гидроксидов) на кислотные остатки. По составу соли делят на средние (K2SO3, Mg(NO3)2 и т.д.), кислые (NaHCO3, КH2PO4 и т.д.) и оснóвные (CuOHNO3, Fe(OH)2Cl и т.д.).
Все соли можно рассматривать как продукт взаимодействия соответствующих кислот и оснований.
Задания для самоконтроля:
Выполните тестовые задания:
Внимательно прочитайте каждое задание (А1 – А10), из предложенных вариантов ответов выберите один правильный и отметьте его.
А1. Кислотам соответствуют следующие соединения:
а) H2 S; NaOH; HNO3
б) HOH; Na2 SO4; K3 PO4
в) HBr; H3 AlO3; CH3 COOH
А2. Кислоты образуются при взаимодействии:
а) основного оксида и воды
б) кислотного оксида и воды
в) кислотного и основного оксида
А3. Реакция образования кислоты:
а) СаО + H2 O = Ca(OH)2
б) MgCl2 + 2NaOH = 2NaCl + Mg(OH)2
в) Na2 SO4 + 2HCl = H2 SO4 + 2NaCl
А4. Реакция нейтрализация:
а) Na2 SO4 + 2HNO3 = H2 SO4 + 2NaNO3
б) MgCl2 + Ba(OH)2 = Ba Cl2 + Mg(OH)2
в) 3NaOH + H3PO4 = Na3PO4 + 3H2 O
А5. Оксиды состоят из кислорода и:
а) одного элемента
б) двух элементов
в) нет правильного ответа
А6. Оксиды могут взаимодействовать между собой с образованием:
а)кислоты
б) соли
в) основания
г) все перечисленное
А7.Оксиды, которые при взаимодействии с водой могут образовывать и кислоты, и основания называют:
а) кислотными
б) основными
в) амфотерными
г) несолеобразующими
А8.Основание можно получить реакцией:
а) разложение
б) соединение
в) замещения
г) обмена
А9.Реакция получения основания:
а) 2Na + H2SO4 = Na2SO4 + H2
б) MgCl2 + 2KOH = Mg(OH)2 +2KCl
в) СuSO4 + BaCl2 = BaSO4 + CuCl2
г) Na2CO3 + 2HCl = H2O + CO2 + 2NaCl
д) нет реакции
А10.Формулы, которым соответствуют соли:
а) NaOH, MgCl2, Cu(OH)2
б) К2О, HNO3, SO3
в) NaHCO3, Mg(OH)Cl2, K2S
г) K3PO4, Al2O3, Na3AlO3
Преподаватель: ______________ Маслова Т.А.
(подпись) (ФИО)
Щигровский филиал областного бюджетного профессионального
образовательного учреждения
«Курский базовый медицинский колледж»
| Рассмотрена и одобрена на заседании ЦМК ООД, ОГСЭ и ЕН Протокол № ___ от «______»_________________ 20___ Зам председателя ЦМК __________ Маслова Т.А..
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
По самоподготовке к практическому занятию
Тема: «Приготовление растворов различных видов концентраций»
«Химические основы окружающего мира»
Специальность: «Сестринское дело»
Щигры – 2022
Тема практического занятия: «Приготовление растворов различных видов концентраций».
Цель: формирование навыков самостоятельной работы, базовых знаний по теме.
В результате самоподготовки необходимо знать:
- роль химии в естествознании, ее связи с другими естественными науками, значение в жизни современного общества;
- основные химические понятия по теме «Приготовление растворов различных видов концентраций».
В результате самоподготовки необходимо уметь:
- приготовить растворы различных видов концентраций;
- осуществлять самостоятельный поиск химической информации по теме «Приготовление растворов различных видов концентраций» с использованием различных источников; использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Литература: Химия для колледжей /О.Е. Саенко.- Ростов н / Д: Феникс, 2016. – 282с.
При подготовке к данному занятию:
Проработайте лекционный материал по данной теме и выполните предложенные задания для контроля знаний и умений.
План самоподготовки
| Вопросы для самоподготовки | Источники информации |
| 1. Понятие раствора | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр.71-74 |
| 2. Приготовление растворов различных видов концентраций | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр. 74-75 |
| 3. Подготовка плана – конспекта по вопросу «Понятие о дисперсных системах» | Интернет - ресурсы. |
Теоретические аспекты
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные(дисперсные ) системы.
Дисперсными- называют гетерогенные системы , в которых одно вещество - дисперсная фаза ( их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы :
Грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это- эмульсии , суспензии , аэрозоли.
Тонкодисперсные- с размерами частиц от 100 до 1 нм . Фаза и среда в таких системах отстаиванием разделяются с трудом. Это : золи (коллоидные растворы- "клееподобные" ) и гели (студни).
| |
|
|
Г+Ж→аэрозоль (туман, облака, карбюраторная смесь бензина с воздухом в ДВС Г+ТВ→аэрозоль(дым, смог, пыль в воздухе) Ж+Г→пена (газированные напитки, взбитые сливки) Ж+Ж→эмульсия (молоко, майонез, плазма крови, лимфа, цитоплазма) Ж+ТВ→золь, суспензия (речной и морской ил, строительные растворы, пасты) ТВ+Г→твердая пена(керамика, пенопласт, поролон, полиуретан, пористый шоколад) ТВ+Ж→гель(желе, желатин, косметические и медицинские мази, помада) ТВ+ТВ→твердый золь (горные породы, цветные стекла) | |
Преподаватель предлагает познакомиться с приготовлением растворов различных концентраций:
ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ
Растворами называются гомогенные системы переменного состава, состоящие из двух или большего числа компонентов и продуктов их взаимодействия.
Под компонентами подразумеваются растворенные вещества и растворитель.
Важнейшей характеристикой раствора является концентрация.
Относительное содержание растворенного вещества в растворе можно выразить через размерные величины - концентрации и безразмерные - доли.
В зависимости от целей использования раствора применяют различные способы выражения концентрации, основные из которых рассмотрены ниже.
1. Массовая доля и процентная концентрация
Массовой долей (ω) называется отношение массы растворенного вещества к массе раствора:

где тв - масса растворенного вещества, г; m(p-pa)- масса раствора, г.
При выражении этой величины в процентах она называется
процентной концентрацией:
![]()
2. Молярная концентрация (молярность)
Молярная концентрация (См)- это отношение количества (числа молей) вещества к объему раствора, выраженному в литрах.


где См - молярная концентрация раствора, моль/л;
тв - масса растворенного вещества, г;
Мв - молярная масса растворенного вещества, г/моль; Vр-ра - объем раствора, л.
Преподаватель предлагает выполнить практическую работу: «Приготовление растворов различных видов концентраций»:
Теоретические аспекты:
ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ
Растворами называются гомогенные системы переменного состава, состоящие из двух или большего числа компонентов и продуктов их взаимодействия.
Под компонентами подразумеваются растворенные вещества и растворитель.
Важнейшей характеристикой раствора является концентрация.
Относительное содержание растворенного вещества в растворе можно выразить через размерные величины - концентрации и безразмерные - доли.
В зависимости от целей использования раствора применяют различные способы выражения концентрации, основные из которых рассмотрены ниже.
1. Массовая доля и процентная концентрация
Массовой долей (ω) называется отношение массы растворенного вещества к массе раствора:

где тв - масса растворенного вещества, г; m(p-pa)- масса раствора, г.
При выражении этой величины в процентах она называется
процентной концентрацией:
![]()
2. Молярная концентрация (молярность)
Молярная концентрация (См)- это отношение количества (числа молей) вещества к объему раствора, выраженному в литрах.


где См - молярная концентрация раствора, моль/л;
тв - масса растворенного вещества, г;
Мв - молярная масса растворенного вещества, г/моль; Vр-ра - объем раствора, л.
Задания для самоконтроля:
1. Составьте молекулярное, полное и краткое ионные уравнения следующей реакции:
HNO3 + K2CO3 →
KOH + Fe(NO3)3 →
NaOH + H2SO4 →
K2SО4 + Вa(ОН)2 →
KOH + HCl →
2. Допишите схему реакции и составьте уравнения в молекулярной и ионных формах:
гидроксид калия + азотная кислота →
силикат калия + серная кислота →
нитрат бария + карбонат натрия →
азотная кислота + гидроксид бария →
cульфат цинка + гидроксид натрия →
3) Установите соответствие между формулой соли и средой её водного раствора.
| Формула соли | Среда раствора | ||||
| 1.щелочная |
Ответ:
|
|
| А | Б | В | Г |
|
|
|
|
|
4) Установите соответствие между формулой соли и отношением её к гидролизу.
| Формула соли | Отношение к гидролизу | ||||
| 1. гидролиз по катиону |
Ответ:
|
|
| А | Б | В | Г |
|
|
|
|
|
5) Установите соответствие между формулой соли и окраской лакмуса в её водном растворе.
| Формула соли | Окраска лакмуса | ||||
| 1.синяя |
Ответ:
|
|
| А | Б | В | Г |
Преподаватель: ______________ Маслова Т.А.
(подпись) (ФИО)
Щигровский филиал областного бюджетного профессионального
образовательного учреждения
«Курский базовый медицинский колледж»
| Рассмотрена и одобрена на заседании ЦМК ООД, ОГСЭ и ЕН Протокол № ___ от «______»_________________ 20___ Зам председателя ЦМК __________ Маслова Т.А..
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
По самоподготовке к практическому занятию
Тема: «Свойства солей. Гидролиз солей»
«Химические основы окружающего мира»
Специальность: «Сестринское дело»
Щигры – 2022
Тема практического занятия: «Свойства солей. Гидролиз солей».
Цель: формирование навыков самостоятельной работы, базовых знаний по теме.
В результате самоподготовки необходимо знать:
- роль химии в естествознании, ее связи с другими естественными науками, значение в жизни современного общества;
- основные химические понятия по теме «Свойства солей. Гидролиз солей».
В результате самоподготовки необходимо уметь:
- определять реакцию среды растворов солей различных типов.
- исследовать растворы различных солей на протекание реакций гидролиза.
- составлять уравнения реакций гидролиза.
- отрабатывать навыки экспериментальной работы, соблюдая правила техники безопасности.
Литература: Химия для колледжей /О.Е. Саенко.- Ростов н / Д: Феникс, 2016. – 282с.
При подготовке к данному занятию:
Проработайте лекционный материал по данной теме и выполните предложенные задания для контроля знаний и умений.
План самоподготовки
| Вопросы для самоподготовки | Источники информации |
| 1. Свойства солей | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр. 79-80 |
| 2. Гидролиз солей | Конспект; Учебник: «Химия для колледжей» (ред. Саенко), Стр. 80-85 |
| 3. Составление уравнений реакций гидролиза | Конспект |
| 4. Подготовка плана – конспекта по вопросу «Многообразие солей», «Применение солей» | Интернет - ресурсы. |
Теоретические аспекты
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией. Электролиты – вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества, имеющие ионную связь: соли, основания, полярные молекулы кисло. Классификация электролитов приведена в таблице 1. Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами.
| Таблица 1. Классификация электролитов
Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит [H+] = [OH-] - среда нейтральная, [H+] [OH-] - среда кислая, [OH-] [H+] - среда щелочная. В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей, которые представлены в таблице 2. | ||||||||||||||||||||||||||
Таблица 2. Типы гидролиза солей
| 1. Соль образована катионом слабого основания и анионом сильной кислоты. (CuCl2, NH4Cl, Fe2(S04)3 — гидролиз по катиону) CuCl2 Cu2+ + 2Сl- Н2О Н+ + ОН- Cu2+ + 2Сl- + Н+ + ОН- CuОН+ + Н++ 2Сl- Выводы: [ Н+] [ОН-] pH среда раствора кислая окраска индикаторов изменяется | 2. Соль образована катионом сильного основания и анионом слабой кислоты. (К2С03, Na2S — гидролиз по аниону) К2С03 2К+ + С032- Н2О Н+ + ОН- 2К+ + С032-+ Н+ + ОН - НСО3- + 2К+ + ОН- Выводы: [ Н+] -] pH 7 среда раствора щелочная окраска индикаторов изменяется |
| 3. Соль образована катионом слабого основания и анионом слабой кислоты. ((NH4)2CO3, CH3COONH4, Na2CO3 — гидролиз по катиону и по аниону) Fe2 (C03)3 2Fe 3+ + 3C032- Н2О Н+ + ОН- 2Fe 3+ + 3C032-+ Н+ + ОН- Fe (ОН)3+ C02 + Н2О идёт до конца | 4. Соль образована катионом сильного основания и анионом сильной кислоты. (гидролизу не подвергаются (NaCl, К2SО4, Ba(N03)2). NaCl Na+ + Сl- Н2О Н+ + ОН- Na+ + Сl- + Н+ + ОН- Na+ + Сl- + Н+ + ОН Выводы: [ Н+] = [ОН-] pH = 7 среда раствора нейтральная окраска индикаторов не изменяется |
Задания для самоконтроля:
1. Определите, какие из указанных веществ являются сильными, а какие слабыми электролитами: H3PO4, LiOH, HCL, Cr(OH)3, KNO3, AgCl.
2. Напишите молекулярные и ионные уравнения:
а) Pb(NO3)2 + K2S =
б) AgNO3 + FeCl3 =
3. Напишите молекулярные и ионные уравнения гидролиза и укажите рН растворов (‹7, ›7, ≈7) следующих солей: FeCl3, Ca(NO3)2, ZnS, K2CO3.
4. Осуществите следующие превращения:
Mg → Mg(OH)2 → MgCL2 → MgCO3 → MgO → Mg(OH)2
Преподаватель: ______________ Маслова Т.А.
(подпись) (ФИО)




 Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля.
Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. 









