Правила техники безопасности:
Инструкция по охране труда для учащихся при выполнении лабораторных и практических работ с использованием химических реактивов и химической посуды
Общие положения.
Данная инструкция предназначена для учащихся при выполнении в кабинете хими практических работ, связанных с использованием работ с использованием химических реактивов и химической посуды
Опасности в работе:
попадание реактивов на части тела при небрежном обращении с химическими реактивами, работой со стеклянной посудой
Требования безопасности перед началом работы.
Перед началом каждой пракической работы, учитель проводит инструктаж учащихся, обучает безопасным правилам поведения при проведении практических работы, экспериментов.
Ученик внимательно изучает содержание и порядок выполнения практической работы, и безопасные приёмы её выполнения.
Ученик освобождает рабочее место от посторонних предметов.
Ученик знакомится с правилами работы с химическими реактивами, работой со стеклянной посудой.
Ученик соблюдает осторожность при работе с химическими реактивами и химической посудой
Учащийся не берёт без разрешения учителя химические реактивы и другое оборудование с других рабочих мест, не встаёт с рабочего места и не ходит по кабинету во время эксперимента.
Учащийся не выносит из кабинета химические реактивы и химическую посуду.
Требования безопасности после окончания работы.
По окончании работы ученик собирает все используемое оборудование и сдает учителю
2. По окончании работы ученик приводит своё рабочее место в порядок.
Требования безопасности в аварийных ситуациях.
В случае выявления неисправностей в приборах, установках немедленно остановить работу и оповестить учителя.
1.Цели проведения практических и лабораторных работ:
Создать условия для изучения особенностей строения и функций организма человека.
2. Планируемые результаты обучения:
Личностные: Формирование познавательных интересов, направленных на изучение веществ и их свойств, развитие интеллектуальных умений.
Метапредметные: овладение составляющими исследовательской деятельности.
Познавательные: Умение вести самостоятельный поиск, анализ, отбор информации, её преобразование, сохранение, передачу в виде, формул, уравнений, текстов, рисунков, таблиц, выводов.
Регулятивные: способность к самостоятельному приобретению новых знаний и практических умений; умение организовывать свою деятельность (самостоятельная работа по инструкции за установленное время); оценивать достигнутые результаты.
Коммуникативные: самостоятельно организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, договариваться друг с другом)
Предметные: особенности работы с химическими реактивами, химической посудой и приборами
3. Методические рекомендации: любая работа может выполняться как лабораторная или практическая. Определяется место работы в учебном курсе. При выполнении работы учащиеся записывают её номер, тему и цель, затем выполняют задание. Переписывать пункты инструктивной карточки не следует.
Подготовка к работе:
1. Точно установить цель и содержание работы, которую должны выполнить учащиеся, и проверить её самому на практике.
2. Составить план урока, в котором необходимо указать место и последовательность выполнения работы, содержание вводной беседы, задание для самостоятельной работы и т.д.
3. Всё необходимое для лабораторных занятий оборудование, должно быть заготовлено заранее.
Практическая работа № 1
«Приёмы обращения с лабораторным оборудованием»
Цель: познакомиться с правилами техники безопасности при работе в кабинете
химии, лабораторным оборудованием и приёмами обращения с ним
Ход работы
Правила техники безопасности при работе в кабинете химии
1) Познакомьтесь с правилами техники безопасности, которые необходимо соблюдать при выполнении лабораторных и практических работ в кабинете химии.
2) Изучите краткую инструкцию по оказанию мер первой медицинской помощи при различного рода отравлениях и поражениях организма.
3) Проверьте полученные знания с помощью тренажёра «Меры предосторожности при работе в лаборатории»
Часть 1. Лабораторный штатив и приёмы обращения с ним
Цель: познакомиться с устройством лабораторного штатива и отработать приёмы обращения с ним
Оборудование: лабораторный штатив, муфты (2 шт.), лапка, кольцо, пробирка, металлическая сетка, химический стакан (100 мл), фарфоровая чашка.
1) Ознакомьтесь с устройством лабораторного штатива.
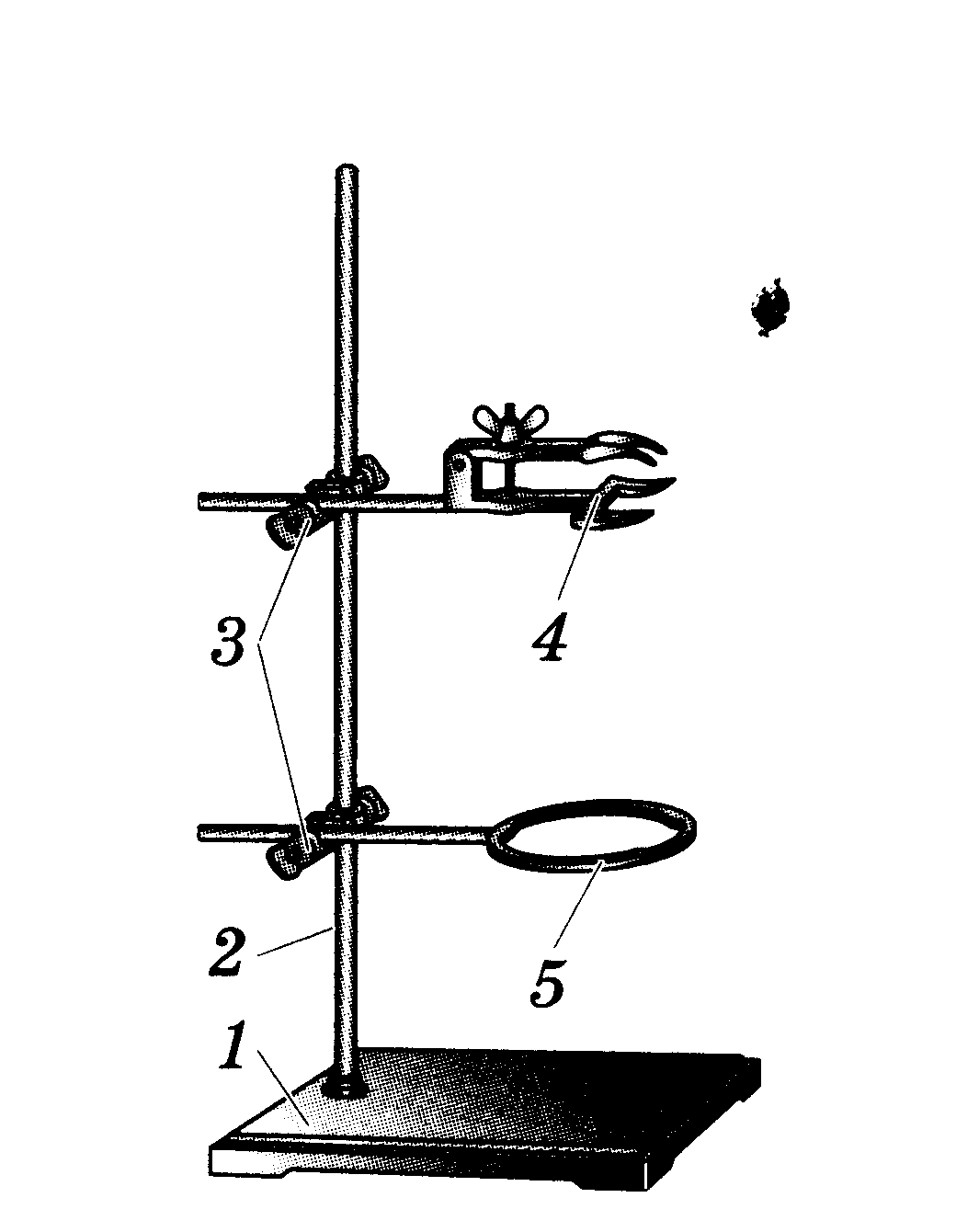
Штатив (см. рисунок) служит для установки и закрепления пробирок, колб, химических стаканов, тиглей, чашек, холодильников и т.д. при выполнении опытов.
Он состоит из массивной чугунной подставки (1), в которую ввинчен стержень (2). Чугунная подставка придаёт штативу устойчивость. На стержне при помощи муфт (3) укрепляют лапку (4) и кольцо (5).
Часть 2. Спиртовка и приёмы обращения с ней. Строение пламени
Цели:
познакомиться с устройством спиртовки, отработать приёмы и правила обращения с ней;
изучить строение пламени спиртовки
Оборудование: спиртовка, спички.
1) Ознакомьтесь с устройством спиртовки.
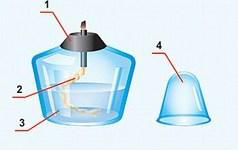
Спиртовка (см. рисунок) состоит из сосуда (резервуара) (3), в который налит спирт, фитиля (2), укреплённого в металлической трубке с диском (1), и колпачка (4).
Внимание!______________________________________________________
Нельзя зажигать спиртовку от другой горящей спиртовки! Это может вызвать пожар.
Рассмотрите строение пламени: оно неоднородно – в нём можно выделить три зоны (см. рисунок)

Тёмная зона (1) находится в нижней части пламени, она самая холодная. За ней самая яркая часть пламени (2). Температура здесь выше, чем в тёмной зоне, но наиболее высокая температура – в зоне 3. Эта зона находится в верхней трети пламени.
Часть 3. Лабораторное оборудование и основные приёмы обращения с ним
Можно выделить несколько групп лабораторного оборудования:
I группа - стеклянная посуда
II группа - фарфоровая посуда
III группа - нагревательные приборы
IV группа - приборы для фиксации и закрепления посуды
Стеклянная посуда может быть сделана из толстого (нетермостойкого) стекла и, соответственно, из термостойкого стекла (тонкостенного).
Посуда из термостойкого стекла используется для проведения операций, сопровождающихся изменением температуры (нагревание, охлаждение).
Посуда из толстого стекла предназначена для хранения реактивов или проведения простейших операций, не сопровождающихся изменением температуры.
2) Ознакомьтесь с назначением лабораторного оборудования
| Пробирки | Используются для проведения опытов и монтажа приборов
|
| Химические стаканы | Служит для проведения простейших операций
|
| Колба плоскодонная (нетермостойкое стекло) | Используется для проведения химических реакций при комнатной температуре или для хранения реактивов
|
| Колба круглодонная (из термостойкого стекла) | Используется для проведения разнообразных химических реакций при нагревании
|
| Воронка | Для разнообразных целей, например, переливания жидкости из одного сосуда в другой, фильтрования
|
| Стеклянная палочка | Для разнообразных химических целей, например перемешивание веществ в стакане
|
| Шпатель | Используется для насыпания твердых веществ
|
| Пробиркодержатель | Используется для удержания пробирок
|
| Тигельные щипцы | Используется для переноса тигля и фарфоровой чашки с веществами
|
| Фарфоровая чашка | Применяется для выпаривания жидкостей
|
| Тигель | Предназначен для нагревания и прокаливания твердых веществ
|
| Ложечка для сжигания | Предназначена для сжигания твердых веществ
|
| Фарфоровая ступка с пестиком | Служит для размельчения и растирания твердых веществ
|
| Мерный цилиндр | Используется для измерения объема жидкости
|
| Ареометр | Предназначен для измерения плотности растворов
|
| Термометр | Предназначен для измерения температуры реакционной смеси или температуры кипения и плавления
|
| Делительная воронка | Используется для разделения двух несмешивающихся жидкостей или для прикапывания раствора какого-либо вещества
|
| Химическая пипетка | Служит для отбора пробы жидких веществ (Прибор для взятия определенного объема жидкости) |
| Штатив для пробирок | Служит для закрепления пробирок при проведение опытов
|
| Мерная колба | Служит для приготовления растворов определенной концентрации
|
| Чашка Петри | Используется для высушивания различных веществ
|
Практическая работа № 2 по теме : «Приготовление раствора с заданной массовой долей растворенного вещества».
Цель работы:1. конкретизировать и закрепить знания о массово доли растворенного вещества как одного из способов выражения состава раствора.
2. Совершенствовать умения работать с химической посудой, пользоваться разновесами выполнять вычисления по формулам.
Оборудования: колбы объемом 50-100мл, стеклянная палочка с резиновым наконечником , весы с разновесами , ложка для сыпучих веществ, мерный цилиндр, сахар , вода.
Экспериментальная задача 1.
1. Получите от учителя задания: приготовить водный раствор сахара массой
150г с массовой долей 20%.
2. Производим расчеты: определяем, какую массу сахара и воды нужно взять для приготовления раствора, заданной концентрации.
3. Записываем формулу для вычисления массы сахара:
m(cахара)= m( раствора)хw( сахара)
4. Делаем вычисления: m(сахара)= 150г х 0,2= 30г
5. Записываем необходимую формулу для вычисления воды:
m(воды)= m( раствора) - m(сахара).
6. Делаем вычисления массы воды: m(воды) = 150г- 30г=120г
Отвесим рассчитанную массу сахара (30г) и поместим ее в колбу.
Т.Б.Помните, что разновесы нужно брать только пинцетом!
7.Учтем, что 1г. воды занимает объем 1мл (или 1см), воду отмеряем мерной посудой. С помощью мерного цилиндра отмеряем 120мл воды.
8. Небольшими порциями вливаем воду в колбу, перемешиваем содержимое колбы стеклянной палочкой.
Делаем этикетку, указываем название (раствор сахара), массовую долю раствора (20%) и массу приготовленного раствора (150мл).
9.Раствор сдаем учителю.
Рабочее место приводим в порядок.
Практическая работа № 3 по теме:
«Условия протекания химических реакций между растворами до конца»
Цель: познакомиться на практике с условия протекания реакций ионного обмена до конца.
Оборудование: штатив с пр бирками, гидроксид натрия (NaOH), фосфат натрия(Na2PO4) , сульфат натрия (Na2SO4), карбонат калия (K2CO3) , соляная кислота (HCl) . серная кислота (H2SO4), фенолфталеин.
Походу выполнения работы заполните таблицу.
| Что делали
| Наблюдения и уравнения реакций
| Вывод о типе химической реакции |
Порядок выполнения работы
Возьмите две пробирки. В одну поместите в одну 2-3 мл. сулфата меди(II), в другую -2-3мл. раствор хлорида калия.
В первую пробирку добавьте немного раствора гидроксида натрия, во-вторую немного фосфата натрия. Что наблюдаете? Наблюдения внесите в таблицу. Составьте уравнения реакции в молекулярном, полном ионном и сокращенном виде.
Сделайте вывод: почему в первой пробирке реакция идет до конца, во второй нет.
3. В одну пробирку налейте 2-3 мл. гидроксида натрия и добавьте каплю фенолфталеина. Раствор приобретает малиновый цвет. Затем прилейте раствор серной кислоты. Что наблюдали? Результаты внесите в таблицу. Составьте уравнения реакции в молекулярном и ионном и виде.
Возьмите пробирку с осадком гидроксидом меди (II), полученном в первом опыте и перелейте в пробирку с соляной кислотой. Что наблюдаете?
Составьте уравнения реакции в молекулярном и ионном и виде.
Сделайте вывод: почему в первой и второй пробирке реакции идет до конца.
Контрольная работа № 1 по теме:
«Атомы химических элементов»
Данная контрольная работа направлена проконтролировать знания о строении атомов химических элементов, а знание физического смысла порядкового номера элемента и номера периода в таблице Д.И.Менделеева; понятия энергетический уровень, распределение электронов на энергетических уровнях, а также о типах химической связи; умение находить относительную атомную и молекулярную массы. На выполнение работы отводится 40 минут.
Характеристика заданий
| № задания | Баллы | Пояснение |
| А. 1-12 | 12 | - строение атома ,периодическая система, за каждый правильный ответ- 1б |
| В. 1 | 2 | - установление соответствия |
| С 1-2 | 6 | - нахождение атомной массы, определение типа химической связи, за каждый правильный ответ – 3б |
| Итого | 20 |
|
Критерии оценивания
| Баллы | Оценка |
| | 2 |
| 14 | 3 |
| 1 5-19 | 4 |
| 20 | 5 |
При выполнении контрольной работы обучающиеся могут пользоваться
Периодической системой химических элементов Д. И. Менделеева
Вариант 1
А1. Каков заряд атом хлора?
А) +24, Б+17, В+12, Г) -17
А2. Определите элемент, если в его атоме 33 электрона.
А) алюминий, Б) мышьяк, В) германий, Г) криптон
А3. Чему равно количество протонов, нейтронов и электронов в атоме фосфора?
А) p=31, n=16, e=31, Б) p=15 n = 15 e= 15, В) p= 15 n= 31 e= 15
Г) p= 15 n=16 e= 15
А4. Каков физический смысл порядкового номера элемента?
А) число энергетических уровней, Б) заряд ядра атома, В) это относительная масса, Г) число нейтронов в ядре
А5. Каков физический смысл номера периода таблицы Д.И.Менделеева?
А) число энергетических уровней, Б) число электронов в атоме В) заряд ядра атома, Г) число электронов на внешнем энергетическом уровне.
А 6. Чему равно число электронов на внешнем энергетическом уровне?
А) порядковому номеру, Б) номеру группы, В) номеру периода, Г) числу нейтронов в ядре.
А 7. У кажите число электронов на внешнем энергетическом уровне атома хлора.
А) 2, Б) 5, В) 7, Г) 17
А 8. Укажите пару элементов между которыми может возникнуть неполярная ковалентная связь.
А) водород и хлор, Б) калий и фтор, В) азот и азот, Г) кислород и натрий
А 9. Укажите формулу соединения с ковалентной полярной связью.
А) O2, Б) KCl В) HBr Г)PH3
А10. Атому какого химического элемента соответствует электронная формула 1S2 2S2 2p4
А) углерод, Б) сера, В) магний, Г) кислород
А11. В ядре атома, какого химического элемента 19 протонов и 20 нейтронов?
А) фтор, Б) калий, В) магний, Г) кислород
А 12. Какова относительная молекулярная масса вещества с химической формулой C2H6O4
А) 100, Б) 94, В) 56, Г) 124
В1. Установите соответствие между типами химической связи и формулой соединения
Вид химической связи химические соединения
А) ковалентная полярная 1). P2O5 2) KCl
Б) ионная 3)HF 4)O3
В) ковалентная неполярная 5) R3P 6) Zn
Г) металлическая
C1. Найти массовую долю натрия в составе молекулы NaNO3
С2. Определите тип химической связи и составьте схему образования связи у следующих веществ:
А) MgCl2 Б) F2 В) H2S
Контрольная работа № 1 по теме:
«Атомы химических элементов»
Данная контрольная работа направлена проконтролировать знания о строении атомов химических элементов, а знание физического смысла порядкового номера элемента и номера периода в таблице Д.И.Менделеева; понятия энергетический уровень, распределение электронов на энергетических уровнях, а также о типах химической связи; умение находить относительную атомную и молекулярную массы. На выполнение работы отводится 40 минут.
Характеристика заданий
| № задания | Баллы | Пояснение |
| А. 1-12 | 12 | - строение атома ,периодическая система, за каждый правильный ответ- 1б |
| В. 1 | 2 | - установление соответствия |
| С 1-2 | 6 | - нахождение атомной массы, определение типа химической связи, за каждый правильный ответ – 3б |
| Итого | 20 |
|
Критерии оценивания
| Баллы | Оценка |
| | 2 |
| 14 | 3 |
| 1 5-19 | 4 |
| 20 | 5 |
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева.
Вариант 2
А1. Каков заряд атома цезия?
А) – 55, Б) +35, В) + 55, Г) + 30
А2. Определите элемент, если в его атоме 35 электронов
А) титан, Б) хром, В) марганец, Г) бром
А3. Чему равно количество протонов, нейтронов и электронов в атоме
А) p=20, n=40, e=20, Б) p=40, n= 20, e=40, В) p=20, n=20, e=20, Г) p=40, n=40, e=40
А4. Каков физический смысл номера периода таблицы Д.И.Менделеева?
А) число нейтронов в ядре, Б) протонов в атоме В) число энергетических уровне в атоме, Г) относительная масса
А5. Каков физический смысл номера периода таблицы Д.И.Менделеева?
А) заряд ядра атома, Б) число электронов на внешнем энергетическом уровне, В) число электронов в атоме, Г) число энергетических уровней в атоме
А 6. Чему равно число электронов на внешнем энергетическом уровне?
А) порядковому номеру, Б) номеру группы, В) номеру периода, Г) числу нейтронов в ядре.
А 7. У кажите число электронов на внешнем энергетическом уровне атома берилия.
А) 2, Б) 5, В) 7, Г) 17
А 8. Укажите пару элементов между которыми может возникнуть ионная связь
А) водород кислород, Б) фтор и углерод, В) хлор и хлор, Г) натрий и хлор
А 9. Укажите формулу соединения с ковалентной полярной связью.
А) CF4, Б) H2B В) KBr Г)P2 O5
А10. Атому какого химического элемента соответствует электронная формула 1S2 2S2 2p3
А11. В ядре атома, какого химического элемента 7 протонов и 7 нейтронов?
А) фтор, Б) азот, В) фосфар, Г) кислород
А 12. Какова относительная молекулярная масса вещества с химической формулой H2CrO4
А) 124, Б) 118, В) 150, Г) 124
В1. Установите соответствие между типами химической связи и формулой соединения
Вид химической связи химические соединения
А) ковалентная полярная 1). O 2 2) Br2
Б) ионная 3) Zn 4) MgCl2
В) ковалентная неполярная 5) CaO 6) HCl
Г) металлическая
Г) металлическая
C1. Найти массовую долю натрия в составе молекулы K2SiO3
С2. Определите тип химической связи и составьте схему образования связи у следующих веществ:
А) NaCl, Б) O2, В)HF
Зачет работа №1 по теме:
«Атомы химических элементов»
Данная зачетная работа направлена проконтролировать знания о строении атомов химических элементов, а знание физического смысла порядкового номера элемента и номера периода в таблице Д.И.Менделеева; понятия энергетический уровень, распределение электронов на энергетических уровнях, а также о типах химической связи; умение находить относительную атомную и молекулярную массы, определять валентность химических элементов. На выполнение работы отводится 40 минут.
Характеристика заданий
| № задания | Баллы | Пояснение |
| А. 1- 7 | 7 | - строение атома ,периодическая система, за каждый правильный ответ- 1б |
| А 8-9 | 4 | - установление соответствия, определение валентности химических элементов, за каждый правильный ответ- 2б |
| Итого | 11 |
|
Критерии оценивания
| Баллы | Оценка |
| | 2 |
| 6-7 | 3 |
| 9-10 | 4 |
| 11 | 5 |
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева.
I вариант
1.(1б) Схема +х)2 )8 )4 отображает строение какого атома?
2. Какой атом имеет заряд ядра + 8?
3. По два электронных слоя имеют атомы:
1) гелия и лития 3)бора и кислорода
2) бериллия и магния 4) алюминия и натрия.
4.И азот, и фосфор имеют:
1) одинаковое число электронов в наружном электронном слое
2) одинаковое число протонов в ядре
3) одинаковое число нейтронов в ядре
4) одинаковое число электронов в атоме.
5. Чем отличается ион кислорода от атома кислорода? Ответ объясните.
6.Ряд элементов, расположенных в порядке усиления их металлических свойств:
1) литий, натрий, калий 2) натрий, магний, алюминий
3) водород, литий, бериллий 4) кальций, магний, бериллий
7. Ионная химическая связь может образовываться между элементами:
1) кислородом и серой, 2) водородом и углеродом,
3) водородом и кислородом, 4) калием и фтором.
8. (2б) Установите соответствие между типом связи и атомами элементов, между которыми она возникает.
ТИП СВЯЗИ АТОМЫ ЭЛЕМЕНТОВ
А)ионная 1)атомы металлов
Б)ковалентная полярная 2)атомы металлов и неметаллов
В)ковалентная неполярная 3)атомы одного химического элемента – неметалла
4)атомы одного химического элемента – металла
5)атомы разных химических элементов-неметаллов
9.(2б) Определите валентность элементов в соединениях с формулами:
H 2O, CuO, Al 2O3, SO3, P 2O5.
Зачет №1 по теме:
«Атомы химических элементов»
Данная зачетная работа направлена проконтролировать знания о строении атомов химических элементов, а знание физического смысла порядкового номера элемента и номера периода в таблице Д.И.Менделеева; понятия энергетический уровень, распределение электронов на энергетических уровнях, а также о типах химической связи; умение находить относительную атомную и молекулярную массы, определять валентность химических элементов. На выполнение работы отводится 40 минут.
Характеристика заданий
| № задания | Баллы | Пояснение |
| А. 1- 7 | 7 | - строение атома ,периодическая система, за каждый правильный ответ- 1б |
| А 8-9 | 4 | - установление соответствия, определение валентности химических элементов, за каждый правильный ответ- 2б |
| Итого | 11 |
|
Критерии оценивания
| Баллы | Оценка |
| | 2 |
| 6-7 | 3 |
| 9-10 | 4 |
| 11 | 5 |
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева.
Вариант 2
1.Схема +х)2 )6 отображает строение какого атома?
2. Какой атом имеет заряд ядра + 16?
3. По два электрона на внешнем энергетическом уровне имеют атомы:
1) гелия и лития 3)бора и кислорода
2) бериллия и магния 4) алюминия и натрия.
4.И натрий, и хлор имеют:
1) одинаковое число электронных слоев
2) одинаковое число протонов в ядре
3) одинаковое число нейтронов в ядре
4) одинаковое число электронов в атоме.
5. Каждый из пары ионов имеет электронную оболочку такую же, как у инертного газа неона:
1) Li +и F– 2) Cl – и Na+ 3) F –и Na+ 4) F– и Cl –
6.Ряд элементов, расположенных в порядке усиления их неметаллических свойств:
1) литий, натрий, калий 2) сера , фосфор, кремний
3) углерод, азот, кислород 4) бор, алюминий, магний
7. При помощи ковалентной полярной связи образовано вещество с формулой:
1) О 2, 2) Ba Cl 2, 3) CO 2, 4) K2 O.
8.Установите соответствие между типом связи и атомами элементов, между которыми она возникает.
ТИП СВЯЗИ АТОМЫ ЭЛЕМЕНТОВ
А)ионная 1)CaO
Б)ковалентная полярная 2) N2
В)ковалентная неполярная 3) PCl5
4)H2
5) CS2
9. Составьте формулы соединений следующих элементов: К, Ba, Al, P(V), Mg – с хлором, зная, что он в этих соединениях одновалентен
Контрольная работа №2
по теме «Соединения химических элементов»
52-49 баллов оценка «5»
48-38 баллов оценка «4»
37-28 баллов оценка «3»
27- 12 баллов оценка «2»
Вариант 1
Часть А. Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (3 балла). Смесью веществ, в отличии от индивидуального вещества, является: А. Водопроводная вода. Б. Углекислый газ. В. Кислород. Г. Медь
2 (3 балла). Ряд формул, в котором все вещества – оксиды: А. ZnO, ZnCl2, H2O. Б. CaO, NaOH, NH3 В. SO3, MgO, CuO. Г. KOH, K2O, MgO.
3 (3 балла). Азот проявляет наибольшую степень окисления в соединении с формулой: А. NH3. Б. NO2. В. N2O5. Г. NO.
4 (3 балла). Общая формула основания выраже-на условной записью:
А. M(OH)x. Б. ЭхОу. В. ЭхНу. Г.НхКО М – металл, Э – элемент, КО – кислотный остаток.
5 (3 балла). Число формул кислот в следующем списке: Н2СО3, Fe(OH)2, NaOH, H2SiО3, Ва(ОН)2,
Cu(OH)2, СаО, SO2 — равно: А. 1. Б. 2. В. 3. Г. 4.
6 (3 балла). Массовая доля серы в серной кислоте Н2SO4 равна: А. 2,04%. Б. 65,31%. В. 52,34%. Г. 32,65% .
7 (3 балла). В 80 г воды растворили 20 г соли. Массовая доля соли в полученном растворе равна:
А. 20% . Б. 25% . В. 40% . Г. 30% .
8 (3 балла). Формула сульфата железа (II): А. FeS. Б. FeSO3. В. Fe2(SO4)3. Г. FeSO4
9 (3 балла). Формула кислоты, в которой заряд иона кислотного остатка равен 2 —:
А. НСl. Б. H2SO4. В. H3PO4. Г. HNO3.
10 (3 балла). Щелочью является вещество с фор-мулой:
А. Аl(ОН)з. Б. Fе(ОН)2, . В. KOH. Г. Cu(OH)2.
11 (3 балла). Соотнесите.
Формула соединения:
1.Na2О. 2.МgSО4. 3.NaOH. 4.HCl. 5.СО2. 6. Н3РО4.
Класс соединений: А. Оксиды. Б. Основания. В. Кислоты. Г. Соли.
12 (3 балла). Соотнесите.
Формула соединения:
1. HNO3. 2. Аl2O3. 3. Са(ОН)2. 4. CaSO4. 5. СаO. 6. H3PO4. 7. Аl(ОН)з. 8. К2SO4.
Название вещества:
А. Оксид кальция. Б. Азотная кислота. В. Гидроксид алюминия. Г. Сульфат калия.
Часть Б. Задания со свободным ответом
13 (6 баллов). Для гидроксидов (кислоты или основания) напишите формулы соответствующих им оксидов: А. H2CO3. Б. Mg(OH)2. В. Al(OH)3.
14 (4 балла). Составьте химические формулы соединений: А. Оксид калия. Б. Соляная кислота. В. Фосфат кальция. Г. Гидроксид бария.
15 (6 баллов). Рассчитайте объем кислорода, полученного из 200 л воздуха, если известно, что объемная доля кислорода в воздухе составляет 21%.
Контрольная работа № 2«Соединения химических элементов»
Вариант 2
Часть А. Тестовые задания с выбором одного правильного ответа и на соотнесение
1. (3 балла). Чистое вещество, в отличие от смеси, - это: А.Морская вода. Б.Молоко. В.Воздух. Г.Кислород.
2 (3 балла). Ряд формул, в котором все ве-щества — основания:
А. Сu(ОН) 2, CuCI2, NaOH. Б. Са(ОН)2, Mg(OH)2, MgOHCI.
В. КОН, Ва(ОН)2, Сu(ОН)2. Г. НСl, NaOH, NaCl.
3 (3 балла). Углерод проявляет наименьшую сте-пень окисления в соединении с формулой:
А. СН4. Б. Н2СО3. В. СО2. Г. СО.
4 (3 балла). Общая формула оксида изображена условной записью:
А. М(ОН)x. В. Мx(КО)у
Б. ЭхОУ. Г. НхКО.
М — металл, Э — элемент, КО — кислотный остаток.
5 (3 балла). Число формул солей в следующем списке: H2CO3, Fe(OH)3, KNO3, NaOH, Ba(OH)2, CaO, SO2, CaCО3 – равно:
А.1 Б.2 В.3 Г.4
6 (3 балла). Массовая доля алюминия в оксиде алюминия Аl2Оз равна:
А. 52,94%. Б. 0,36% В. 26,47% Г. 73,00%
7 (3 балла). В 180 г воды растворили 20 г NaCl. Массовая доля хлорида натрия в полученном растворе равна:
А. 11%. Б. 15%. В. 20%. Г. 10%
8 (3 балла). Формула хлорида меди (II):
А. CuCl Б. Си2SO4 В. CuCl2. Г. CuSO4.
9 (3 балла). Формула кислоты, в которой заряд иона кислотного остатка равен 3 -:
А. НСl. Б. Н3РО4 . В. Н2SO4. Г. HNO3.
10 (3 балла). Нерастворимое в воде основание – это вещество с формулой:
А. NaOH. Б. KOH . В. Fe(OH)3. Г. Ba(OH)2.
11 (6 баллов) Соотнесите.
Формула соединения:
1.K2O. 2.CaSO4. 3.Н2SO4. 4.KOH 5.SO2 6.HNO3
Класс соединений:
А. Оксиды. Б. Основания. В. Кислоты. Г. Соли.
12.(4балла) Соотнесите.
Формула соединения:1. Mn CL2 2. Fe(OH)2 3. Fe(OH)3 4. H 2SO4 5. MgCl2 6. MgO 7. MnO Название вещества: А.Оксид магния. Б.Серная кислота В.гидроксид железа(3) Г.хлорид магния
Часть Б Задания со свободным ответом
13. (6 баллов) Для гидроксида(кислоты или основания) напишите формулу соответствующего ему оксида: А.H 2SiO3 Б.Ca(OH)2 В. Fe(OH)3
14. (4 балла)
Составьте химические формулы соединений: А.оксид алюминия(3) Б.нитрат натрия В.сульфат калия Г. гидроксид цинка(2)
15. (6 баллов) Рассчитайте объем азота, полученного из 200л воздуха, если объемная доля азота в воздухе составляет 78%.
ЗАЧЕТ №2 ПО ТЕМЕ
« ПРОСТЫЕ ВЕЩЕСТВА.
СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ»
Вариант 1
ЧАСТЬ А
Бинарным соединением является
1) Н2 2) KF 3) K2SO4 4) N2
В соединении NO2 степени окисления азота и кислорода равны соответственно 1)-2и+2 2)+4 и-2 3)+Зи-2 4)-2 и+4
Во всех фторидах степень окисления фтора равна
1)-1 2) +1 3)0 4)+7
Водородное соединение неметалла — это
1)H2SO4 2)NaH 3)FeS 4) H2S
Белое тугоплавкое вещество, называемое «негашеной известью», — это
1) NH3 2) СО2 3) НС1 4) СаО
При нормальных условиях оксид находится в газообразном состоянии
1) СаО 2) Н2О 3) СО2 4) ВаО
Правильное название соединения Fe(OH)2
гидроксид железа (III)
гидрид железа (II)
гидроксид железа (II)
едкое кали
Растворимым основанием является:
1)Сu(ОН)2 2) NaOH 3)Mg(OH)2 4) Fe(OH)2
9.Степень окисления фосфора в кислоте Н3РО4 равна
1)+5 2)+3 3)+2 4)+4
Заряд у иона СО3x равен
2)1+ 3)1- 4)2-
Формула сульфита бария
1) Ba(NO3)2 2) Ba(NO2)2 3) BaSO4 4 ) BaSO3
Вещество FeSO4 называется
1) сульфит железа 2) сульфид железа 3) сульфат железа (II) 4) сульфат железа (III)
Оксидом является
1)FeSO4 2)Fe(OH)3 3) SO3 4) FeS
Этот тип решетки имеют соли, некоторые оксиды и гидроксиды металлов
1)ионная 2) молекулярная 3) атомная 4) металлическая
ЧАСТЬ С
Какая масса карбоната натрия потребуется для приготовления 0,5 л 13%-ного раствора плотностью 1,13 г/мл.
(6 баллов) Рассчитайте объем азота, полученного из 200л воздуха, если
объемная доля азота в воздухе составляет 78%
ЗАЧЕТ №2 ПО ТЕМЕ
« ПРОСТЫЕ ВЕЩЕСТВА.
СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ»
Вариант 2
ЧАСТЬ А
1.Бинарными соединениями являютcя:
a. H2SO4, б. K2SO4 в.FeS г.O3
2.В соединении SiCl4 степень окисления равна: а. -1, б.+2, в. -4, г.+4
3. Оксид серы (VI) это: а.O2, б. SO, в. S2O3, г.SO3
4.Хлорид свинца (IV) или тетрахлорид свинца- это:
а. PbCl4, б.PbCl2, в. Pb4Cl, г.Pb4Cl4
5.Данное соединение для приготовления шипучих напитков:
a.CaO , б.CO2, в.HCl. г.NH3
6. Раствор данного соединения в воде называют соляной кислотой:
а. CaO , б. CO2, в. HCl, г.NH3
7.Щелочью является:
а.NaOH, б.Al(OH)3 , в.CuOH, г.Ni(OH)2
8. Степень окисления металла в соединении равна:
а. +2, б. -1, в. +1, г. -2
9. Кислородсодержащей кислотой является:
а. хлороводородная
б. сероводородная
в. азотная кислота,
г. иодоводородная
10. Кислотный остаток кремниевой кислоты
a. P2O5, б. SiO , в. NO3, г.Cl
11.Формула селиката натрия:
а.NaNO3, б.Na2SO3, в.Na2SiO3, г. Na2SO3
12. Оксид бария это:
а. BaO, б. BeO, в. SiO2, г.BaCl2
13. Гидроксид калия это6
а. KOH, б. Ca(OH)2, в. KH , г.CaH2
14. Ковки, пластичны, электро-и теплопроводны с типом решетки: ионной, б. молекулярной, в. атомной, г. металлической
Часть С
Какую массу соли содержит 353 грамма физиологического раствора, если массовая доля содержит соли в нем 0, 85%.
Контрольная работа №3
Тема «Растворение. Растворы. Свойства растворов электролитов»
Данная работа направлена проконтролировать полученные знания о растворении и растворах как физико-химическом процессе и о растворах как физико-химические системы. Контроль сформированных понятий об электролитах и неэлектролитах, механизме диссоциации веществ с различными типами связи, «степень электролитической диссоциации» и классификацией электролитов. Основные положения ТЭД. Умение пользоваться рядом напряжений металлов, таблицей растворимости. На выполнение работы отводится 40 минут.
Характеристика заданий
| № задания | Баллы | Пояснение |
| 1 | 5 | - составить уравнения в молекулярном и ионном виде в свете ТЭД. Правильно выполненное задание. |
| 2 | 2 | - формулы веществ, которые практически не диссоциируют |
| 3 | 5 | - записать уравнения возможных реакций в молекулярном и ионном виде в свете ТЭД |
| Итого | 12 |
|
Критерии оценивания
| Баллы | Оценка |
| 0-7 | 2 |
| 8-9 | 3 |
| 10-11 | 4 |
| 12 | 5 |
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева, Таблицей растворимости солей, кислот и оснований.
Вариант 1
1.Даны вещества: медь, железо, сера, оксид кальция, гидроксид магниния, серная кислота, нитрат серебра, хлорид калия. Выберите, с какими из перечисленных веществ будет взаимодействовать соляная кислота. Запишите уравнения возможных реакций в молекулярном виде, одно уравнение- в свете ТЭД.
2.Из приведенного перечня веществ выпишите формулы веществ, которые практически не диссоциируют: KCl, PbS, Ba(OH)2, CaCO3, CuO, H2SO4, Fe(OH)2.
3.Даны вещества: цинк, оксид серы (VI), оксид кальция, гидроксид железа (II), фосфорная кислота, хлорид свинца, нитрат калия, нитрат аммония. Выберите, с какими из перечисленных веществ будет взаимодействовать раствор гидроксида калия. Запишите уравнения возможных реакций в молекулярном виде, одно уравнение- в свете ТЭД.
Контрольная работа № 3
Тема «Растворение. Растворы. Свойства растворов электролитов»
Данная работа направлена проконтролировать полученные знания о растворении и растворах как физико-химическом процессе и о растворах как физико-химические системы. Контроль сформированных понятий об электролитах и неэлектролитах, механизме диссоциации веществ с различными типами связи, «степень электролитической диссоциации» и классификацией электролитов. Основные положения ТЭД. Умение пользоваться рядом напряжений металлов, таблицей растворимости. На выполнение работы отводится 40 минут
Характеристика заданий
| № задания | Баллы | Пояснение |
| 1 | 5 | - составить уравнения в молекулярном и ионном виде в свете ТЭД. Правильно выполненное задание. |
| 2 | 2 | - формулы веществ, которые практически не диссоциируют |
| 3 | 5 | - записать уравнения возможных реакций в молекулярном и ионном виде в свете ТЭД |
| Итого | 12 |
|
Критерии оценивания
| Баллы | Оценка |
| 0-7 | 2 |
| 8-9 | 3 |
| 10-11 | 4 |
| 12 | 5 |
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева, Таблицей растворимости солей, кислот и оснований.
Вариант 2
1.Даны вещества: магний, золото, оксид калия, вода, гидроксид меди(I I), азотная кислота, карбонат натрия. Выберите, с какими из перечисленных веществ будет взаимодействовать соляная кислота. Запишите уравнения возможных реакций в молекулярном виде, одно уравнение- в свете ТЭД.
2.Из приведенного перечня веществ выпишите формулы веществ, которые практически не диссоциируют: MgCl, BaSO4, KOH, Fe2O3, HNO3, Zn(OH)2, Na3PO4,
3.Даны вещества: натрий, оксид азота(V), оксид магния, серная кислота, гидроксид железа (III), оксид углерода(IV), хлорид меди(I I) , вода. Выберите, с какими из перечисленных веществ будет взаимодействовать раствор гидроксида бария. Запишите уравнения возможных реакций в молекулярном виде, одно уравнение- в свете ТЭД.
Зачет № 3 по теме «Растворение. Растворы. Свойства растворов электролитов».
Данная работа направлена проконтролировать полученные знания о растворении и растворах как физико-химическом процессе и о растворах как физико-химические системы. Контроль сформированных понятий об электролитах и неэлектролитах, механизме диссоциации веществ с различными типами связи, «степень электролитической диссоциации» и классификацией электролитов. Основные положения ТЭД. Умение пользоваться рядом напряжений металлов, таблицей растворимости. На выполнение работы отводится 40 минут.
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева, Таблицей растворимости солей, кислот и оснований.
Критерии оценивания: «2» - 0-7 баллов; «3» - 8-16 баллов; «4» - 17-25 баллов; «5» - 26-30 баллов.
Вариант 1
1.(1 балл) Дайте определение
Электролитическая диссоциация – это …
2. (1 балл) Растворы каких веществ будут проводить электрический ток?
а) сульфата меди(II)
б) спирта
в) гидроксида бария
г) сахара
3. (3 балла) Выпишите формулы:
I)сильных электролитов, а) H2CO3 , б) AgCl, в) KOH, д) O2, е) NH4OH
II)слабых электролитов,
III) неэлектролитов.
4. (1 балл) Формула вещества, электролитическая диссоциация которого протекает ступенчато:
а) Al(NO3)3, б) H2SO4, в) NaOH
5.(3 балла) Пользуясь таблицей 10 учебника, выпишите кислоты по неполному описанию: I) кислородсодержащая, нелетучая; II) двухосновная, слабая;
III) растворимая, сильная.
а) сероводородная, б) соляная, в) ортофосфорная
6.(2 балла) Только основный оксид и соответствующий ему гидроксид
входят в список формул: а) CO, Co(OH)2, б) ZnO, Zn(OH)2, в) Na2O, NaO
7.(3 балла) Формулы веществ, растворы которых окрашивают универсальный индикатор в цвет: I) красный; II) синий; III) не меняют окраску индикатора
а) H2SO4, б) ZnCl2, в) KOH
8. (3 балла) Напишите уравнение электролитической диссоциации азотной кислоты
9.(5 баллов) Дано полное ионное уравнение химической реакции. Напишите соответствующие ему молекулярное и сокращенное ионное уравнения.
2Na+ + SiO32- + 2H+ + 2Cl- = H2SiO3↓ + 2Na+ + 2Cl-
10. (8 баллов) Осуществите превращения. Для реакции (3) составьте ионные уравнения.
Ca→CaO→Ca(OH)2→CaCO3
Зачет № 3 по теме «Растворение. Растворы. Свойства растворов электролитов».
Данная работа направлена проконтролировать полученные знания о растворении и растворах как физико-химическом процессе и о растворах как физико-химические системы. Контроль сформированных понятий об электролитах и неэлектролитах, механизме диссоциации веществ с различными типами связи, «степень электролитической диссоциации» и классификацией электролитов. Основные положения ТЭД. Умение пользоваться рядом напряжений металлов, таблицей растворимости. На выполнение работы отводится 40 минут.
При выполнении контрольной работы обучающиеся могут пользоваться Периодической системой химических элементов Д. И. Менделеева, Таблицей растворимости солей, кислот и оснований.
Критерии оценивания: «2» - 0-7 баллов; «3» - 8-16 баллов; «4» - 17-25 баллов; «5» - 26-30 баллов.
Вариант 2
1.(1 балл) Дайте определение: Раствор – это
2. (1 балл) Растворы каких веществ будут проводить электрический ток?
а) сульфата железа(II) б) кислорода в) гидроксида магни
3. (3 балла) Выпишите формулы:
а) H2SO4, б) H2S, в) HNO2,, г) H2, д) NaOH, е) Al
4. (1 балл) Формула вещества, электролитическая диссоциация которого протекает ступенчато:
а) Ca(OH)2, б) ZnCl2, в) H3PO4.
5.(3 балла) Пользуясь таблицей 10 учебника, выпишите кислоты по неполному описанию: I) кислородсодержащая, нелетучая; II) двухосновная, слабая;
III) растворимая, сильная.: а) ортофосфорная, б) азотная, в) угольая
6.(2 балла) Только основный оксид и соответствующий ему гидроксид
входят в список формул: а) Li2O, LiOH, б) SO2, H2SO3, в) NO2, NH4OH
7.(3 балла) Формулы веществ, растворы которых окрашивают универсальный индикатор в цвет: I) красный; II) синий; III) не меняют окраску индикатора
а) Ca(OH)2, б) HCl, в) К2SO4
8. (3 балла) Напишите уравнение электролитической диссоциации сульфата меди (II)
9.(5 баллов) Дано полное ионное уравнение химической реакции. Напишите соответствующие ему молекулярное и сокращенное ионное уравнения.
2H+ + 2NO3- + Ba2+ + 2OH- = Ba2+ + 2NO3- + 2H2O
10. (8 баллов) Осуществите превращения. Для реакции (3) составьте ионные уравнения.
Zn→ZnO→ZnCl2→Zn(OH)
Ответы к зачету № 1 « Атомы химических элементов»
Вариант 1.
Часть 1. 1а, 2б, 3б, 4а, 5г, 6б, 7б.
Часть 2. 1.Частица имеющая положительный или отрицательный заряд
2. В пределах периода слева направо металлические свойства ослабевают, а неметаллические возрастают, так как увеличивается порядковый номер элемента и количество энергетических уровней, а также изменяется атомная масса.
O2- ковалентная неполярная
OF2- ковалентная полярная
F2- ковалентная
Ca-металлическая
Вариант 2.
Часть 1. 1б, 2в, 3а, 4б, 5а, 6б, 7б
Часть 2. 1. Определенный вид атома.
. В пределах периода слева направо металлические свойства ослабевают, а неметаллические возрастают, так как увеличивается порядковый номер элемента и количество энергетических уровней, а также изменяется атомная масса.
3. AlCl- ионная химическая связь
Al- металлическая химическая связь
HCl- ковалентная полярная химическая связь
Cl- ковалентная неполярная химическая связь
Ответы к зачету № 2 по теме «Простые вещества. Соединения химических элементов»
| Вариант 1. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| Часть А | 2 | 4 | 4 | 2 | 4 | 3 | 3 | 2 | 1 | 4 | 4 | 3 | 3 | 1 |
| Вариант 2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Часть А | 3 | 1 | 3 | 1 | 2 | 3 | 1 | 1 | 3 | 2 | 3 | 1 | 4 | 4 |
Вариант 1. Часть С m(р-ра) = 73,4г
Вариант 2. Часть С. m (NaCl) = 3г




























