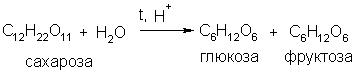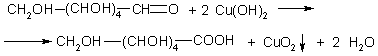Практическое занятие №5.
Решение задач и упражнений по теме: «Кислородсодержащие органические соединения»
Учебная цель: формировать умение решать задачи по теме: «Кислородсодержащие органические соединения».
Учебные задачи:
Повторить основные классы кислородсодержащих органических веществ, генетическую связь между ними;
Повторить строение, получение, физические и химические свойства углеводов;
Научиться решать задачи и упражнения по этой теме.
Ожидаемые результаты:
Студент должен:
иметь практический опыт: применения знаний о строении, химических свойствах и получении кислородсодержащих органических веществах при решении задач;
знать: номенклатуру, строение, химические и физические свойства, применение, получение кислородсодержащих органических веществ, качественные реакции для определения их;
уметь: составлять уравнения реакций, характеризующих химические свойства, выполнять расчёты по формулам;
владеть: навыками работы с калькулятором.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
Рабочая тетрадь.
Калькулятор.
Краткие теоретические и учебно-методические материалы по теме практического занятия.
Существует огромное число органических соединений, в состав которых наряду с углеродом и водородом входит кислород. Атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к определенному классу.
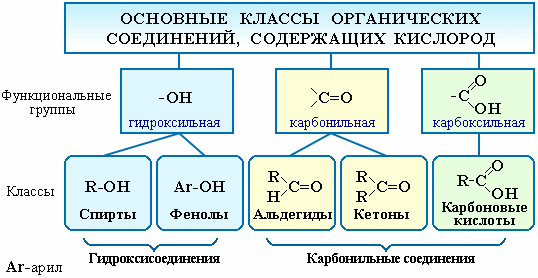
Соединения каждого класса образуют различные производные. Например, к производным спиртов относятся простые эфиры ROR’, к производным карбоновых кислот – сложные эфиры RCOOR’, амиды RCONH2, ангидриды (RCO)2O,хлорангидриды RCOCl и т.д.
Кислодосодержащими органическими соединениями являются и углеводы. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причём водород и кислород находятся в них, как правило, в таком же соотношении, как и в молекуле воды (2:1).

Для обнаружения веществ используют качественные реакции:



1
3
2
Пример 1. Составьте уравнения реакций получения уксусной кислоты исходя из карбида кальция.
CaC2 → C2H2 → CH3-COH → CH3COOH
1) CaC2 + 2H2O→ C2H2 + Ca(OH)2

Hg2+
2) Реакция Кучерова: C2H2 + H2O → CH3-COH
3) Реакция «серебряного зеркала»
CH3-COH + 2[Ag(NH3)2]OH → CH3-COOH + 2Ag↓ + 4NH3↑ + H2O
Пример 2. С помощью каких реакций можно осуществить следующие превращения: сахароза → глюкоза → глюконовая кислота?
Решение. Сахароза гидролизуется при нагревании в подкисленном растворе:
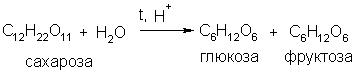
Глюкоза окисляется свежеосажденным гидроксидом меди (II) с образованием глюконовой кислоты (С6Н12О7):
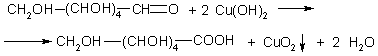
Пример 3. Полученное из глюкозы соединение С3Н6О3 в реакции с натрием образует соединение состава C3H4Na2O3, с карбонатом кальция — С6Н10СаО6, с этанолом в присутствии серной кислоты — С5Н10О3. Назовите это соединение и напишите уравнения реакций.
Решение. При молочнокислом брожении из глюкозы получается молочная (2-гидроксипропановая) кислота:
С6Н12О6 → 2СН3-СН(ОН)-СООН.
В реакции молочной кислоты с натрием участвуют и гидроксильная и карбоксильная группы:
СН3-СН(ОН)-СООН + 2Na → CH3-CH(ONa)-COONa + H2↑
С карбонатом кальция и с этанолом молочная кислота реагирует как обычная карбоновая кислота:
СаСО3 + 2СН3СН(ОН)СООН → (СН3СН(ОН)СОО)2Са + CO2↑ + Н2О,
t, H+
СН3СН(ОН)СООН+С2Н5ОН → СН3СН(ОН)СООС2Н5+Н2О.
Пример 4. Массовая доля крахмала в картофеле составляет 20%. Рассчитайте массу глюкозы, которая может быть получена из картофеля массой 405 кг. Выход продукта равен 70%.
Решение. Составляем уравнение реакции гидролиза крахмала, в результате которой образуется глюкоза:

Рассчитаем массу крахмала в картофеле:

Определяем количество вещества крахмала:

Из уравнения реакции гидролиза крахмала следует

откуда получаем
n(глюкозы) = x∙n (крахмала);

Вычисляем массу глюкозы, которую можно получить при количественном выходе:
m(глюкозы) = n(глюкозы)М(глюкозы);
m(глюкозы) = 0,5∙180 кг = 90 кг.
Учитывая массовую долю выхода продукта, рассчитаем массу реально полученной глюкозы:
 ;
; 
Выполнение работы.
Составьте уравнения гидролиза сахарозы и докажите соответствующими реакциями образование одного из продуктов.
2. Составьте уравнения реакций получения ацетата магния исходя из метана.
3.Составьте уравнения реакций по схеме:
СО2 → С6Н12О6 → С12Н22О11 → С6Н12О6 → С2Н5ОН → СО2
4.Оксид углерода (IV), выделившийся в результате спиртового брожения 25 моль глюкозы, полностью поглощен избытком известковой воды. Какова масса образовавшегося осадка?
5. Массовая доля целлюлозы в древесине составляет 40%, какую массу технической глюкозы можно получить из 1620 кг древесных опилок?
Порядок выполнения отчёта по практическому занятию.
1.В тетради напишите номер, название и учебную цель занятия.
2.Выполните задания.