Государственное бюджетное профессиональное образовательное учреждение Московской области
«МОСКОВСКИЙ ОБЛАСТНОЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ №1»
Специальность
34.02.01 «Сестринское дело»
Цикловая методическая комиссия
общеобразовательных, гуманитарных и естественнонаучных дисциплин
ОУД.10 Химия
1 курс, 1семестр
Методическая разработка
занятия
для студента
по теме:
«Аминокислоты»
Разработчик: преподаватель – Чернышова Н.И.
2020 год
Специальность: 34.02.01 «Сестринское дело»
Разработчик: преподаватель Чернышова Надежда Ивановна
ГБПОУ МО «Московский областной медицинский колледж № 1»
| Рассмотрено и утверждено на заседании ЦМК общеобразовательных, гуманитарных и естественнонаучных дисциплин Протокол №____от___________2020г.
Председатель ЦМК_____________________ Чернышова Н.И. | Согласовано Зам. директора по УР
« » ____________________ 2020 год
____________________________________ Шабарова М. Н.
|
Методическая разработка предназначена для проведения практического занятия по дисциплинеОУД.10 Химия по теме: «Аминокислоты»
для студентов первого года обучения по программе подготовки специалистов среднего звена специальности 34.02.01 «Сестринское дело».
Содержание.
| Структура занятия |
| 4 |
| План-конспект дистанционного занятия |
| 5 |
| Приложение 1 |
| 6 |
| Приложение 2 |
| 10 |
| Список использованной литературы |
| 12 |
Структура занятия
| № п/п. | Этапызанятия | Ориентир. время | Методические рекомендации |
| 1 | Организационная часть, целевая установка | 5 минут | Объявление темы, проверка присутствующих |
| 2 | Мотивация изучения темы | 5 минут | Применение в профессиональной деятельности |
| 3 | Исходный контроль | 10 минут | Фронтальный опрос: Что такое аминокислоты? Где в природе встречаются? Сколько природных аминокислот существует? Какое значение в организме имеют? Какие функции выполняют? |
|
| Опорный конспект Выполнение практической работы | 20 минут | Приложение 1 |
| 4 | Задания по закреплению знаний и формированию ПК | 15 минут | Приложение 2 |
| 5 | Подведение итогов занятия | 3 минуты | Выставление оценок Организуется беседа с целью осмысления своих собственных действий в ходе занятия. Вопросы: 1. Что нового вы для себя узнали на занятии? 2. Понятен ли был материал? 3. Понравился ли вам занятие? |
| 6 | Домашнее задание | 2 минуты | Разъяснение домашнего задания |
Приложение№1
План-конспект дистанционного занятия.
по дисциплине ОУД.10 Химия
Тема: Аминокислоты
Цели занятия:
Сформировать у учащихся знания об азотсодержащих органических соединениях: аминокислотах, белках.
Изучить состав, номенклатуру, химические свойства аминокислот. Актуализировать знания учащихся о белках из курса биологии, изучить структуру, химические свойства белков, их биологические функции.
Продолжить формировать умение предполагать свойства вещества на основании его строения
Продолжить развивать у учащихся умение связывать уже имеющиеся знания с вновь приобретенными, умение анализировать и выделять главное в изученном материале, обобщать изученный материал и делать выводы.
Развитие учебных умений при работе с конспектом.
Тип: изучение нового материала
Вид: лекция
Метод: объяснительно-иллюстративный
Предполагаемый состав слушателей – 11 мс/о,12мс/о,13 мс/о группы, 34.02.01 «Сестринское дело», 33 студента в группе.
План лекции:
1. Аминокислоты: состав, номенклатура.
2. Физические и химические свойства аминокислот.
3. Белки – как биополимеры. Строение белковых молекул.
4. Физические и химические свойства белков.
5. Превращение и функции белков в организме.
1. Аминокислоты – гетерофункциональные соединения, содержащие две функциональные группы: аминогруппу ─NH2 и карбоксильную группу ─ COOH, связанные с углеводородным радикалом.
Общая формула аминокислот:
(H2N)m─ R─ (COOH)n, где m и n – чаще всего равны 1 или 2
По систематической номенклатуре аминокислоты называют по соответствующей карбоновой кислоте с добавлением приставки амино-. Положение аминогруппы указывают соответствующей цифрой.
Например,
3 2 1
СН3─СН─СООН 2-аминопропановая кислота
│
NH2
3 2 1
NH2─СН2─СН2─СООН 3-аминопропановая кислота
По рациональной номенклатуре положение аминогруппы ─NH2 указывается буквами греческого алфавита, начиная со второго атома углерода: α, β, γ, δ, ε и т. д. Название кислоты используется тривиальное.
β α
СН3─СН─СООН α - аминопропионовая кислота
│
NH2
β α
NH2─СН2 ─СН─СООН β –аминопропионовая кислота
Часто аминокислотам организма, образующим белки, дают эмпирические названия:
NH2─СН2─СООН глицин (аминоэтановая кислота, аминоуксусная
кислота)
СН3─СН─СООН аланин (α-аминопропионовая, 2-аминопропановая
│ кислота)
NH2
2. Физические свойства аминокислот
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде, температура плавления , многие аминокислоты имеют сладкий вкус.
Химические свойства аминокислот
(H2N)m─ R─ (COOH)n,
Аминокислоты - амфотерные вещества
1. Аминогруппа ─NH2 определяет основные свойства аминокислот, т. к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия неподеленной электронной пары у атома азота.
2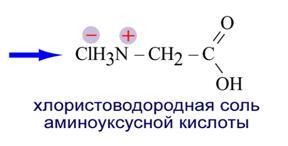

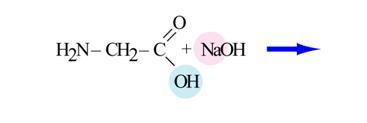 . Карбоксильная группа ─ COOH определяет кислотные свойства.
. Карбоксильная группа ─ COOH определяет кислотные свойства.
3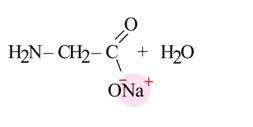 . Взаимодействие аминокислот друг с другом - образование пептидов
. Взаимодействие аминокислот друг с другом - образование пептидов
Р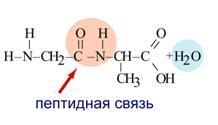
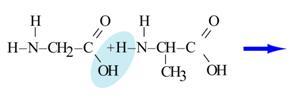 еакция образования пептидов относится к реакциям поликонденсации.
еакция образования пептидов относится к реакциям поликонденсации.
Поликонденсация – реакция образования высокомолекулярных соединений, сопровождающаяся выделением побочных низкомолекулярных продуктов (H2O NH3 и др.)
Получение аминокислот
1. Лабораторный способ - через галогенпроизводные карбоновых кислот
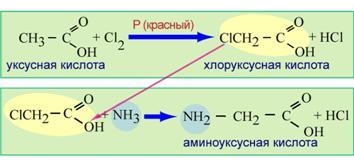

2. Промышленный способ - гидролиз белков.
3. Белки – высокомолекулярные органические соединения, состоящие из α-аминокислот, соединенных пептидными связями.
В состав белков входит свыше 20 различных аминокислот. Все белки сильно различаются между собой по качественному и количественному составу различных аминокислот, по взаиморасположению аминокислотных остатков.
В тканях и органах человека и животных могут синтезироваться 12 α-аминокислот (заменимые аминокислоты), 8 α-аминокислот в организме человека и животных не синтезируются (незаменимые аминокислоты) и должны поступать в организм с пищей.
Строение белковых молекул
Различают четыре уровня структурной организации белковых молекул.
Первичная структура белка — это полипептидная цепь линейной формы из последовательно соединенных пептидной связью аминокислот. (Полипептидную теорию строения белков предложил немецкий химик Э. Фишер в начале XX в.).
В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 α-аминокислот, которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 10. Потенциально возможное число белков с различной первичной структурой практически не ограничено.
Один из первых белков, первичная структура которого была установлена в 1954 г., — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой — 30).
Вторичная структура белка (для большинства белков) — это α-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами: —СО— и —NН—
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Существуют белки, имеющие другие типы вторичной структуры.
Третичная структура белка — пространственная конфигурация спирали.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу». Эта структура поддерживается за счет гидрофобных взаимодействий, а также водородных, дисульфидных, ионных и других связей.
Четвертичная структура белка — способ совместной укладки нескольких полипептидных цепей; образующиеся структуры называются ассоциатами.
Например, гемоглобин (белок крови) — это сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя геммами. В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Физические свойства
Свойства белков так же разнообразны, как и функции, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства
В радикалах аминокислотных остатков белки содержат различные функциональные группы, которые способны вступать во многие реакции. Белки вступают в реакции окисления-восстановления, этерификации, алкилирования, нитрования, могут образовывать соли как с кислотами, так и с основаниями (белки амфотерны).
1. Гидролиз белков:
Конечным продуктом гидролиза белков являются аминокислоты.
2. Осаждение белков:
Осаждение белков бывает обратимое и необратимое.
Обратимое осаждение происходит при добавлении к раствору белка солей Na+, K+, NH4+. Раствор белка становится мутным (белок выпадает в осадок). При добавлении достаточного количества воды раствор белка вновь становится прозрачным.
Необратимое осаждение - денатурация (разрушение третичной и вторичной структур белковых молекул). Например, альбумин — яичный белок — при температуре 60—70° осаждается из раствора (свертывается), теряя способность растворяться в воде.
|
|
| Функции белков в организме | |
Белки являются основой всего живого на Земле и выполняют в организмах многообразные функции.
| 1 . Пластическая | Строительный материал клетки | Белки составляют основу строения клетки: коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки. В комплексе с липидами (преимущественно фосфолипидами) белки участвуют в построении мембран клеток и внутриклеточных образований. |
| 2. Транспортная | При участии белков происходит связывание и доставка (транспорт) различных веществ от одного органа к другому. | Например, гемоглобин (перенос О2 и СО2) Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях |
| 3. Защитная | Белки обеспечивают связывание и обезвреживание веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов. | Белки иммунной системы (иммуноглобулины – ответственные за иммунитет, интерфероны – противовирусные белки), а также белки системы свертывания крови (тромбин, фибриноген). |
| 4. Энергетическая | Снабжают организм энергией. | Большое значение имеют пищевые и запасные белки, которые снабжают организм энергией. При расщеплении 1 г белка освобождается 17,6 кДж энергии |
| 5. Каталитическая | Ускоряют протекание химических реакций в организме. | Все ферменты по своей химической природе являются белками. Ферменты катализируют (ускоряют) реакции: - расщепления сложных молекул (катаболизм) и их синтеза (анаболизм); - репликации и репарации ДНК и синтезе РНК; - фермент пепсин, расщепляют белки в процессе пищеварения. |
| 6. Сократительная | Выполняет все виды движений, к которым способны клетки и организмы. | Сокращение и расслабление сердца, движение других внутренних органов. Сокращение мышц (сгибание, разгибание конечностей). Движение ресничек и жгутиков. |
| 7. Регуляторная | Регулируют обменные процессы. | Гормоны, например, инсулин (обмен глюкозы),который регулирует концентрацию глюкозы в крови и фактор некроза опухолей, и передаёт сигналы воспаления между клетками организма. |
Белки — необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьезные заболевания.
Приложение№2
Мысленный эксперимент Составьте схему, отражающую превращения белков в организме.
Домашнее задание . О.Е. Саенко Химия для колледжей глава 4 , п 2 с 255№3 .
Список использованной литературы
1. О.Е. Саенко Химия для колледжей - Ростов н/Д Феникс,2017



















