Лысенко Ольга Александровна
учитель биологии и химии муниципального общеобразовательного учреждения
«Александровская школа Марьинского района» г. Донецка
lisenkooo@gmail.com
11 класс Урок химии Дата _______
Тема. Летучие водородные соединения неметаллов.
Задачи:
Образовательные: обобщить знания о водородных соединениях неметаллов на основе знаний о строении атома, рассмотреть строение водородных соединений неметаллов, закрепить знания об общих и характерных свойствах водородных соединений.
Развивающие: развитие умений определять химические свойства водородных соединений по их строению, использовать химические знания для охраны природы и здоровья человека.
Воспитательные: воспитывать в себе бережное отношение к природе и к себе, как части природы, изучая губительное действие водородных соединений неметаллов на организм человека; экологическое воспитание.
Ход урока.
-
Организационно-мотивационный момент.
Здравствуйте!
Мы с вами живем в очень сложной экологической обстановке. Миллионы тонн загрязняющих веществ выбрасывается ежегодно в окружающую среду. И наша местность не исключение. Животноводческие и птицеводческие комплексы, комплексы по переработке мяса, агропромышленные предприятия, энергопроизводящие и теплосиловые предприятия, пестициды применяемые в сельском хозяйстве, загрязняют сельскую местность, распространяя на значительные расстояния аммиак, сероводород и другие, имеющие неприятный запах газы.
Сегодня мы рассмотрим вещества, которые с одной стороны необходимы в народном хозяйстве, а с другой стороны опасны для человека и окружающей среды.
Тема нашего урока: «Летучие водородные соединения неметаллов»
Задачи нашего урока:
-
Обобщить знания о водородных соединениях;
-
Узнать, почему необходимо проявлять осторожность при использовании водородных соединений неметаллов;
-
Научиться самостоятельно, проводить исследование.
Актуализация опорных знаний.
Задание 1:
Каков состав водородных соединений, отражаемый химическими формулами по таблице 1:
| Группы элементов | I | II | III | IV | V | VI | VII |
|
| R+1H-1 | R+2H-12 | R+3H-13 | R+4H-14 R-4H+14
| R-3H+13 | H+1 2R-2 | H+1 R-1 |
|
| Нелетучие водородные соединения | Летучие водородные соединения |
Вопросы:
-
Какие водородные соединения вам известны?
-
Какой тип химической связи в летучих водородных соединениях?
-
Какую степень окисления проявляет водород в этих соединения?
-
Как находится степень окисления других неметаллов в этих соединениях?
-
Почему соединения металлов с водородом нелетучие?
-
Какой тип химической связи в них?
(Внимание! Попробуйте ответить на ?? самостоятельно, проверьте свои знания, верьте в себя! ответ ниже приведенный смотрите – если не справитесь с вопросами)
Правильные примерные ответы: К водородным соединениям неметаллов относятся бинарные соединения с ковалентным типом связи элементов IV-VII групп главных подгрупп. Во всех этих соединениях водород проявляет степень окисления +1, а степень окисления неметаллов определяется как разность 8-№ группы. Водородные соединения металлов не летучи, так как образованы ионным типом связи.
Задание 2:
Что вы можете предположить, зная тип связи в веществе?
Вопросы:
-
Какой тип химической связи в летучих водородных соединения?
-
Какой тип кристаллической решетки?
-
Какие частицы расположены в узлах данной решетки?
-
Какими физическими свойствами обладают данные соединения?
Правильные примерные ответы: физические свойства веществ зависят от вида химической связи и типа кристаллической решетки. Так как связь в молекулах водородных соединений ковалентная полярная связь, а в узлах кристаллической решетки лежат полярные молекулы – для этих соединений характерен молекулярный тип кристаллической решетки. Все соединения жидкости или газы, легко растворимы в воде, с низкими температурами кипения, имеющие запах и окраску.
-
Зависимость свойств водородных соединений от положения неметаллов в Периодической системе химических элементов Д.И. Менделеева.
Задание 3: Водородные соединения HCI и NH3 отличаются по свойствам. От чего это зависит?
Таблица 2.
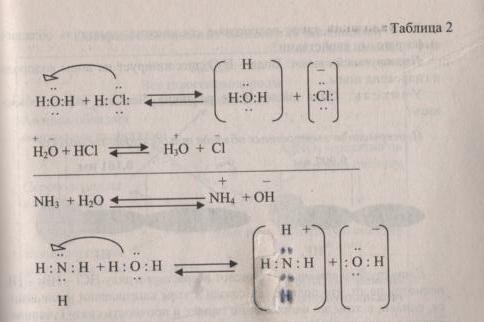
Вопросы:
-
Как растворяются данные вещества в воде?
-
Что образуется при растворении хлороводорода в воде?
-
Что образует аммиак при растворении в воде?
-
Влияет ли полярность связи на растворимость и как?
(Правильные примерные ответы: Исходя из того, что связь в водородных соединениях неметаллов ковалентная полярная, данные соединения хорошо растворимы в воде. Хлороводород при растворении в воде образует соляную кислоту. Она диссоциирует следующим образом: вследствие большой полярности связи H—CI, ион водорода со свободной орбиталью присоединяется к кислороду воды. Водород «приносит» свободную орбиталь- акцептор, а кислород располагает на ней пару электронов- донор. В растворе образуются ионы гидроксония - среда кислая, лакмус красный.
Во втором случае азот принимает от воды водород со свободной орбиталью и в растворе остаются гидроксид ионы. Среда раствора основная, лакмус синий.
Это зависит от силы притяжения электронов последнего электронного уровня ядром атома.
Из двух связей N-H и H-O более полярная - последняя, поэтому не поделенная электронная связь атома азота легче атакует + поляризованный атом водорода в воде, образуя донорно-акцепторную связь.
В случае хлороводорода: связь H-CI более полярная, чем связь O-H, поэтому здесь атаке подвергается протон хлороводорода).
Задание 4:
Какое водородное соединение неметалла обладает амфотерными свойствами? HCI, NH3, H2S, H2O, CH4
Объясните почему?
Ответ:
Задание 5:
Сила кислот в ряду HF, HCI. HBr, HI различна. Чем это можно объяснить? (обратите внимание на рисунок)
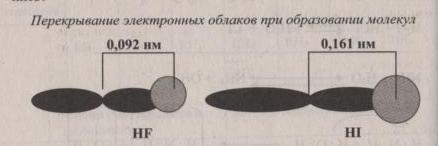
Вопросы:
-
Как изменяется полярность и прочность связи между водородом и галогенами?
-
Как изменяется диссоциация этих веществ?
-
Как изменяется сила кислот в данном ряду?
Ответ:
III. Влияние водородных соединений неметаллов на здоровье человека.
Почему с водородных соединений некоторых неметаллов необходимо обращаться осторожно?! Мы знаем, что все водородные соединения имеют большое практическое значение для народного хозяйства страны. Они используются в производстве минеральных удобрений, синтезе волокон и пластмасс, лекарственных средств и т.д. Вода – вообще основа жизни на земле. Но некоторые из них чрезвычайно ядовиты! Информацию о таких веществах можно получить из следующих сообщений:
Сообщение «Соляная кислота»
Свободная соляная кислота содержится в желудочном соке и играет важную роль, так как, с одной стороны, способствует перевариванию пищи, с другой стороны - убивает различные болезнетворные бактерии (холеры, чумы и др.). Если последние попадают в желудок вместе с большим количеством воды, то вследствие разбавления раствора соляной кислоты, они выживают и вызывают заболевания организма. Поэтому во время эпидемий особенно опасна сырая вода. При повышенной концентрации соляной кислоты в желудке ощущается «изжога», которую устраняют, принимая во внутрь небольшое количество гидрокарбоната натрия или оксида магния. Наоборот, при недостаточной кислотности желудочного сока, для приема внутрь приписывается разбавленный раствор соляной кислоты.
Содержание в воздухе уже 0,05 мг/л хлороводорода быстро вызывает раздражение в носу и гортани, боль в груди, хрипоту и ощущение удушья в горле. При хроническом отравлении малыми его концентрациями (порядка 0,01 мг/л) особенно страдают зубы, эмаль которых подвергается более или менее быстрому разрушению.
Сообщение «Сероводород»
Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения достаточных мер предосторожности. Между тем уже 0,1% сероводорода в воздухе быстро вызывает тяжелое заболевание. При вдыхании сероводорода в значительных концентрациях. Может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания (если пострадавший не был своевременно удален из отравленной атмосферы). В случае меньших концентраций сероводорода, внезапные обмороки часто наступают лишь через некоторое время после отравления. Тяжело отравленным сероводородом дают вдыхать чистый кислород. При слабой и неправильной работе дыхательных органов приходится применять искусственное дыхание. Хроническое отравление малыми количествами сероводорода обуславливает общее ухудшение самочувствия, исхудание, появление головных болей.
Домашнее задание. Учить § 40 (составить краткий конспект); ситуационная задача:
Целлюлозно-бумажный комбинат произвел сброс сточных вод. Вычислите объем хлора (н.у.), необходимого для очистки 1000 м3 сточных вод от сероводорода. Концентрация сероводорода в сточных водах 0,05 мг/л.
H2S + CI2 = S + 2HCI.
Творческое задание: подготовить сообщение «Аммиак».
Рефлексия
В ходе урока вы пытались овладеть самым главным в процессе познания – умением находить истину с помощью доказательств, то есть проводить исследования. Многие ученые прошлых веков опирались в своих изысканиях лишь на интуицию и в результате нередко ошибались.
Вы же, опирались на свои знания и умения, развивали свои навыки в поиске истины. Молодцы!
1. Сегодня я понял …
2. Теперь я могу…
3. Я приобрел….
Благодарю за старания! Будьте ЗДОРОВЫ!




























