

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Методические рекомендации студентам к теоретическим занятиям на дистанционном обучении по дисциплине ОУП 11. Химия Раздел «Неметаллы» Специальность 34.02.01 Сестринское дело
Методические указания содержат задания для организации самостоятельной работы обучающихся на дистанционном обучении.
Владение знаниями темы для обучающихся является средством формирования учебно-исследовательских умений, расширения своих знаний в других предметных областях. Педагогической целью является не только развитие навыков обучающихся по химии, но и навыков самостоятельной работы с литературой для дальнейшего самообразования.
Все это способствует оптимальному формированию общих и профессиональных компетенций.
Просмотр содержимого документа
«Методические рекомендации студентам к теоретическим занятиям на дистанционном обучении по дисциплине ОУП 11. Химия Раздел «Неметаллы» Специальность 34.02.01 Сестринское дело»
Государственное бюджетное профессиональное образовательное учреждение «Самарский медицинский колледж им Н. Ляпиной»
Филиал «Борский»
Методические рекомендации
студентам к теоретическим занятиям на дистанционном обучении
по дисциплине ОУП 11. Химия
Раздел «Неметаллы»
Специальность 34.02.01 Сестринское дело
Борское, 2021 год
| ОДОБРЕНА Цикловой методической комиссией ОУП, ОГСЭ, ЕН Протокол № ________ «_____» _____________20___г. Председатель ЦМК __________ /О.В. Иванова/
| Составлена в соответствии с Государственными требованиями к минимуму содержания и уровню подготовки выпускника по специальности зав. отделом по УР ______ /З.Р.Рахматуллина/ |
Рассмотрена и утверждена
На заседании методического совета
Протокол № _________
«__________» __________20____г
Председатель _____________/А.А. Зенин/
Составитель: Иванова О.В. - преподаватель Филиала «Борский» ГБПОУ «СМК им Н. Ляпиной» первой категории дисциплины ОУП.10 Химия
Аннотация
Данные рекомендации предназначены студентам. Методические рекомендации выполнены в соответствии с требованиями Федерального государственного образовательного стандарта среднего профессионального образования по специальности 34.02.01 Сестринское дело и рабочей программы по дисциплине ОУП.10 Химия. Рекомендовано для использования преподавателями в учебном процессе студентов, обучающихся в медицинском колледже по специальностям 34.02.01 Сестринское дело. Могут быть использованы преподавателями химии для подготовки к занятиям на дистанционном обучении.
СОДЕРЖАНИЕ
Пояснительная записка ........................................................................... .............3
Тема «Подгруппа углерода» ............................................................................. .6
Тема «Подгруппа азота».........................................................................................8
Тема «Подгруппа кислорода»....................................................................... ......10
Тема» «Галогены».................................................................................................12
Тема «Решение задач на прмеси»........................................................................14
Тема «Решение задач на выход продукта».........................................................17
Тема «Обобщение знаний. Решение задач и упражнений по разделу «Неметаллы»..........................................................................................................19
Тема «контроль знаний по разделу «Неметаллы»..............................................20
Приложение............................................................................................................21Ссылки на использованные сайты.......................................................................27
Пояснительная записка
Химических элементов-неметаллов всего 16. Совсем немного, если учесть, что известно 114 элементов, два элемента-неметалла составляют 76% от массы земной коры. Это кислород (49%) и кремний (27%). В атмосфере содержится 0,03 % от массы кислорода в земной коре. Неметаллы составляют 98,5% от массы растений, 97,6% от массы тела человека. Шесть неметаллов – углерод, водород, кислород, азот, фосфор и сера – биогенные элементы, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы и нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами. Водород – главный элемент Вселенной. Такой необходимый микроэлемент, как сера, в организме человека выступает в роли минерала красоты, так как благодаря ей, кожа, ногти и волосы, будут оставаться здоровыми. Анионы хлора также играют важную биологическую роль для человека, так как принимают участие в активизации некоторых ферментов. С их помощью поддерживается благоприятная среда в желудке и поддерживается осмотическое давление. Неметаллы и их соединения широко используют в медицине. Кислород применяют в тех случаях, когда у больного затруднено дыхание. Активированный уголь есть почти в каждой домашней аптечке. Точно так же, как иодная тинктура — спиртовой раствор иода. Мази, в состав которых входит сера, используются при лечении кожных заболеваний. Жидкий азот используют не только для хранения биологического материала, но и в косметической медицине. При обработке ран и для остановки мелких кровотечений используют трех процентный раствор перекиси водорода.
Знание свойств неметаллов, особенностей их применения позволит расширить кругозор, приобрести новые знания о возможностях их использования в медицине, поможет медицинскому работнику организовывать собственную деятельность для эффективного выполнения профессиональных задач.
Выполнение самостоятельной работы по решению упражнений позволяет продолжить формирование умения организовывать собственную деятельность, выбирая типовые методы и способы выполнения заданий, оценивать качество их выполнения.
Методические указания содержат задания для организации самостоятельной работы обучающихся на дистанционном обучении.
Владение знаниями темы для обучающихся является средством формирования учебно-исследовательских умений, расширения своих знаний в других предметных областях. Педагогической целью является не только развитие навыков обучающихся по анатомии и физиологии, но и навыков самостоятельной работы с литературой для дальнейшего самообразования.
Все это способствует оптимальному формированию общих и профессиональных компетенций.
ЦЕЛИ ЗАНЯТИЙ
1. Учебные цели:
- продолжить формирование знаний о положении неметаллов в П. С., физических и химических свойствах неметаллов, водороде, его соединениях, аллотропии, кислороде, озоне, сере и её соединениях, азоте и его соединениях, фосфоре и его соединениях, углероде и его соединениях, кремнии, оксиде кремния, силикатах, пространственном строении молекул неметаллов. Продолжить формирование умений определять валентности и степени окисления неметаллов, окислителей и восстановителей, формирование умений характеризовать общие химические свойства неметаллов, объяснять зависимость свойств химического элемента и образованных им веществ от положения в П.С.
2. Развивающие цели:
- развивать логическое мышление, внимание, память, умение осуществлять самостоятельный поиск информации в различных источниках, организовывать собственную деятельность, необходимую для выполнения профессиональных задач.
3. Воспитательные цели:
- создавать содержательные и организационные условия для развития самостоятельности в добывании студентами знаний, скорости восприятия и переработки информации, культуры речи, воспитании настойчивости в достижении цели, формирование способности организовывать собственную деятельность при выполнении упражнений, работе с текстом учебника.
Результаты освоения учебной дисциплины, подлежащие проверке по разделу «Неметаллы»
Результатом освоения учебной дисциплины являются освоенные умения и усвоенные знания, направленные на формирование общих и профессиональных компетенций.
В результате освоения учебной дисциплины обучающийся должен:
уметь:
У.1. называть: изученные вещества
У.2. определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам неорганических веществ; типы реакций в неорганической химии.
У.3. характеризовать: s-, p-, d- элементы по их положению в Периодической системе Д.И. Менделеева; общие химические свойства неметаллов.
У.4. объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
У.6. проводить расчеты по химическим формулам и уравнениям реакций;
У.7. осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
У.8. использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
• для понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
• объяснения химических явлений, происходящих в природе, быту и на производстве;
• экологически грамотного поведения в окружающей среде;
• оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
• безопасной работы с веществами в лаборатории, быту и на производстве;
• определения возможности протекания химических превращений в различных условиях и оценки их последствий;
• распознавания и идентификации важнейших веществ и материалов;
• оценки качества питьевой воды и отдельных пищевых продуктов;
• критической оценки достоверности химической информации, поступающей из различных источников.
знать:
З.1. роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
З.2. важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, окисление и восстановление.
З.4. основные теории химии: строение атома, химической связи, электролитической диссоциации кислот и оснований, строения органических и неорганических соединений, химическую кинетику и химическую термодинамику;
З.5. классификацию и номенклатуру неорганических соединений;
З.7. вещества и материалы, широко используемые в практике: основные неметаллы. Формируемые компетенции:
Медицинская сестра/Медицинский брат (базовой подготовки) должен обладать общими компетенциями, включающими в себя способность:
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать и осуществлять повышение квалификации.
ОК 9. Ориентироваться в условиях смены технологий в профессиональной деятельности.
ОК 10. Бережно относиться к историческому наследию и культурным традициям народа, уважать социальные, культурные и религиозные различия.
ОК 11. Быть готовым брать на себя нравственные обязательства по отношению к природе, обществу и человеку.
ОК 12. Организовывать рабочее место с соблюдением требований охраны труда, производственной санитарии, инфекционной и противопожарной безопасности.
ОК 13. Вести здоровый образ жизни, заниматься физической культурой и спортом для укрепления здоровья, достижения жизненных и профессиональных целей.
ТЕМА: «ПОДГРУППА УГЛЕРОДА»
Цели урока:
Образовательные. Формирование компетенций по теме: положение элементов подгруппы углерода в периодической системе, изменение свойств элементов и образуемых ими соединений, химический элемент углерод и образуемые им простые вещества, их свойства, применение. Формирование универсальных учебных действий.
Развивающие. Умение работать с периодической системой, устанавливать взаимосвязь между положением элемента в Периодической системе, строением атома и свойствами образуемых им веществ.
Развитие навыков ученического эксперимента.
Воспитательные. Формирование культуры общения. Вклад российских ученых в изучение химии углерода и его соединений.
Задачи урока:
Изучить электронное строение атома углерода, строение кристаллических решеток аллотропных модификаций углерода – алмаза, графита, карбина, фуллерена, их физические свойства, химические свойства углерода.
Сформировать понятия: « адсорбция», «адсорбент», «десорбция».
Актуализировать связь между строением вещества, его свойствами и применением.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
1.Посмотреть видеоролики по ссылке:
Урок 17. https://resh.edu.ru/subject/lesson/2072/start/
Урок 18. https://resh.edu.ru/subject/lesson/2071/start/
Урок 19 https://resh.edu.ru/subject/lesson/2070/start/
Урок 20 https://resh.edu.ru/subject/lesson/2069/start/
Видеоопыты:
1Получение углекислого газа https://drive.google.com/file/d/0B5ux5Pgt5WdKVzZIYnY0Q0JLaHM/view?resourcekey=0-bdMR7y1R8mqyonm8e-klyA
2. Химические свойства углекислого газа https://drive.google.com/file/d/0B5ux5Pgt5WdKempGOG1HdXY4RFU/view?resourcekey=0--Royr34pOZZGkR4P9JP1aA
3.получение угольной кислоты
https://drive.google.com/file/d/0B5ux5Pgt5WdKMXdYMEtycl81bXc/view
4.Распознование растворов хлорида натрия, карбоната натрия и сульфата натрия
https://drive.google.com/file/d/0B5ux5Pgt5WdKdWYyYjhQVFhqSlU/view?resourcekey=0-JCS_UqZqtFylqRgL5hmgEg
5. Взаимодействие кремния со щелочами
https://drive.google.com/file/d/0B5ux5Pgt5WdKRnpaN0xwaTlUejA/view?resourcekey=0-rwr2HnOwggKvSrcyP_vB9w
2. Используя видеоуроки, видеоопыты и материал учебника https://s.11klasov.net/15825-himija-9-klass-rudzitis-ge-feldman-fg.html стр. 111-137
составить конспект «Общая характеристика элементов подгруппы углерода» по плану:
Положение в периодической таблице, строение атома.
Аллотропия и аллотропные видоизменения углерода.
Химические свойства углерода.
Адсорбция и десорбция ( определения записать).
Соединения углерода (оксиды углерода, угольная кислота и её соли - строение молекул, получение, химические свойства, применение).
Записать, как можно в лаборатории распознать карбонаты.
3. Выполнить тренировочные задания уроков 18-20 https://resh.edu.ru/subject/lesson/2071/train/#208449
Выполненные в рабочей тетради задания ( конспект и ответы на тренировочные тесты) присылать в группу в контакте https://vk.com/id430426807
4.Домашнее задание: https://docs.google.com/viewer?url=https%3A%2F%2F11klasov.net%2Findex.php%3Fdo%3Ddownload%26id%3D19370%26viewonline%3D1
Выполнить задание стр 64. Тренировочная работа 11, № 1,2,4,; тренировочная работа 12, №1-6,
ТЕМА: «ПОДГРУППА АЗОТА »
Цели урока:
Образовательные. Формирование компетенций по теме: положение элементов подгруппы азота в периодической системе, изменение свойств элементов и образуемых ими соединений, химический элемент азот и образуемые им простые вещества, их свойства, применение. Формирование универсальных учебных действий.
Развивающие. Умение работать с периодической системой, устанавливать взаимосвязь между положением элемента в Периодической системе, строением атома и свойствами образуемых им веществ.
Воспитательные. Формирование культуры общения. Вклад российских ученых в изучение химии углерода и его соединений.
Задачи урока:
Изучить электронное строение атома азота, химические свойства азота и его соединений.
Актуализировать связь между строением вещества, его свойствами и применением.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
Посмотреть видео уроки с 14. по 16
https://resh.edu.ru/subject/lesson/2078/start/
Видео опыты
https://www.sites.google.com/site/videoopytypohimii/neorganiceskaa-himia/podgruppa-azota
Взаимодействие аммиака с концентрированными кислотами
Качественная реакция на аммиак
Получение азота разложением нитрита аммония
Получение аммиака
Взаимодействие безводной азотной кислоты с белым фосфором
Взаимодействие безводной азотной кислоты с углем\
Окислительные свойства азотной кислоты
Распознавание растворов соляной, азотной и серной кислот (практическая работа)
Термическое разложение нитрата калия
Качественная реакция на фосфат-ион
Превращение красного фосфора в белый
Распознавание растворов фосфата натрия, нитрата аммония и нитрата натрия (практическая работа)
Свечение белого фосфора в темноте
Используя видеоуроки, видеоопыты и материал учебника
https://s.11klasov.net/15825-himija-9-klass-rudzitis-ge-feldman-fg.html
стр. 80-106
составить конспект «Общая характеристика элементов подгруппы азота» по плану:
Положение в периодической таблице, строение атома.
Аллотропия и аллотропные видоизменения фосфора.
Химические свойства азота и фосфора.
Соединения азота и фосфора (оксиды, кислоты и их соли - строение молекул, получение, химические свойства, применение).
Записать, как можно в лаборатории распознать нитрат и фосфат -ионы.
3. Выполнить тренировочные задания уроков 14-16 https://resh.edu.ru/subject/lesson/2071/train/#208449
Выполненные в рабочей тетради задания ( конспект и ответы на тренировочные тесты) присылать в группу в контакте https://vk.com/id430426807
4.Домашнее задание: https://docs.google.com/viewer?url=https%3A%2F%2F11klasov.net%2Findex.php%3Fdo%3Ddownload%26id%3D19370%26viewonline%3D1
Выполнить задание стр 58. Тренировочная работа №8 упр1-5, №9 упр3,4,6; тренировочная работа №10, упр4,
ТЕМА: «ПОДГРУППА КИСЛОРОДА »
Цели урока:
Образовательные. Формирование компетенций по теме: положение элементов подгруппы серы в периодической системе, изменение свойств элементов и образуемых ими соединений, химический элемент сера и образуемые им простые вещества, их свойства, применение. Формирование универсальных учебных действий.
Развивающие. Умение работать с периодической системой, устанавливать взаимосвязь между положением элемента в Периодической системе, строением атома и свойствами образуемых им веществ.
Воспитательные. Формирование культуры общения. Вклад российских ученых в изучение химии углерода и его соединений.
Задачи урока:
Изучить электронное строение атома серы, химические свойства серы и её соединений.
Актуализировать связь между строением вещества, его свойствами и применением.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
Посмотреть видео уроки с 11 по 13
https://resh.edu.ru/subject/lesson/2434/start/
Видео опыты
https://www.sites.google.com/site/videoopytypohimii/neorganiceskaa-himia/podgruppa-kisloroda
Горение серы в кислороде
Горение углерода в кислороде
Горение фосфора в кислороде
Получение кислорода
Получение озона и его определение
Взаимодействие серы с медью
Взаимодействие серы с натрием
Взаимодействие серы с цинком
Получение пластической серы
Получение сероводорода и получение его свойств
Взаимодействие серной кислоты с металлами
Разбавление серной кислоты
Реакция серной кислоты с органическими веществами
Качественная реакция на сульфат- и сульфит-ионы
Распознавание растворов хлорида бария, сульфата натрия и серной кислотыПолучение сернистой кислоты
Свойства сернистой кислоты
Используя видеоуроки, видеоопыты и материал учебника
https://s.11klasov.net/15825-himija-9-klass-rudzitis-ge-feldman-fg.html
стр. 61-79
составить конспект «Общая характеристика элементов подгруппы кислорода» по плану:
Положение в периодической таблице, строение атома.
Аллотропия и аллотропные видоизменения кислорода и серы.
Химические свойства кислорода, серы
Соединения серы (оксиды, кислоты и их соли - строение молекул, получение, химические свойства, применение).
Записать, как можно в лаборатории распознать сульфат -ионы.
3. Выполнить тренировочные задания уроков 11-13 https://resh.edu.ru/subject/lesson/2434/train/#194941
Выполненные в рабочей тетради задания ( конспект и ответы на тренировочные тесты) присылать в группу в контакте https://vk.com/id430426807
4.Домашнее задание: https://docs.google.com/viewer?url=https%3A%2F%2F11klasov.net%2Findex.php%3Fdo%3Ddownload%26id%3D19370%26viewonline%3D1
Выполнить задание стр 54. Тренировочная работа №6 упр 2,4,5,6, №7 упр1,2,5,6; тренировочная работа № 8 , упр3,
ТЕМА: «ГАЛОГЕНЫ »
Цели урока:
Образовательные. Формирование компетенций по теме: положение элементов в периодической системе, изменение свойств элементов и образуемых ими соединений, химический элемент сера и образуемые им простые вещества, их свойства, применение. Формирование универсальных учебных действий.
Развивающие. Умение работать с периодической системой, устанавливать взаимосвязь между положением элемента в Периодической системе, строением атома и свойствами образуемых им веществ.
Воспитательные. Формирование культуры общения. Вклад российских ученых в изучение химии углерода и его соединений.
Задачи урока:
Изучить электронное строение атома серы, химические свойства серы и её соединений.
Актуализировать связь между строением вещества, его свойствами и применением.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
Посмотреть видео урок10
https://resh.edu.ru/subject/lesson/2075/start/
Видео опыты
https://www.sites.google.com/site/videoopytypohimii/neorganiceskaa-himia/galogeny
Взаимодействие брома с алюминием
Взаимодействие галогенидов с бромной водой
Качественные реакции не хлорид-, бромид-, иодид-ионы
Распознавание растворов хлорида натрия, бромида натрия и йодида калия (практическая работа)
Взаимодействие хлора с водородом
Взаимодействие хлора с железом
Взаимодействие хлора с калием
Взаимодействие хлора с медью
Взаимодействие хлора с органическими красителями
Взаимодействие хлора с фосфором
Получение соляной кислоты (практическая работа)
Получение хлора и растворение его в воде
Возгонка йода
Качественная реакция на йод
Получение йодида алюминия
Растворимость йода в воде и спирте
Используя видеоуроки, видеоопыты и материал учебника
https://s.11klasov.net/15825-himija-9-klass-rudzitis-ge-feldman-fg.html
стр. 43-59
составить конспект «Общая характеристика галогенов» по плану:
Положение в периодической таблице, строение атома.
Химические свойства галогенов
Соляная кислота и её соли - строение молекул, получение, химические свойства, применение).
Записать, как можно в лаборатории распознать хлорид, бромид, иодид -ионы.
3. Выполнить тренировочные задания уроков 10 https://resh.edu.ru/subject/lesson/2075/train/#195017
Выполненные в рабочей тетради задания ( конспект и ответы на тренировочные тесты) присылать в группу в контакте https://vk.com/id430426807
4.Домашнее задание: https://docs.google.com/viewer?url=https%3A%2F%2F11klasov.net%2Findex.php%3Fdo%3Ddownload%26id%3D19370%26viewonline%3D1
Выполнить задание стр 52. Тренировочная работа №5 упр 1,3,4,5
ТЕМА: «РЕШЕНИЕ ЗАДАЧ НА ПРИМЕСИ »
Цели урока: научиться решать задачи на примеси
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
Посмотреть видео
https://www.youtube.com/watch?v=VAu9J5xyOXA
и https://www.youtube.com/watch?v=68hrx1_wnjo
Внимательно прочитать и записать тетрадь.
Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего определенную массовую долю примесей (в %)
При решении задач этого типа необходимо вначале рассчитать массу или объем чистого вещества, которое содержится в исходной смеси, а потом решать как обычную задачу по химическому уравнению. Массу чистого вещества (как и объем) можно вычислить двумя способами.
С п о с о б 1. Массу чистого вещества (или объем) определяют по формуле:
w (чист. в-ва) = 100 % – w (примеси),
w (чист. в-ва) = ![]()
m (чист. в-ва) = m (смеси) · w (чист. в-ва)
Способ 2. Вначале определяют массу примеси:
m (примеси) = m (смеси) · w (примеси), а затем вычитают ее из массы смеси: m (чист. в-ва) = m (смеси) – m (примеси).
Алгоритм решения задач на примеси.
I. Определение массы (объема) вещества по известной массе другого вещества, содержащего определенную долю примесей.
Помните: 1.Особенность данного типа задач в том, что сначала необходимо вычислить массу чистого вещества в смеси.
2. В условии задачи в роли смеси может выступать руда, технический образец вещества, раствор.
Порядок решения задачи:
1) Прочитайте задачу, запишите краткое условие.
2) Определите массу чистого вещества по формуле: mв-ва= mсмеси * ωв-ва.
3) Напишите уравнение реакции.
4) Найдите количества веществ, данных в задаче, по уравнению и по условию.
5) Произведите необходимые расчёты и запишите ответ.
Образец решения:
Рассчитайте объем водорода, выделившегося при взаимодействии с соляной кислотой 325 г цинка, содержащего 20% примесей.
Д а н о: Р е ш е н и е:
 mтехнич.(Zn)= 325 г 1) mтехнич.(Zn)= 325 г
mтехнич.(Zn)= 325 г 1) mтехнич.(Zn)= 325 г
ω (Zn)= 100%-20%=80% (0,8);
ωприм.= 20% (0,2) ωприм.= 20% (0,2) m (Zn)= 325 * 0,8 = 260 г
V(Н2)= ? n (Zn) = 260г : 65 г/моль = 4 моль.
 по условию: 4 моль Х моль
по условию: 4 моль Х моль
2) Zn + 2HCl = ZnCl2 + H2
по уравнению: 1 моль 1 моль
Х= 4 моль
V(Н2) = Vm * n(Н2); V(Н2) = 22,4 л/моль * 4 моль = 89,6 л.
Ответ: V(Н2) =89,6 л.
Алгоритм
решения задач на примеси.
II. Определение массовой доли примесей (или массовой доли чистого вещества в смеси) по массе (объёму) продуктов реакции.
Помните: 1) сначала выполняются действия по уравнению реакции;
2) для определения массовой доли примесей применяем формулу:
ωприм. = mприм./mсмеси.
Порядок решения задачи:
1) Прочитайте задачу, запишите краткое условие.
2) Составьте уравнение химической реакции.
3) Рассчитайте массу чистого вещества, необходимого для реакции по уравнению реакции.
4) Вычислите массу примесей в образце по условию.
5) Вычислите массовую долю примесей по формуле: ωприм. = mприм./mсмеси.
Образец решения:
Определите массовую долю примесей в техническом образце карбида кальция, если из 200 г его получили 56 л ацетилена.
Д а н о: Р е ш е н и е: пусть х г – масса чистого вещества CaC2.
mтехнич.(CaC2)=200г 1)по условию: х г 56л
 V(С2Н2) = 56 л CaC2 + 2Н2О = С2Н2 + Са(ОН)2
V(С2Н2) = 56 л CaC2 + 2Н2О = С2Н2 + Са(ОН)2
ωприм = ? 1 моль 1 моль
= ? 1 моль 1 моль
М=64г/моль Vm=22.4л/моль
по уравнению: m=64 г V= 22,4 л ,
тогда х г/64 г= 56 л/22,4 л; х = 160 г.
2) определяем массу примесей в образце:
mприм.= 200 – 160 = 40 г.
3) определяем массовую долю примесей:
ωприм = 40 г/ 200 г = 0,2 (или 20%).
Ответ: ωприм = 20%.
3.Используя образец решения решить самостоятельно задачи .
Образец решения:
Рассчитайте объем водорода, выделившегося при взаимодействии с соляной кислотой 162,5г цинка, содержащего 10% примесей.
Д а н о: Р е ш е н и е:
 mтехнич.(Zn)= 162,5г ω (Zn)= 100%-10%=90% (0,9);
mтехнич.(Zn)= 162,5г ω (Zn)= 100%-10%=90% (0,9);
ωприм.= 10% (0,1) m (Zn)= 162,5г * 0,9 = 146,25 г
V(Н2)= ? n (Zn) = 146,25г : 65 г/моль = 2,25 моль.
 по условию: 2,25 моль Х моль
по условию: 2,25 моль Х моль
2) Zn + 2HCl = ZnCl2 + H2
по уравнению: 1 моль 1 моль
Х= 4 моль
V(Н2) = Vm * n(Н2); V(Н2) = 22,4 л/моль * 2,25 моль = 50,4 л.
Ответ: V(Н2) = 50,4 л.
Задачи для самостоятельного решения:
1.Вычислите массу оксида кальция и объём углекислого газа, которые образуются при обжиге 250 грамм карбоната кальция, содержащего 10% примесей.
2.Какой объём оксида углерода (IV) выделится при сжигании 50 килограмм угля (С), содержащего 8% примесей ?
Решение задач отправить в группу, а также идёт по видео звонку и аудио обсуждение ошибок и вопросов при решении и оформлении задач
4. Домашнее задание:
3.Рассчитайте массу хлорида железа (III), который образуется при взаимодействии соляной кислоты с 60 граммами оксида железа (III), содержащего 20% примесей.
4.Какой объём оксида серы (IV) образуется при сжигании 20 килограмм цинковой обманки (сульфид цинка), содержащей 80% сульфид цинка ?
ТЕМА: «РЕШЕНИЕ ЗАДАЧ НА ВЫХОД ПРОДУКТА »
Цели урока: научиться решать задачи данного типа
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
Посмотреть видео
https://www.youtube.com/watch?v=4XFKdy5Wj8U
и https://www.youtube.com/watch?v=68hrx1_wnjo
Внимательно прочитать и записать тетрадь.
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой (эта), измеряется в процентах или долях.
m практическая х100%
= m теоретичееская
V практический х100%
= V теоретичееский
Алгоритм решения задач.
Составьте краткое условие задачи.
Составьте уравнение реакции, расставьте коэффициенты.
Подпишите над формулами веществ известные величины( массу или объем), неизвестную обозначьте как х.
Найдите неизвестную величину(массу или объем), используя метод пропорции- это будет теоретическая mилиv.
Определите практический выход продукта реакции по формуле
| η = mпракт. / m теор. или |
Запишите ответ.
Расчёт выхода продукта реакции по отношению к теоретически возможному.
Помните: первым действием в решении задачи является определение массы (объема, количества вещества) продукта реакции по уравнению и исходным данным.
| Порядок действий (пошаговый): | Пример: Определите выход продукта реакции синтеза аммиака, если при взаимодействии 6,72 л азота с избытком водорода получено 6,72 л аммиака. |
| I.Запишите краткое условие задачи и уравнение химической реакции, подчеркните вещества, о которых идет речь в задаче. Переведите массу (объем) известного исходного вещества (реагента) в количество (моли): n = m : M (n = V : Vm) | Д а н о : Решение: V(N2) = 6.72 л N2 + 3 H2 = 2 NH3 Vпракт.(NH3)=6.72 л 1 моль 2 моль φ (NH3) = ? n (N2) = 6.72 л : 22.4 л/моль = 0,3 моль |
| II.Определите количество продукта по уравнению реакции. Т.е. теоретически возможное (если бы выход реакции составлял бы 100%) . | По уравнению: 1 моль (N2) → 2 моль (NH3) Следовательно: 0,3 моль (N2) → 0,6 моль(NH3) nтеорет. (NH3) = 0.6 моль (или 13,44 л) |
| III.Определите, какую часть от теоретически возможного составляет практически полученная по условию масса (объем, количество) продукта. Воспользуйтесь формулой: η = mпракт. / mтеор. или φ = Vпракт./Vтеор. Запишите ответ. | Обратите внимание: Vпракт./Vтеор = nпракт. / nтеорет. = φ nпракт.(NH3) = 6.72 л : 22.4 л/моль = 0,3 моль φ (NH3) = 0,3моль (6,72 л) : 0,6моль (13,44л) = 0,5 (50%) Ответ:φ (NH3) = 50%. |
Решить самостоятельно задачи:
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Решение задач отправить в группу, а также идёт по видео звонку и аудио обсуждение ошибок и вопросов при решении и оформлении задач
Домашнее задание:
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
ТЕМА: «ОБОБЩЕНИЕ ЗНАНИЙ И РЕШЕНИЕ ЗАДАЧ И УПРАЖНЕНИЙ ПО РАЗДЕЛУ «НЕМЕТАЛЛЫ» »
Цели урока: обобщить и закрепить знания обучающихся, полученные при изучении темы «Неметаллические элементы и их соединения»; продолжить формировать умения составлять уравнения реакций, которые характеризуют основные химические свойства неметаллических элементов и их соединений, навыки составлять уравнения окислительно-восстановительных, ионных реакций, а также решения качественных задач и расчетных задач на избыток и недостаток.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
1. Посмотреть видео
https://resh.edu.ru/subject/lesson/2068/main/
Выполнить задания из рабочей тетради:
https://s.11klasov.net/8684-himija-9-klass-rabochaja-tetrad-gabruseva-ni.html
Работа «Кислород и сера» стр 17, упр 40,41,44,45,46,48; стр 22 тестовое задание 1 вариант,
Работа «Азот и фосфор» стр 24, упр 58,59,61,63,65,67,71,76, тестовой задание 1 вариант стр 33,
Работа «Углерод и кремний» стр 35, упр 87,88,94 ,95,103, тестовое задание стр 45, 1 вариант,
Выполнить задания, тренировочный тест https://resh.edu.ru/subject/lesson/2068/train/#208494
и отправить в группу в контакте.
ТЕМА: «КОНТРОЛЬ ЗНАНИЙ ПО РАЗДЕЛУ «НЕМЕТАЛЛЫ»
Цели урока: проверить знания и умения обучающихся по изученным темам, выявить проблемы в знаниях для дальнейшей коррекции.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА
Галогены : https://onlinetestpad.com/ru/test/2676-test-po-teme-galogeny-variant-1
https://onlinetestpad.com/ru/test/2677-test-po-teme-galogeny-variant-2
Подгруппа кислорода: https://pencup.ru/test/1668
https://onlinetestpad.com/ru/test/1777-sera-i-ee-soedineniya
Подгруппа азота https://pencup.ru/test/1684
https://onlinetestpad.com/ru/testview/653317-khimiya-9-klass-azot-i-ego-svojstva
Подгруппа углерода https://onlinetestpad.com/ru/test/286026-uglerod-i-ego-soedineniya
Обобщающий тест по разделу « Неметаллы»
https://pencup.ru/test/1629
https://onlinetestpad.com/ru/test/87246-nemetally
Время прохождения всех тестов 60 минут. Фотографии результатов отправляются преподавателю в группу в контакте с название теста. Выставляется средняя оценка по всем тестам.
Критерии оценивания тестовых контрольных работ.
Шкала перевода в пятибалльную систему оценки
Отметка «5» ставится за выполнение 90-100% работы.
Отметка «4» ставится за выполнение 70-89 % работы;
Отметка «3» ставится за выполнение 50-69%
Отметка «2» ставится за выполнение менее 50%,
Приложение1.
СПРАВОЧНЫЙ МАТЕРИАЛ.
Неметаллы в природе
Из 118 известных на данный момент химических элементов 96 являются металлическими, и только 22 химических элемента относятся к неметаллическим.
Неметаллические химические элементы широко распространены в земной коре.
Кислород и кремний составляют около 76 % (практически три четверти) от массы земной коры (O2 — 49,4 %, Si — 25,8 %).
А люминий Al — 7,5 %.
люминий Al — 7,5 %.
Железо Fe — 4,7 %.
Кальций Ca — 3,4 %.
Натрий Na — 2,6 %.
Калий K — 2,4 %.
Магний Mg — 1,9 %.
Водород H — 0,9 %.
Титан Ti — 0,9 %.
Рис. 1. Содержание химических элементов в земной коре

Такие химические элементы, как углерод C, водород H, кислород O, азот N, фосфор P и сера S, составляют 98,5 % от массы растений и 97,6 % от массы тела человека.
Рис. 2. Содержание химических элементов в теле человека
На долю неметаллических химических элементов приходится большая часть массы живых организмов.
В состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
В объёмных долях на азот N2 приходится 78 %, на кислород O2 — 21 %, а инертные газы составляют 0,96 % от объёма воздуха. В состав земной атмосферы также постоянно входит углекислый газ CO2, доля которого (по разным оценкам) составляет около 0,04 % от состава чистого воздуха.
Следует иметь в виду, что в воздухе постоянно содержится водяной пар H2O и другие соединения неметаллов, доля которых не является постоянной.
Неметаллические химические элементы образуют большую часть веществ, входящих в состав воздух
Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т. д. И на нашей планете из каждых 100 атомов 17 — это атомы водорода.
Положение элементов неметаллов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов неметаллы занимают правый верхний угол и находятся только в главных (А) группах.
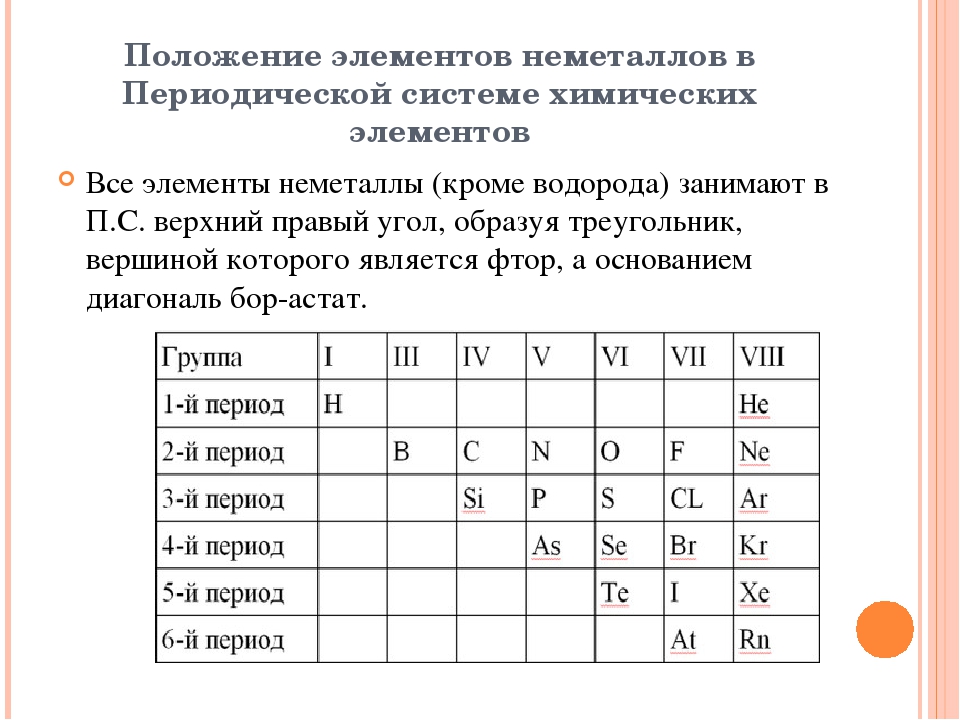
Рис. 4. Положение неметаллов в периодической системе
В электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как правило, содержится от 4 до 8 электронов. Исключение составляют только водород H, у которого в электронной оболочке атома вообще только один электрон, гелий He с двумя электронами и бор B, у которого на наружном энергетическом уровне имеются три электрона.
Радиусы атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу близости положительно заряженного ядра атома неметаллы хорошо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
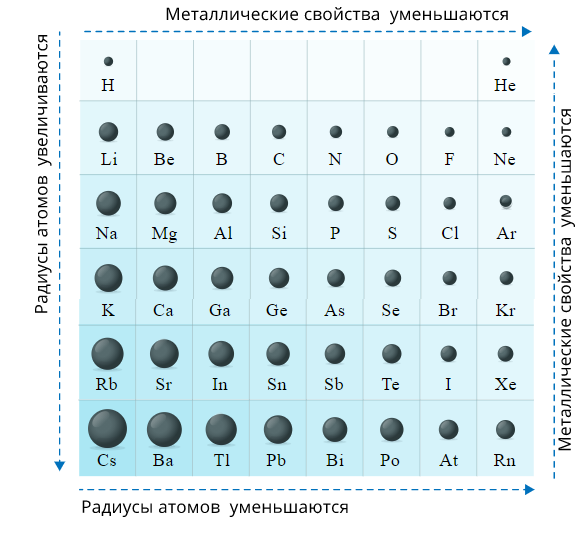
Рис. 5. Характер изменения радиусов атомов химических элементов в периодах и в группах
Радиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде.
Главное отличительное свойство неметаллов — это их высокая электроотрицательность, т. е. способность в химических соединениях притягивать электроны.
Аллотропия
Из 118 известных на данный момент химических элементов 22 элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород O образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор P образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод C образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы VIIA и VIIIA групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.


Рис. 1. Модели кристаллических решёток алмаза (слева) и графита.
Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород H2, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).


Рис. 2. Модель молекулы серы (слева) и кристалл серы.
Кристалл серы состоит из отдельных молекул S8
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn. Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород H, кислород O, азот N, хлор Cl, фтор F образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — H2, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск. Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
В отличие от металлов, большинство которых имеют серебристо-серый цвет, окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
|
|
|
| Рис. 3. Алмаз
| Рис. 4. Иод
|
|
|
|
| Рис. 5. Бром | Рис. 6. Хлор |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
Химические свойства нметаллов
В химических реакциях неметаллы могут проявить себя и как восстановители, и как окислители. Из общих химических свойств неметаллов отметим их способность взаимодействовать с металлами, с водородом и кислородом.
Взаимодействие неметаллов с металлами
В реакциях с металлами неметаллы проявляют себя как окислители.
Особенно активно с металлами взаимодействуют галогены. В результате реакций соединения образуются соли — галогениды.
Например, при взаимодействии алюминия с иодом образуется иодид алюминия AlI3 :
2Al0+3I20→Al+3I3−1.
Железо активно реагирует с хлором, образуя хлорид железа(III) FeCl3:
2Fe0+3Cl20 − 2Fe+3Cl3−1.
Металлы реагируют с серой, образуя сульфиды.
Реакция соединения алюминия с серой начинается после того, как смесь веществ нагрели. Продуктом реакции является сульфид алюминия AlS32:
2Al0+3S0→Al2 +3S3−2.
Химическое взаимодействие между натрием и серой протекает при простом механическом смешивании. В результате образуется сульфид натрия NaS2:
2Na0+S0→Na2+1S−2.
Взаимодействие неметаллов с водородом
По сравнению с другими неметаллами водород имеет невысокую электроотрицательность. В силу этой причины в реакциях с другими неметаллами, как правило, данный химический элемент будет восстановителем, а другие неметаллы — окислителями.
В таких реакциях образуются летучие водородные соединения, состав молекул которых отвечает общей формуле RHx, где R — неметалл, а х — индекс, указывающий число атомов водорода в молекуле образовавшегося вещества. Этот индекс численно совпадает с валентностью неметалла, с которым водород соединяется.
Например, в реакции соединения водорода с хлором образуется газ хлороводород HCl:
H20+Cl20→2H+1Cl−1.
Взаимодействие водорода с азотом происходит при выcокой температуре и давлении. В промышленности для ускорения данного процесса используют катализатор. Продуктом взаимодействия этих двух неметаллических веществ является газ аммиак NH3:
N20+3H20⇄2N−3H3+1.
Взаимодействие неметаллов с кислородом
Кислород имеет высокую электроотрицательность, поэтому в реакциях с другими неметаллами он является окислителем, а другие неметаллы — восстановителями
В результате соединения кислорода с другими неметаллами образуются оксиды.
Например, сера сгорает в кислороде, образуя сернистый газ или оксид серы(IV) SO2:
S0+O20→S+4O2−2.
Фосфор энергично cгорает в кислороде ярким пламенем. В ходе реакции образуются белые клубы оксида фосфора(V) PO52:
4P0+5O20→2P2+5O5−2.
В то же самое время взаимодействие кислорода с химически малоактивным азотом протекает медленно и начинается только при очень высокой температуре. Продуктом реакции является газообразный оксид азота(II) NO:
N20+O20→2N+2O−2.
Такая химическая реакция протекает в атмосфере при разряде молнии, а также в цилиндрах двигателей при сгорании топлива.
Таблица. Применение неметаллов
| Область применения | Примеры |
| Промышленность | Такие неметаллы, как сера S, азот N2, фосфор P и хлор Cl2, используются в качестве сырья для получения кислот и другой продукции. Сера S используется в качестве сырья в производстве резин. Сажа C служит пигментом в производстве лаков и красок, а также пигментом и наполнителем в производстве пластмасс и резин |
| Транспорт | Водород H2 используется в качестве топлива. Важно, что продукт сгорания этого топлива не загрязняет среду |
| Сельское хозяйство | Сера S используется как эффективное средство борьбы с вредителями и болезнями растений |
| Медицина | Кислород O2 применяют в тех случаях, когда у больного затруднено дыхание. Активированный уголь C есть почти в каждой домашней аптечке. Точно так же, как иодная тинктура — спиртовой раствор иода I2. Мази, в состав которых входит сера S, используются при лечении кожных заболеваний. Жидкий азот N2 используют не только для хранения биологического материала, но и в косметической медицине |
| Подготовка воды | Для дезинфекции воды используют хлор Cl2 и озон O3. |
| Получение высоких температур | В металлургии и металлообработке для того, чтобы, сжигая горючее вещество, создать среду с высокой температурой, используют кислород O2 |
| Пиротехника | В производстве спичек и другой пиротехнической продукции используют серу S, фосфор P и уголь C |
| Пищевая промышленность | Для продления срока годности пищевых продуктов и для создания инертной атмосферы в упаковку закачивается азот N2 |
ССЫЛКИ НА ИСПОЛЬЗОВАННЫЙ МАТЕРИАЛ
https://docs.google.com/viewer?url=https%3A%2F%2F11klasov.net%2Findex.php%3Fdo%3Ddownload%26id%3D19370%26viewonline%3D1
https://s.11klasov.net/8684-himija-9-klass-rabochaja-tetrad-gabruseva-ni.html
https://s.11klasov.net/817-himiya-didakticheskiy-material-8-9-klassy-radeckiy-am.html
https://www.school2-plast.ru/svedeniya-ob-obrazovatelnoi-organizacii/obrazovanie/ocenochnye-materialy/5-9-klassy/himiya
https://resh.edu.ru/subject/29/9/
https://www.sites.google.com/site/videoopytypohimii/
https://onlinetestpad.com/ru/tests/chemistry/9class
https://pencup.ru/test/1629
https://onlinetestpad.com/ru/test/87246-nemetally


















