МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по выполнению самостоятельной работы
| по дисциплине | ОП.05 Физическая и коллоидная химия |
| специальность | 18.02.09 Переработка нефти и газа |
СОДЕРЖАНИЕ
Пояснительная Записка………………………………………………………...…….…..…
1. Карта самостоятельной работы обучающегося…….………..………………....…..
2. Порядок выполнения самостоятельной работы обучающимся…...........................................
2.1 Инструкции по выполнению самостоятельной работы, предусмотренных рабочей программой УД…… ……… …….………………………………………….……...…..
2.2 Методические указания по выполнению самостоятельной работы……………….....
3. Список рекомендуемой литературы…………………………………………………….
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методические указания по выполнению самостоятельной работы (далее –методические указания) составлены в соответствии с рабочей программой дисциплины ОП.05 Физическая и коллоидная химия.
Содержание методических указаний соответствует требованиям ФГОС СПО по специальности СПО18.02.09 Переработка нефти и газа
Целью методических указаний является оказание помощи обучающимся в выполнении самостоятельной работы по учебной дисциплине ОП.05 Физическая и коллоидная химия.
Задачами методических указаний по организации самостоятельной работы являются:
активизация самостоятельной работы обучающихся;
определение содержания самостоятельной работы обучающихся;
установление требований к различным формам самостоятельной работы;
определение порядка выполнения самостоятельной работы обучающимися;
формулирование методических рекомендаций по выполнению самостоятельной работы.
Методические указания состоят из карты самостоятельной работы обучающегося, порядка выполнения самостоятельной работы обучающимися, инструкции по выполнению различных видов самостоятельной работы, методических указаний по выполнению, списка рекомендованной литературы.
В карте самостоятельной работы указаны:
номер самостоятельной работы;
наименование темы, по которой запланировано выполнение самостоятельной работы;
наименование самостоятельной работы;
вид работы;
количество часов на выполнение
формы контроля;
формируемые общие и профессиональные компетенции (ОК, ПК).
Для выполнения самостоятельной работы рекомендуется пользоваться конспектами занятий, учебной литературой, которая предложена в списке рекомендуемой литературы, интернет - ресурсами или другими источниками по усмотрению обучающегося.
При освоении учебной дисциплины предусматриваются различные виды самостоятельной работы обучающегося:
для освоения теоретических знаний:
- презентации;
- конспект
для закрепления и систематизации полученных знаний:
для формирования компетенций:
- презентации;
- конспект
- решение химических задач
Выполнение самостоятельной работы обучающихся оценивается и фиксируется в журнале учебных занятий группы на календарный учебный год.
В дальнейшем методические указания могут быть переработаны при изменении ФГОС СПО.
Карта самостоятельной работы обучающегося
| № работы | Наименование темы | Наименование самостоятельной работы | Вид работы | Форма контроля | Кол-во часов | Формируемые ПК, ОК, У, З |
| Введение | Вклад российских ученых в развитие физической химии | презентация | защита устно на занятии | 2 | ОК1-ОК9 З1,З2 |
| Тема 1.1 Агрегатные состояния вещества | Основные положения молекулярно – кинетической теории Жидкое и твердое состояние вещества | конспект | проверка конспекта и защита работы по контрольным вопросам | 4 | ОК1-ОК9 У2 З1,З5-З7, З12 |
| Решение задач с использованием газовых законов | решение задач | проверка задачи и устная защита | 4 | ОК1-ОК9 У2 З1,З5-З7, З12
|
| Тема 1.2. Основы химической термодинамики. | Решение задач: Термохимические расчеты. Расчеты энтропии, свободной энергии Гиббса, определение возможности самопроизвольного протекания реакции | решение задач | проверка задачи и устная защита | 8 | ОК1-ОК9 У1, У2, У5, У6 З1, З2, З5, З6, З9, З11, З12
|
| Тема 1.3. Химическая кинетика | Кинетика неразветвленных цепных реакций | конспект | проверка конспекта и защита работы по контрольным вопросам | 2 | ОК1-ОК9 У2, У3, У5, У6 З1, З4, З5-З7, З11, З12 |
| Решение задач по теме «Химическая кинетика» | решение задач | проверка задачи и устная защита | 2 | ОК1-ОК9 У2, У3, У5, У6 З1, З4, З5-З7, З11, З12 |
| Тема 1.4. Катализ | Подбор материала и подготовка презентации по теме «Каталитические процессы и катализаторы в промышленности». | презентация | защита устно на занятии | 2 | ОК1-ОК9 У2, У7 З1, З3, З4, З6-З8, З11, З12 |
| Тема 1.5. Химическое равновесие. | Решение задач по теме «Составление выражений для констант равновесия при постоянном объеме и при постоянном давлении для предложенных реакций». Решение задач по теме «Расчет равновесных концентрации» Решение задач по теме «Определение направления смещения равновесия» | решение задач | проверка задачи и устная защита | 10 | ОК1-ОК9 У2, У5 З1, З6, З7, З11, З12
|
| Тема 1.6. Фазовое равновесие. | Подготовка презентации на тему «Диаграмма состояния воды». | презентация | защита устно на занятии | 2 | ОК1-ОК9 У2, У4 З1, З6, З7, З11, З12 |
| Фазовое равновесие в неизоморфно кристаллизующейся системе | конспект | проверка конспекта и защита работы по контрольным вопросам |
| ОК1-ОК9 У2, У4 З1, З6, З7, З11, З12 |
| Тема 1.7. Растворы. | Основные понятия, определения и классификация растворов. Способы выражения и пересчета концентрации | конспект | проверка конспекта и защита работы по контрольным вопросам | 2 | ОК1-ОК9 У2, У3 З1, З6, З7, З11, З12 |
| Подбор материала и подготовка презентации на тему «Свойства неидеальных растворов». | презентация | защита устно на занятии | 2 | ОК1-ОК9 У2, У3 З1, З6, З7, З11, З12 |
| Тема 2.8. Электрохимия | Химические источники тока | конспект | проверка конспекта и защита работы по контрольным вопросам | 2 | ОК1-ОК9 У1, У2 З1, З5, З6, З7, З11, З12 |
| Решение задач по теме «Расчеты потенциала электродов и ЭДС гальванических элементов». | решение задач | проверка задачи и устная защита | 2 | ОК1-ОК9 У1, У2 З1, З5, З6, З7, З11, З12 |
| Тема 2.1. Дисперсные системы | Коагуляция и стабилизация лиофобных дисперсных систем. Нефтяные ДС, виды | конспект | проверка конспекта и защита работы по контрольным вопросам | 4 | ОК1-ОК9 У1-ОУ7 З1-З12 |
| Решение задач на нахождение поверхностного натяжения жидкости. | решение задач | проверка задачи и устная защита | 4 | ОК1-ОК9 У1-ОУ7 З1-З12 |
Порядок выполнения самостоятельной работы обучающимися
Памятка-алгоритм написания конспекта
Перед конспектированием необходимо тщательно изучить конспектируемое произведение.
Конспектированию предшествует составление плана.
В начале конспекта необходимо точно указать фамилию и инициалы автора (или редактора сборника), полное название работы, место и год издания.
Наименование глав, разделов, параграфов конспектируемой работы всегда указывать точно.
Изложение текста дается сжато, но основные мысли и аргументы записываются подробно.
В конспекте можно использовать цитаты.
При оформлении конспекта используйте подчеркивания, условные знаки, пометки на полях.
Критерии оценки конспекта:
Оценка «отлично»: актуальность темы; грамотность и полнота использования источников; наличие элементов наглядности. Обучающийся четко и ясно озвучивает сообщение, а не зачитывает.
Оценка «хорошо» актуальности темы; соответствие содержания теме; грамотность и полнота использования источников; отсутствие элементов наглядности. Обучающийся четко зачитывает сообщение.
Оценка «удовлетворительно» сообщение не вполне соответствует содержанию темы; отсутствуют элементы наглядности. Обучающийся монотонно зачитывает сообщение.
Решение задач
Задача — это цель, заданная в определенных условиях, решение задачи — процесс достижения поставленной цели, поиск необходимых для этого средств.
Алгоритм решения задач:
Внимательно прочитайте условие задания и уясните основной вопрос, представьте процессы и явления, описанные в условии.
Повторно прочтите условие для того, чтобы чётко представить основной вопрос, проблему, цель решения, заданные величины, опираясь на которые можно вести поиски решения.
Произведите краткую запись условия задания.
Если необходимо составьте уравнение реакции.
Определите метод решения задания, составьте план решения.
Запишите основные понятия, формулы, описывающие процессы, предложенные заданной системой.
Найдите решение в общем виде, выразив искомые величины через заданные.
Проверьте правильность решения задания.
Произведите оценку реальности полученного решения.
Запишите ответ.
Критерии оценки решения задач, выполнения упражнений:
Оценка «отлично» ставится за верное выполнение всего задания, допускается 1или 2 недочёта.
Оценка «хорошо» ставится за верное выполнение 75% задания.
Оценка «удовлетворительно» ставится за верное выполнение 50% задания.
В случае выполнения менее 50% задания - оценка «неудовлетворительно».
3.Методические рекомендации по оформлению компьютерных презентаций.
Рекомендации по дизайну презентации
Рекомендации по оформлению и представлению на экране материалов различного вида.
Текстовая информация:
размер шрифта: 24–54 пункта (заголовок), 18–36 пунктов (обычный текст);
цвет шрифта и цвет фона должны контрастировать (текст должен хорошо читаться), но не резать глаза;
тип шрифта: для основного текста гладкий шрифт без засечек (Arial, Tahoma, Verdana),
для заголовка можно использовать декоративный шрифт, если он хорошо читаем;
курсив, подчеркивание, жирный шрифт, прописные буквы рекомендуется использовать только для смыслового выделения фрагмента текста.
Графическая информация:
рисунки, фотографии, диаграммы призваны дополнить текстовую информацию или передать ее в более наглядном виде;
желательно избегать в презентации рисунков, не несущих смысловой нагрузки, если они не являются частью стилевого оформления;
цвет графических изображений не должен резко контрастировать с общим стилевым оформлением слайда;
иллюстрации рекомендуется сопровождать пояснительным текстом;
если графическое изображение используется в качестве фона, то текст на этом фоне должен быть хорошо читаем.
Анимация
Анимационные эффекты используются для привлечения внимания слушателей или для демонстрации динамики развития какого-либо процесса. В этих случаях использование анимации оправдано, но не стоит чрезмерно насыщать презентацию такими эффектами, иначе это вызовет негативную реакцию аудитории.
Звук
- звуковое сопровождение должно отражать суть или подчеркивать особенность темы слайда, презентации;
- фоновая музыка не должна отвлекать внимание слушателей и не заглушать слова докладчика.
Единое стилевое оформление
Стиль может включать: определенный шрифт (гарнитура и цвет), цвет фона или фоновый рисунок, декоративный элемент небольшого размера и др.;
Не рекомендуется использовать в стилевом оформлении презентации более 3 цветов и более 3 типов шрифта;
Оформление слайда не должно отвлекать внимание слушателей от его содержательной части;
Все слайды презентации должны быть выдержаны в одном стиле;
Содержание и расположение информационных блоков на слайде
информационных блоков не должно быть слишком много (3-6);
рекомендуемый размер одного информационного блока — не более 1/2 размера слайда;
желательно присутствие на странице блоков с разнотипной информацией (текст, графики, диаграммы, таблицы, рисунки), дополняющей друг друга;
ключевые слова в информационном блоке необходимо выделить;
информационные блоки лучше располагать горизонтально, связанные по смыслу блоки — слева направо;
наиболее важную информацию следует поместить в центр слайда;
логика предъявления информации на слайдах и в презентации должна соответствовать логике ее изложения.
В тексте ни в коем случае не должно содержаться орфографических ошибок.
Рекомендации к содержанию презентации.
По содержанию:
На слайдах презентации не пишется весь тот текст, который произносит докладчик.
Текст должен содержать только ключевые фразы (слова), которые докладчик развивает и комментирует устно.
Если презентация имеет характер игры, викторины, или какой-либо другой, который требует активного участия аудитории, то на каждом слайде должен быть текст только одного шага, или эти «шаги» должны появляться на экране постепенно.
По оформлению
На первом слайде пишется не только название презентации, но и имена авторов (в ученическом случае – и руководителя проекта) и дата создания.
Каждая прямая цитата, которую комментирует или даже просто приводит докладчик (будь то эпиграф или цитаты по ходу доклада) размещается на отдельном слайде, обязательно с полной подписью автора (имя и фамилия, инициалы и фамилия, но ни в коем случае – одна фамилия, исключение – псевдонимы). Допустимый вариант – две небольшие цитаты на одну тему на одном слайде, но не больше.
Все схемы и графики должны иметь названия, отражающие их содержание.
Подбор шрифтов и художественное оформление слайдов должны не только соответствовать содержанию, но и учитывать восприятие аудитории. Например, сложные рисованные шрифты часто трудно читаются, тогда как содержание слайда должно восприниматься все сразу – одним взглядом.
На каждом слайде выставляется колонтитул, включающий фамилию автора и/или краткое название презентации и год создания, номер слайда.
В конце презентации представляется список использованных источников, оформленный по правилам библиографического описания.
Правила хорошего тона требуют, чтобы последний слайд содержал выражение благодарности тем, кто прямо или косвенно помогал в работе над презентацией.
Кино и видеоматериалы оформляются титрами, в которых указываются:
- название фильма (репортажа),
- год и место выпуска,
- авторы идеи и сценария,
- руководитель проекта.
Общие правила оформления презентации
Титульный лист
1. Название презентации.
2. Автор: ФИО, студента, место учебы, год.
3. Логотип колледжа.
Второй слайд «Содержание» - список основных вопросов, рассматриваемых в содержании. Лучше оформить в виде гиперссылок (для интерактивности презентации).
Заголовки
1. Все заголовки выполнены в едином стиле (цвет, шрифт, размер, начертание).
2. В конце точка не ставится.
3. Анимация, как правило, не применяется.
Текст
1.Форматируется по ширине.
2.Размер и цвет шрифта подбираются так, чтобы было хорошо видно.
3.Подчеркивание не используется, т.к. оно в документе указывает на гиперссылку.
4.Элементы списка отделяются точкой с запятой. В конце обязательно ставится точка.
Методические указания по выполнению самостоятельной работы
Введение.
Самостоятельная работа №1. Вклад российских ученых в развитие физической химии
Методические указания по выполнению самостоятельной работы:
1.Пользуясь рекомендуемой литературой и интернет-ресурсами составить презентацию.
2. Подготовиться к устной защите
Рекомендуемая литература:
О1.
О2.
Тема 1.1 Агрегатные состояния вещества
Самостоятельная работа №2. Основные положения молекулярно – кинетической теории. Жидкое и твердое состояние вещества
Методические указания по выполнению самостоятельной работы:
1. Пользуясь рекомендуемой литературой составить тематический конспект по технике отбора средней пробы.
2. Составить вопросы для самоконтроля.
Рекомендуемая литература:
О1.
О2.
Самостоятельная работа №3. Решение задач с использованием газовых законов
Методические указания по выполнению самостоятельной работы
Устная защита на занятии.
Для решения задач повторите тему
Решите задачи, пользуясь методическими указаниями, интернет-ресурсами.
При изучении данной темы необходимо обратить внимание на основные термины пройденной темы.
Задачи:
1. Кислород при давлении 25 кПа занимает объем 10 л. Вычислить, какой объем займет кислород при давлении 2 кПа и постоянной температуре.
2. Какой объем займет данное количество газа при давлении 0,7·105 Па, если при давлении 1,5·105 Па это количество газ занимает объем 6 л?
3. При температуре 17° С объем газа равен 0,5л При какой температуре объем газа удвоится?
Давление газа в закрытом сосуде при 17° С равна 100 кПа. Найти давление газа, если сосуд нагрели до 400°С.
Давление газа в закрытом сосуде при 25° С равно 500 кПа. До какого значения следует понизить температуру, чтобы давление газа понизилось на 25%?
Давление газа в закрытом сосуде при 0° С равна 100 кПа. Найти давление газа, если сосуд охладили до -40°С.
Давление газа в закрытом сосуде при 25° С равно 125 кПа. При какой температуре оно станет равно 25кПа?
Рекомендуемая литература:
О1.
О2.
Тема 1.2. Основы химической термодинамики
Самостоятельная работа №4. Решение задач: Термохимические расчеты. Расчеты энтропии, свободной энергии Гиббса, определение возможности самопроизвольного протекания реакции
Методические указания по выполнению самостоятельной работы
Устная защита на занятии.
1.Для решения задач повторите тему
2. Решите задачи, пользуясь методическими указаниями, интернет-ресурсами.
3. При изучении данной темы необходимо обратить внимание на основные термины пройденной темы.
Задачи:
1. Найти количество теплоты, выделяющееся, если в реакцию СО(г) + Н2О(ж) = СО2(г) + Н2(г) вступят 5,6л СО (н.у.).
2. Найти количество теплоты, выделяющееся, если в реакции Ca(к) + Н2О(ж) = Са(ОН)2(к) образуется 7,4 г Са(ОН)2.
3. Найти количество теплоты, выделяющееся, если в реакцию 2H2S(г) + О2(г) = 2S(к) + 2Н2О(г) вступят 2,8 л О2(н.у.).
4. Найти количество теплоты, выделяющееся, если в реакции 4NH3(г) + 5О2(г) = 4NО(г) + 6Н2О(ж) образуется 5,4 г воды.
5. Найти количество теплоты, выделяющееся, если в реакцию СН4(г) + О2(г) = С(графит) + 2Н2О(г) вступят 11,2 л метана.
Рекомендуемая литература:
О1.
О2.
Тема 1.3. Химическая кинетика
Самостоятельная работа №5 Кинетика неразветвленных цепных реакций
Методические указания по выполнению самостоятельной работы:
1. Пользуясь рекомендуемой литературой составить тематический конспект по технике отбора средней пробы.
2. Составить вопросы для самоконтроля.
Рекомендуемая литература:
О1.
О2.
Самостоятельная работа №6. Решение задач по теме «Химическая кинетика»
Методические указания по выполнению самостоятельной работы
Устная защита на занятии.
1.Для решения задач повторите тему
2. Решите задачи, пользуясь методическими указаниями, интернет-ресурсами.
3. При изучении данной темы необходимо обратить внимание на основные термины пройденной темы.
Задачи:
1. Начальная концентрация этана в сосуде для сжигания газов была равна 5 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 12 сек концентрация этана составила 1,4 моль/л. Найдите скорость данной химической реакции.
2. Как записать выражение закона действующих масс для следующих простых реакций?
2H2(г) + O2(г) = 2H2O(г);
3. Дана реакция синтеза аммиака: N2 + 3Н2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
4. Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)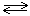 2NH3(г), если давление в системе увеличить в 2 раза?
2NH3(г), если давление в системе увеличить в 2 раза?
5. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300, если температурный коэффициент ее скорости равен 3?
6. Константа скорости реакции: СН3СООH(р-р) + КОН(р-р)→СН3СООК (р-р) +Н2O(р-р) равна 0,2 л/моль∙мин. Начальная концентрация уксусной кислоты была равна 0,5 моль/л, а щелочи – 1 моль/л. Вычислите скорость реакции в тот момент, когда концентрация кислоты станет равной 0,1 моль/л.
Рекомендуемая литература:
О1.
О2.
Тема 1.4. Катализ
Самостоятельная работа №7. Подбор материала и подготовка презентации по теме «Каталитические процессы и катализаторы в промышленности».
Методические указания по выполнению самостоятельной работы:
1.Пользуясь рекомендуемой литературой и интернет-ресурсами составить презентацию.
2. Подготовиться к устной защите
Рекомендуемая литература:
О1.
О2.
Тема 1.5. Химическое равновесие
Самостоятельная работа №8. Решение задач по теме «Составление выражений для констант равновесия при постоянном объеме и при постоянном давлении для предложенных реакций». Решение задач по теме «Расчет равновесных концентрации». Решение задач по теме «Определение направления смещения равновесия»
Методические указания по выполнению самостоятельной работы
Устная защита на занятии.
1.Для решения задач повторите тему
2. Решите задачи, пользуясь методическими указаниями, интернет-ресурсами.
3. При изучении данной темы необходимо обратить внимание на основные термины пройденной темы.
Задачи:
Задача 1. Как сместиться равновесие с увеличение температуры химической реакции, уравнение которой: 2SO2(г) + O2(г) ⇆2SO3(г) +Q?
Задача 2. Как сместить химическое равновесие обратимой реакции, уравнение которой N2(г) + 3H2(г) ⇆2NH3(г)+Q в сторону продуктов реакции? (рассмотреть влияние всех трех факторов)
Задача 3. Понижение давления смещает химическое равновесие вправо (→) в обратимой реакции, уравнение которой:
3H2(г) + N2(г) ⇆2NH3(г)+Q
СН4 + Н2О ⇆ 3Н2 + СО
СО2 + Н2О ⇆ Н2СО3
2СО + О2 ⇆ 2СО2
Задача 4. В какую сторону сместится химическое равновесие в реакции, уравнение которой НCl(г) + O2(г) ⇆ 2H2O (г) + 2Сl2(г) + Q в случае:
А) повышения температуры?
Б) уменьшения давления?
В) увеличения концентрации O2?
Г) применения катализатора?
Ответить на все четыре вопроса
Задача 5. При некоторой температуре равновесные концентрации в системе:
2HI(г) →H2(г) + I2(г)
составляли: [HI] = 0,2 моль/л, [H2] = 0,5 моль/л, [I2] = 0,4 моль/л. Определите константу равновесия.
Рекомендуемая литература:
О1.
О2.
Тема 1.6. Фазовое равновесие.
Самостоятельная работа №9. Подготовка презентации на тему «Диаграмма состояния воды».
Методические указания по выполнению самостоятельной работы:
1.Пользуясь рекомендуемой литературой и интернет-ресурсами составить презентацию.
2. Подготовиться к устной защите
Рекомендуемая литература:
О1.
О2.
Самостоятельная работа №10 Фазовое равновесие в неизоморфно кристаллизующейся системе
Методические указания по выполнению самостоятельной работы:
1. Пользуясь рекомендуемой литературой составить тематический конспект по технике отбора средней пробы.
2. Составить вопросы для самоконтроля.
Рекомендуемая литература:
О1.
О2.
Тема 1.7. Растворы
Самостоятельная работа №11 Основные понятия, определения и классификация растворов. Способы выражения и пересчета концентрации
Методические указания по выполнению самостоятельной работы:
1. Пользуясь рекомендуемой литературой составить тематический конспект по технике отбора средней пробы.
2. Составить вопросы для самоконтроля.
Рекомендуемая литература:
О1.
О2.
Самостоятельная работа №12. Подбор материала и подготовка презентации на тему «Свойства неидеальных растворов».
Методические указания по выполнению самостоятельной работы:
1.Пользуясь рекомендуемой литературой и интернет-ресурсами составить презентацию.
2. Подготовиться к устной защите
Рекомендуемая литература:
О1.
О2.
Тема 2.8. Электрохимия
Самостоятельная работа №13 Химические источники тока
Методические указания по выполнению самостоятельной работы:
1. Пользуясь рекомендуемой литературой составить тематический конспект по технике отбора средней пробы.
2. Составить вопросы для самоконтроля.
Рекомендуемая литература:
О1.
О2.
Самостоятельная работа №14. Решение задач по теме «Расчеты потенциала электродов и ЭДС гальванических элементов».
Методические указания по выполнению самостоятельной работы
Устная защита на занятии.
1.Для решения задач повторите тему
2. Решите задачи, пользуясь методическими указаниями, интернет-ресурсами.
3. При изучении данной темы необходимо обратить внимание на основные термины пройденной темы.
Задачи:
1. Ток силой 1,5 А проходит через раствор сульфата меди в течение часа. Найти массу выделившейся меди.
2. Сколько времени нужно пропускать ток силой 1 А, чтобы восстановить до двухвалентного все трехвалентное железо, содержащееся в 80 мл 0,1 М раствора?
3. Ток, проходя через раствор кислоты, выделяет за 6 минут 120 см 3 водорода (при 17 C под давлением 98 910 Па). Рассчитать силу тока.
4. Сколько времени нужно пропускать ток силой 2 А, чтобы выделить из раствора KOH 300 см 3 гремучего газа при 0 C и 1,0 10 5 Па?
5. Соляная кислота (4 мл) кулонометрически титруется электролитически генерируемыми в растворе ионами OH – при постоянной силе тока 50 мА. Точка эквивалентности достигается через 5 мин 15 с. Рассчитать титр исследуемого раствора по NaOH.
Рекомендуемая литература:
О1.
О2.
Тема 2.1. Дисперсные системы
Самостоятельная работа №15 Коагуляция и стабилизация лиофобных дисперсных систем. Нефтяные ДС, виды
Методические указания по выполнению самостоятельной работы:
1. Пользуясь рекомендуемой литературой составить тематический конспект по технике отбора средней пробы.
2. Составить вопросы для самоконтроля.
Рекомендуемая литература:
О1.
О2.
Самостоятельная работа №16. Решение задач на нахождение поверхностного натяжения жидкости
Методические указания по выполнению самостоятельной работы
Устная защита на занятии.
1.Для решения задач повторите тему
2. Решите задачи, пользуясь методическими указаниями, интернет-ресурсами.
3. При изучении данной темы необходимо обратить внимание на основные термины пройденной темы.
Задачи:
1. Рассчитайте межфазное натяжение в системе СеО2–вода, зная, что растворимость частиц СеО2 диаметром 0,1 мкм (при 298 К) превышает растворимость крупных кристаллов на 7 мас. %. Плотность СеО2 примите равной 7,13 г/см3 .
2. Оцените размер частиц оксида меди СuО, зная, что их растворимость в воде на 8 мас. % больше растворимости крупных кристаллов. Межфазное натяжение при 298 К примите равным 840 мДж/м 2 , плотность СuО 6,32 г/см3 .
3. Рассчитайте межфазное натяжение в системе СuО – вода, зная, что растворимость частиц СuО диаметром 0,1 мкм (при 298 К) превышает растворимость крупных кристаллов на 10 мас. %. Плотность СuО примите равной 6,32 г/см3 .
4. Оцените размер частиц оксида цинка ZnО, зная, что их растворимость на мас. 7 % больше растворимости крупных кристаллов. Межфазное натяжение при 298 К примите равным 960 мДж/м 2 , плотность ZnО 5,60 г/см3 .
5. Рассчитайте межфазное натяжение в системе ZnО – вода, зная, что растворимость частиц ZnО диаметром 0,7 мкм (при 298 К) превышает растворимость крупных кристаллов на 3,26 мас. %. Плотность ZnО примите равной 5,60 г/см3 .
Рекомендуемая литература:
О1.
О2.
Список рекомендуемой литературы
Основные источники:
О-1 Белик В. В. Физическая и коллоидная химия : учебник для студ. учреждений сред. проф. образования – М.: Академия, 2017 – 288 с. [Электронный ресурс; Режим доступа http://www.academia-moscow.ru]
О-2 Кудряшева, Н. С. Физическая и коллоидная химия: учебник и практикум для СПО / Н. С. Кудряшева, Л. Г. Бондарева. — 2-е изд., перераб. и доп. — М.: Издательство Юрайт, 2019. – 379 с. [Электронный ресурс; Режим доступа https://www.biblio-online.ru]
Дополнительные источники:
Д-1 Гавронская, Ю. Ю. Коллоидная химия : учебник и практикум для СПО / Ю. Ю. Гавронская, В. Н. Пак. — М.: Издательство Юрайт, 2019. — 287 с. — (Профессиональное образование) [Электронный ресурс; Режим доступа https://www.biblio-online.ru].

















