Министерство Здравоохранения РД
«Буйнакское медицинское училище»
Методическая разработка открытого урока на тему:
Разработала: преподаватель
химии Даибова А.М.
Утвержден на заседании ЦМК
«Естественно научных дисциплин»
«___» __________2020
Протокол №__ о т__________
Председатель ЦМК:
Ярбилова З.Х.____________
ТЕМА: Сложные эфиры и жиры.
Тип урока: Урок изучения нового материала с мультимедийным сопровождением, комбинированный урок
Задачи урока.
-
Закрепить знания о сложных эфирах, их номенклатуре, реакции этерификации.
-
Дать понятия о физических и химических свойствах сложных эфиров, механизме реакции этерификации.
-
Сформировать представление о жирах, их составе, свойствах и применении.
-
Способствовать развитию эрудиции, логического и ассоциативного мышления студентов.
Методы и приемы: словесные, наглядные, практические – в логической взаимосвязи.
Требования к уровню подготовки: Знать определение сложных эфиров, строение, свойства, способы получения и области применения. Уметь составлять формулы сложных эфиров, называть их, составлять уравнения реакций этерификации и гидролиза, знать условия осуществления этих реакций. Знать определение жиров, их классификацию, строение, свойства, нахождение в природе. Уметь записывать структурные формулы жиров, уравнение гидролиза жира и образование его. Знать, как происходит превращение жиров пищи в организме.
Цели занятия:
Обучающие цели: Систематизировать знания о сложных эфирах, их строении, нахождении в природе и свойствах; обобщить и развить знания студентов о жирах
как о сложных эфирах глицерина и высших карбонатных кислот, об особенностях их физико-химических свойств и о роли в живой природе.
Воспитывающие цели: Создать условия для самостоятельной работы студентов, укреплять навыки работы студентов с текстом, выделять основное в тексте, выполнять тесты.
Развивающие цели: Создать на уроке диалоговое взаимодействие, содействовать развитию умений студентов высказывать свое мнение, выслушивать товарища,
задавать друг другу вопросы и дополнять выступления друг друга.
Оборудование: Мел, доска, экран, проектор, компьютер, электронная презентация,
Видеоролики: 1. Определение непредельности жиров.
2. Образование нерастворимых кальциевых солей жирных кислот.
Лабораторный опыт:
1. Ознакомление с образцами жиров, изучение их физических свойств.
2. Распознавание сливочного масла и маргарина с помощью подкисленного теплого раствора КМnO4.
ХОД УРОКА
Организационный момент.
Подготовка к изучению нового материала.
Актуализация знаний студентов.
Мир химии богат и разнообразен. Немало загадок и тайн приготовил он человеку. Но человек любознателен и настойчив – множество веществ и явлений было открыто уже очень давно. Однако не все еще познано.
У меня в руках сладкая газированная вода со вкусом и запахом груши. Как вы думаете, что за вещество придает сладкой газированной воде приятный аромат и вкус груши? (Ароматизатор груши) Какую формулу он имеет и к какому классу оно относится? Чтобы ответить на этот вопрос, выполним задание (задание на слайде и у каждого студента на столе)
| Реагент | Название и формула вещества |
| Этанол | Фенол | Этаналь | Этановая кислота |
| Водород | С | Ц | И | Л |
| Натрий | З | О | Ж | П |
| Цинк | Ж | Н | Ы | Е |
| Оксид меди (II) при нагревании | Н | О | Й | Т |
| Гидроксид натрия | Э | И | Ф | Л |
| Гидроксид меди (II) при обычных условиях | Ц | Ы | Б | А |
| Гидроксид меди (II) при нагревании | Ч | Л | Ц | Р |
| Азотная кислота | Е | Т | Ц | Т |
| Этанол | А | Т | А | Т |
Студенты записывают на доске уравнения реакций и комментируют, какие свойства отражают эти уравнения, какой тип реакции и как называются продукты.
Вывод: ИЗОПЕНТИЛАЦЕТАТ. К какому классу относится это вещество? Из каких исходных веществ оно образовано? Правильно, для того, чтобы получить изопентилацетат необходимо взять изопентиловый (амиловый) спирт и уксусную
кислоту.
Демонстрация:
В пробирку налить 2 мл изоамилового (изопентилового) спирта, 2 мл уксусной кислоты и 0,5 мл концентрированной серной кислоты. Закрыть пробирку газоотводной трубкой и нагреть на водяной бане в течение нескольких минут.
После охлаждения добавить в пробирку несколько миллилитров воды. При этом образуется слой изоамилового эфира уксусной кислоты (изоамилацетата) с характерным запахом грушевой эссенции.
1.Как называется взаимодействие кислот со спиртами? Напишите уравнение реакции изоамилового спирта с уксусной кислотой.
2.Для чего в реакционную смесь, содержащую спирт и карбоновую кислоту, добавляют концентрированную серную кислоту?
3.Как вы думаете, где находят применение сложные эфиры?
Изучение нового материала в форме беседы.
Сегодня наш урок будет посвящен изучению сложных эфиров.
Что такое сложные эфиры?
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
R-COO-R, где R и R1 углеводородные радикалы, исключение – эфиры муравьиной кислоты
H–COO–R1.
Сложные эфиры – жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природе. Их наличием обусловлены приятные
запахи цветов и фруктов. Они даже могут находиться в коре некоторых деревьев.
Посмотрите на экран и рассмотрите состав сложных эфиров, которые придают
запах цветам. Демонстрируются слайды: запах жасмина - бензилпропаноат, хризантемы – сложный эфир фенилэтилового спирта и муравьиной кислоты. Как мы видим сложные эфиры, которые имеют цветочные запахи, это чаще всего производные ароматических кислот или ароматических спиртов. А вот сложные
эфиры, которые входят в состав известных вам фруктов имеют довольно простой состав.
На экран проектируются слайды: запах вишни - пентилформиат, абрикосов - этилбутаноат, яблок - метилбутаноат, апельсинов – пентилпентаноат, груш – изопентлацетат; и даются формулы эфиров, которые называют студенты.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3 (CH2)14–CO–O–(CH2)29CH3.
Как могут быть получены сложные эфиры?
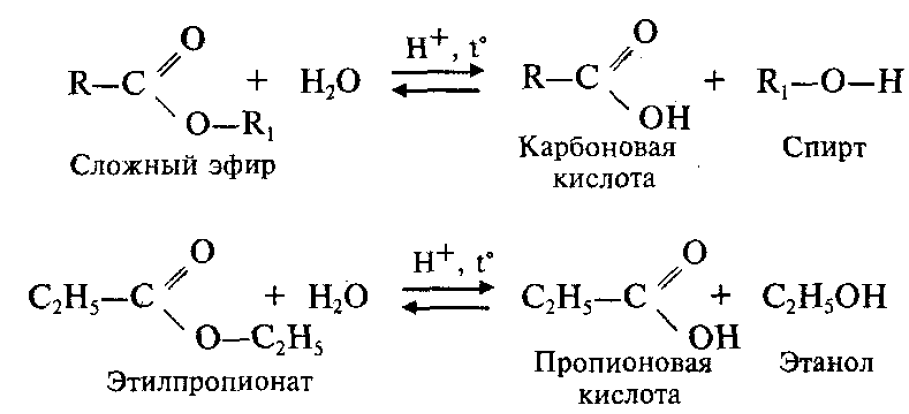
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
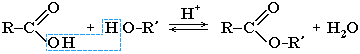
Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат - анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
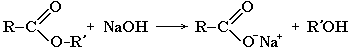
Эта реакция называется омылением сложного эфира.
Изомерия и номенклатура сложных эфиров
| Структурная изомерия | Межклассовая изомерия |
| Цепи | Положения группы |
| CH3 – COO – CH2 – CH2 – CH3 Пропилацетат Пропилэтаноат Пропиловый эфир уксусной кислоты
CH3 – COO – CH – (CH3)2 Изопропилацетат Изопропилэтаноат Изопропиловый эфир
уксусной кислоты | C2H5 – COO – C2H5 Этилпропионат Этилпропаноат Этиловый эфир пропионовой кислоты
CH3 – CH2 – CH2 – COO – CH3 Метилбутират Метилбутаноат Метиловый эфир
масляной кислоты | CH3 – CH2 – CH2 – CH2 – COOH н-Пентановая кислота и ее изомеры
(Сложные эфиры изомерны карбоновым кислотам)
|
Применение сложных эфиров очень разнообразно (презентация).
Их применяют в промышленности в качестве растворителей и промежуточных продуктов при синтезе различных органических соединений. Сложные эфиры с приятным запахом используют в парфюмерии и пищевой промышленности. Сложные эфиры часто служат исходными веществами в производстве многих фармацевтических препаратов.
ЖИРЫ
Важнейшими представителями сложных эфиров являются жиры.
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами, и таким образом впервые синтезировал жир.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров. Действуя водными растворами кислот и щелочей на различные жиры, он получил в
результате реакции гидролиза (омыления) открытый еще Шееле глицерин
и неизвестные, ранее химические соединения – различные жирные кислоты, многим из которых он и дал названия. А «сладкое масло» Шееле Шеврёль назвал глицерином.
На основании этих экспериментов сделали вывод, что жиры (триглицериды) – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Общая формула: 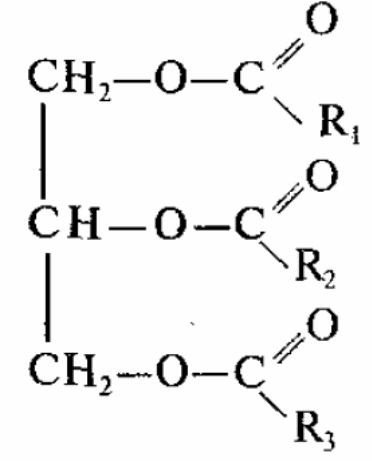 , где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
, где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
Жиры, как это не удивительно, тоже относятся к сложным эфирам. В их образовании участвуют стеариновая кислота С17Н35СООН (или близкие к ней по составу и строению другие жирные кислоты) и трехатомный спирт глицерин С3Н5(ОН)3. Вот как выглядит схема молекулы такого эфира:
Н2С - О - С (О) С17Н35
|
НС - О - С (О) С17Н35
|
Н2С - О - С (О) С17Н35
тристеарин, эфир глицерина и стеариновой кислоты, тристеарат глицерина.
Жиры имеют сложное строение – это подтверждает модель молекулы тристеарата.
Физические свойства
Для изучения физических свойств жиров проведем лабораторный опыт №1.
Рассмотрим растворимость жиров.
Налейте в пробирки различные растворители (воду, этанол, бензол, бензин) и добавьте в каждую пробирку растительное масло, и встряхните. Запишите наблюдения.
Жиры в воде не растворяются, но растворяются в органических растворителях (бензине, бензоле, гексане...). Поэтому их можно извлечь экстракцией из измельченных семян растений или из животных продуктов этими растворителями при нагревании. Рассмотрим классификацию жиров:
Классификация жиров
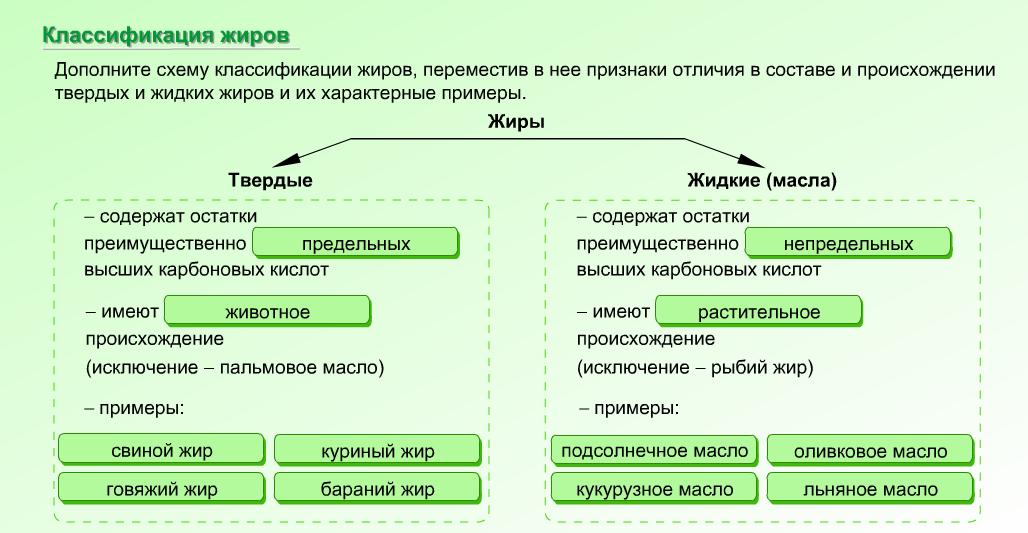
Наиболее важные ВКК, входящие в состав жиров:
| Насыщенные кислоты | Ненасыщенные кислоты |
| Эмпирическая формула ВКК | Название кислоты (кислотного остатка) | Эмпирическая формула ВКК | Название кислоты (кислотного остатка) |
| С15Н31СООН | Пальмитиновая (пальмитат) | С17Н33СООН | Олеиновая (олеат) |
| С17Н35СООН | Стеариновая (стеарат) | С17Н31СООН | Линолевая (линолеат) |
|
|
| С17Н29СООН | Линоленовая |
Получение жиров
СН2 ОН СН2 - ОО – С - С17 Н35
С
 Н ОН + 3С17Н35 СООН СН - ОО–С – С17 Н 35 + 3 Н2О
Н ОН + 3С17Н35 СООН СН - ОО–С – С17 Н 35 + 3 Н2О
СН2 О Н СН2–ОО–С–С 17 Н 35
Химические свойства жиров
Как распознать входят ли в состав жира непредельные кислоты? Правильно, провести реакцию с бромной водой (видеоролик) или с раствором перманганата калия.
Лабораторный опыт №2.
К маргарину и к сливочному маслу прилейте теплый раствор перманганата калия. Запишите наблюдения.
-
Реакции присоединения
1.Присоединение галогенов (взаимодействие с бромной водой):
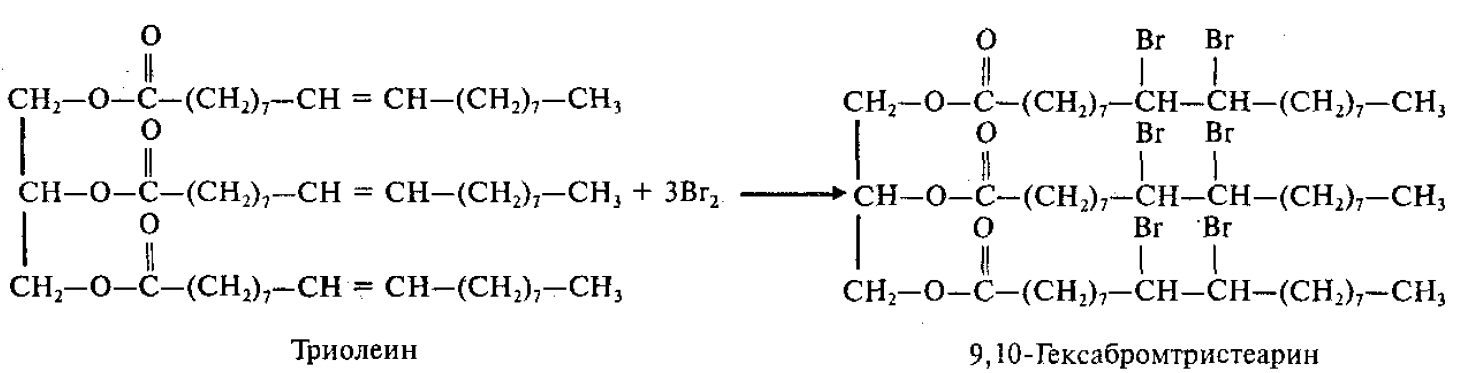
Бромная вода в результате этой реакции обесцвечивается.
2.Гидрирование:
Для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина – твердого жира из растительных масел.
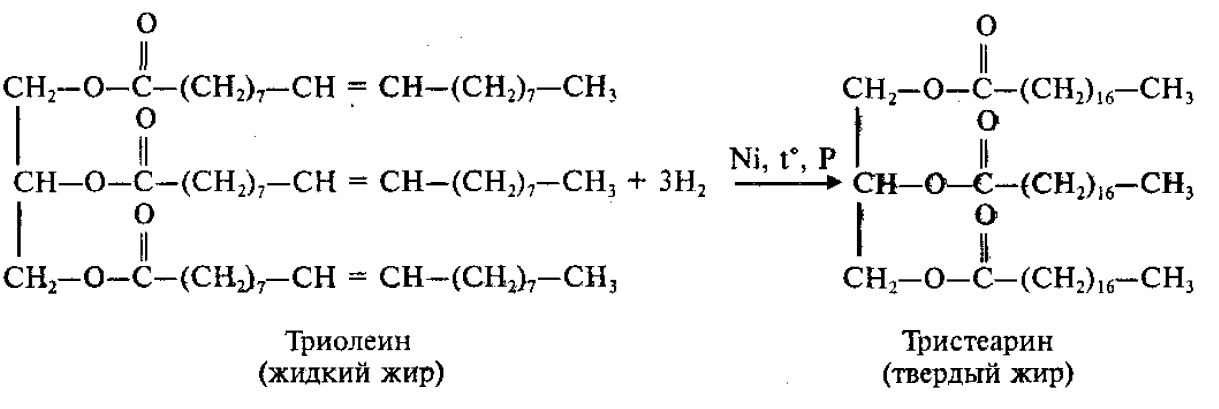
Гидролиз
В зависимости от условий гидролиз бывает:
1.Водный (без катализатора, при высоких температуре и давлении),
2.Кислотный (в присутствии кислоты в качестве катализатора),
3.Ферментативный (происходит в живых организмах):
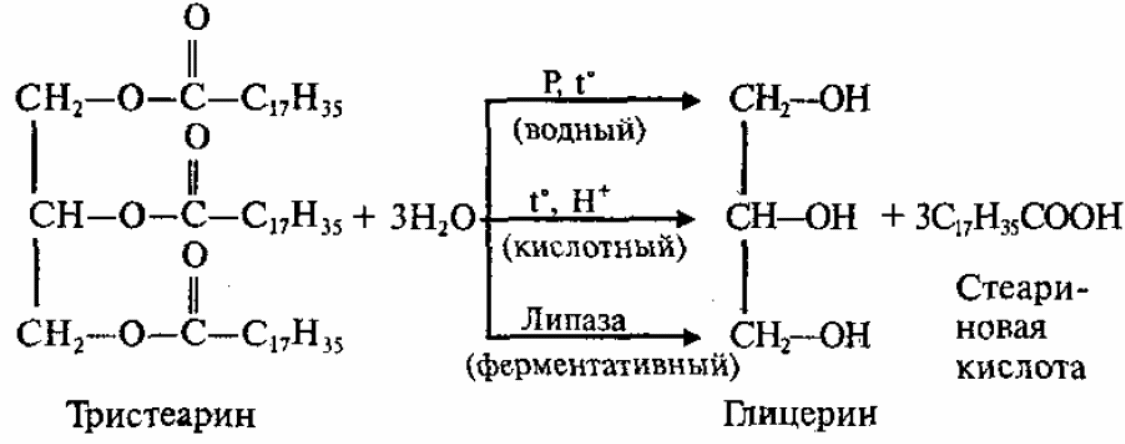
4.Щелочной (под действием щелочей):
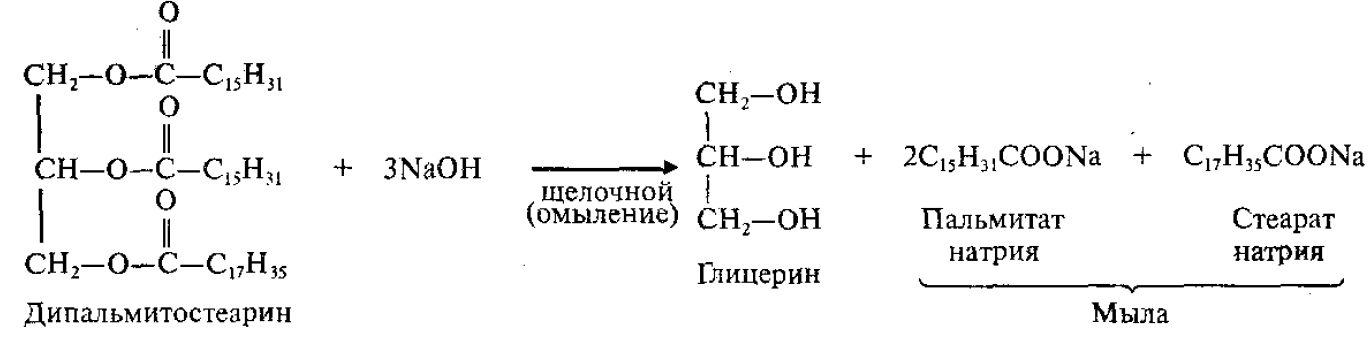
Мыла – натриевые или калиевые соли ВКК.
Натриевые соли являются основным компонентом твердого мыла, калиевые соли – жидкого мыла.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или
кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой.
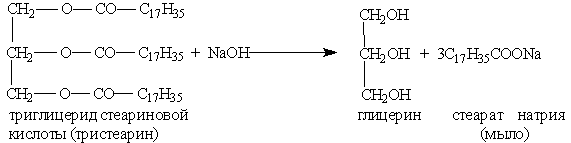
Почему мыло теряет свою моющую способность в жесткой воде? (видеоролик)
Биологическая роль жиров
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. И первые среди незаменимых - жирные кислоты с несколькими двойными связями в молекуле. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
-
строительная (входят в состав клеточных мембран);
-
энергетическая (1 г жира при окислении дает 9 ккал энергии);
-
защитная (теплорегуляционная, механическая защита органов);
-
запасная (запас энергии и воды);
-
регулирующая (обмен веществ в организме).
Применение жиров (презентация).
Многие жиры при стоянии на воздухе прогоркают – приобретают неприятные запах и вкус, так как при этом образуются кетоны и альдегиды. Такой процесс
стимулируется железом, поэтому нельзя оставлять масло в сковороде до следующего дня. Для предотвращения его применяют антиоксиданты.
Прокисание жира связано с гидролизом его. Кислый вкус обусловлен появлением карбоновых кислот.
Весьма важными являются реакции полимеризации масел. По этому признаку
растительные масла делят на высыхающие, полувысыхающие и невысыхающие. Высыхающие в тонком слое образуют блестящие тонкие пленки. На этом основано использование этих масел для приготовления лаков и красок (льняное). К полувысыхающим относятся, например, подсолнечное, а к невысыхающим относится оливковое, содержащее мало непредельных кислот.
Теперь перейдем к практическим советам. Вам надо удалить пятно от подсолнечного масла. Можно ли их физическим способом удалить, не прибегая к помощи химии? Да, растительное масло хорошо растворяется в бензине или керосине.
Если вы за праздничным столом посадили на одежду жирное пятно и не можете заняться его выведением, рекомендуется немедленно засыпать пятно солью. Соль адсорбирует жиры. Можно также воспользоваться с этой целью зубным порошком.
При старении пятна растительного масла, особенно на свету и при повышенных температурах, образуются прочные полимерные соединения, также за счет двойных связей происходит взаимодействие молекул жира с молекулами ткани. Вывести такое пятно очень трудно, поэтому жирное пятно выводите сразу сами или в «Еврочистке».
Закрепление ЗУН.
Тестирование
1. Вещество, формула которого, называется:
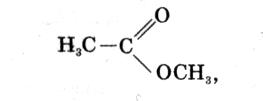
1) метилацетатом;
2) метилформиатом;
3) метилэтиловым эфиром;
4) этилацетатом.
2. В результате гидролиза жидкого жира образуются:
1) твердые жиры и глицерин;
2) глицерин и непредельные кислоты;
3) глицерин и предельные кислоты;
4) твердые жиры и смесь кислот.
3. В каком веществе жиры не растворяются?
1) в бензоле;
2) в воде;
3) в бензине;
4) в хлороформе.
4. Для превращения жидких жиров в твердые используют реакцию:
1) дегидрогенизации;
2) гидрогенизации;
3) гидратации;
4) дегидроциклизации.
5. В результате гидрирования жидких жиров образуются:
1) твердые жиры и непредельные кислоты;
2) твердые жиры и глицерин;
3) твердые жиры и предельные кислоты;
4) твердые жиры.
6.В организме процесс переваривания жиров начинается с реакции:
1) гидролиза;
2) гидрирования;
3) полимеризации;
4) дегидрирования.
Задания повышенного уровня сложности
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций. Дайте названия всем соединениям.
1-й уровень
C


 H4 CH3Cl CH3OH HCOOH HCOOC3H7
H4 CH3Cl CH3OH HCOOH HCOOC3H7
2-й уровень
Э
 тилен этанол ацетальдегид уксусная кислота этилацетат
тилен этанол ацетальдегид уксусная кислота этилацетат
э танол углекислый газ
танол углекислый газ
3-й уровень
Как из углеводорода (предельного, непредельного) перейти к сложному эфиру? Приведите примеры реакций, составьте свои «цепочки» превращений.
Домашнее задание: Конспект
16






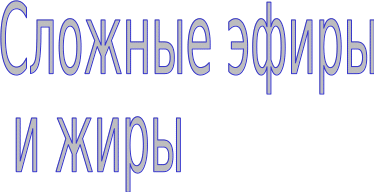

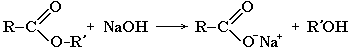
 , где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
, где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.

 Н ОН + 3С17Н35 СООН СН - ОО–С – С17 Н 35 + 3 Н2О
Н ОН + 3С17Н35 СООН СН - ОО–С – С17 Н 35 + 3 Н2О


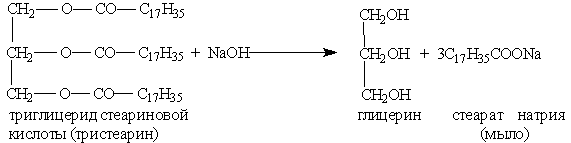




 H4 CH3Cl CH3OH HCOOH HCOOC3H7
H4 CH3Cl CH3OH HCOOH HCOOC3H7
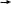
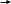
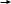
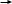 тилен этанол ацетальдегид уксусная кислота этилацетат
тилен этанол ацетальдегид уксусная кислота этилацетат 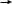 танол углекислый газ
танол углекислый газ

















