

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

«Металдар химиясы» қолданбалы ҚМЖ
«Металдар химиясы» қолданбалы курс 9.10 сыныптар үшін
Просмотр содержимого документа
««Металдар химиясы» қолданбалы ҚМЖ»
| Пәннің аты | Химия қолданбалы | №1 | Уақыты:7.09.16 |
| Сабақтың атауы | Металдарға жалпы сипаттама | ||
| Мақсаты Күтілетін нәтиже | Тақырыптың мазмұнын ашу арқылы түсінеді, есте сақтау әдіс – тәсілдерін үйренеді.оқушы ойлау қабілеттерін дамытадыу, сөйлеу тілдерін байытады | ||
| Психологиялық ахуал | Психологиялық дайындық «Жүректен - жүрекке» шеңбері – Әрбір еркелетіп айтатын есім гүлге ұқсайды. Гүлдердің бәрі әдемі: раушан да, қызғалдақ та, бәйшешек те – бәрі де өзінше керемет, бәрі де адамға қуаныш сыйлайды. Біздің есіміміз де осындай керемет! | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабаққа сәттілік тілейді. | |
| Қызығушылықты ояту | Топқа тапсырма Сөзжұмбақ құрастыру Постер қорғау Ребус | ||
| Жаңа сабақ |
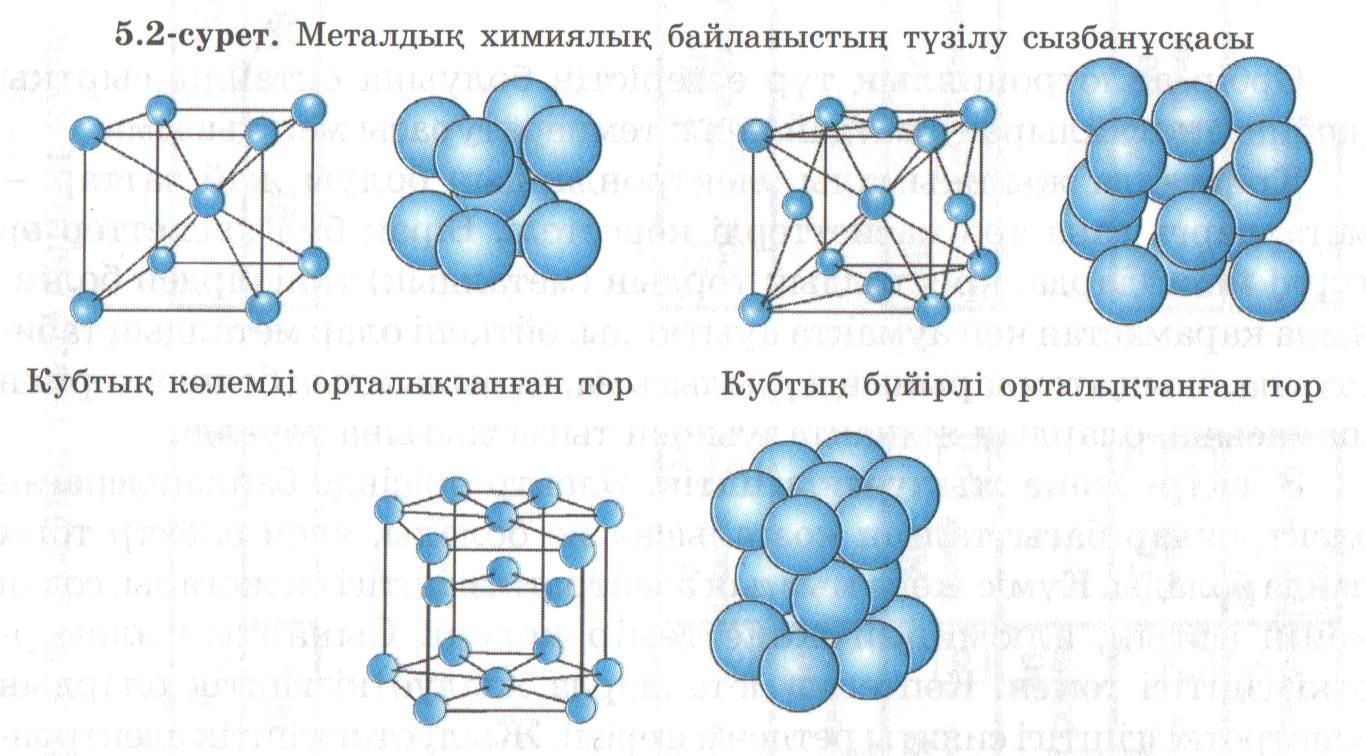
Металдар– Электр тоғы мен жылуды жақсы өткізетін, пластикалық қасиеті жоғары, жылтыр заттар. Мұндай қасиеттердің болуы металдардың ішкі құрылымымен байланысты. Металдардың (сынаптан басқа) кристалдық тор көздерінде металл атомдары орналасқан. Олар бір-бірімен металдық байланыспен байланысады. Металдардың иондану энергиясы аз болғандықтан олардың валенттік электрондары оңай бөлініп, бүкіл кристалдың бойында еркін қозғала алады. Сондықтан олардың жиынтығын электрон газы деп те атайды. Су ерітінділеріндегі реакциялар үшін металдың активтілігі оның активті қатардағы орнына байланысты. Металдардың қаттылығы, температураға төзімділігі күнделікті тәжірибеде шешуші рөл атқарады. Егер шыны хроммен кесілсе, ал цезийді адам тырнағымен-ақ кесе алады. Кейбір металдар жұмсақ (күміс, алтын, т.б.) болғандықтан таза металдардың орнына олардың бір-бірімен құймалары қолданылады. Ең алғаш алынған құймалардың бірі – қола. Темір мен оның құймалары (шойын, болат) қара металдар, ал қалғандары түсті металдар; алтын, күміс, платина химиялық реактивтергетөзімділігіне байланысты асыл металдар; сумен әрекеттесіп сілті түзетін металдарды сілтілік (Lі, Na, K, Rb, Cs), ал жер қыртысының негізін құрайтындарын сілтілік жер металдар; массалық үлесі 0,01%-дан аспайтындарын сирек металдар деп атайды. Өнеркәсіпте металдарды негізінен пирометаллургия, гидрометаллургия және электрметаллургия әдістерімен алады. Металдар электр сымдарын, тұрмысқа қажет бұйымдар (қазан, балға, т.б.) жасауда, т.б. кеңінен қолданылады. Тест құрастыру
| ||
| Жаңа сабаққа байланысты жеке тапсырмалар | Жұмыс дәптерімен жұмыс
| ||
| Үйге тапсырма | Берілген тапсырманы түсіндіру | Күнделіктеріне жазып беремін | |
| Бағалау | Оқыту үшін бағалау және оқуды бағалау
| Бағалау парақшасын толтырады. | |
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | Сабақ№2 | Уақыты:14.09.16 | ||||
| Сабақтың атауы | Металдардың периодтық жүйедегі орыны | ||||||
| Мақсаты Күтілетін нәтиже | Металдардың периодтық жүйедегі орынын қарай з топқа бөлінетінін біледі оларды қасиеттерін салыстыра отырып, қосылыстарын ажырата алады. | ||||||
| Психологиялық ахуал | Психологиялық дайындық Өз аттарынның бас әріпіне сәйкес тілек тілейді | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабаққа сәттілік тілейді. | |||||
| Қызығушылықты ояту | 1) металдар период бойынша қалай жіктеледі? 4) металдарға тән қасиет? | ||||||
| Сергіту сәті | «Молекулалар» биі | ||||||
| Жаңа сабақ | Химиялық элементтердің басым көпшілігі - металдар. Қазір белгілі болып отырған 110 элементтің 89-ы металдарға жатады. Химиялық элементтердің барлық топтарында металдар бар. Периодтық кестедегі металдар мен бейметалдарды өзара бөліп көрсету үшін II топтағыбериллийден VII топтағы астатқа қарай диагональ жүргізіледі. Сызықтың жоғары жағында қосымша топша металдарын есептемегенде, бейметалдар, ал төменгі жағында металдар орналасады. Олар I-III топтың негізгі топшасында жəне барлық қосымша топшаларында кездеседі. Металл атомдарының өзіне тəн ерекшелігі бар. Диагональ сызықтың дəл үстінде жатқан берилий, алюминий сияқты металдар екі жақты қасиеті бар екідайлы элементтерді құрайды
| ||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Деңгейлік тапсырмалар1-тапсырма Периодтық жүйедегі орына сәйкес металдарды қасиетіне қарай үш топқа бөл. 2 тапсырма Металдарды ата.
3 тапсырма реакция теңдеуін жаз. А) Литий сутегімен белсенді әрекеттесіді.Литийдің кішкенбай бөлігі осы газдың үлкен көлемімен әрекеттеседі. Одан алынған литий гидриді табеткасы теңіздегі апатты жағдайда қолданылады. Литий гидриді судың әсерінен тез ыдырап, құтқару қайықтары мен құтқару желеттерін тез арада сутегіге толтырады.Осыған сәйкес литий гидридінің сумен әрекеттесу реакция теңдеуін жаз..________________________________________________________
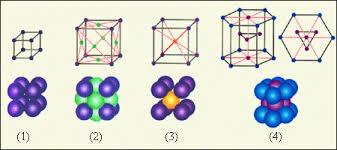
Б) Массасы 5г А тұзында 0,6 г көміртек және 2г Б металы бар .Б металы көп мөлшері сумен әрекеттесіп белгілі «әк суы»реактивін түзеді. А тұзы қыздырғанда бөлінетін газ осы реактивпен әрекеттеседі.Мұндағы Б металы және А тұзы болады. 1)Ва. ВаСО3 2) Са, СаСО3 3)Na, Na2CO3 4) Mg, MgCO3 4- тапсырма Металдардың кристалды құрылысы оның маңызды қасиеттерін айқындайды. Олай болса сілтілік (К,Rb және Cs)металдарға қандай кристалдық торлардың қайсысы тән.
| ||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| |||||
| Бағалау |
Бірін- бірі бағалау |
| |||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | №3 сабақ | Уақыты:21,09 | ||||
| Сабақтың атауы | Металдарды алу әдістері | ||||||
| Мақсаты Күтілетін нәтиже | Металдардың алу әдістерін біледі оларды қасиеттерін салыстыра отырып, ажырата алады. | ||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | |||||
| Қызығушылықты ояту | 1) сілтілік металдарды қалай алады. 4) Электролиз арқылы алынатын металдарға тән қасиет? | ||||||
| Сергіту сәті | «Молекулалар» биі | ||||||
| Жаңа сабақ |
| ||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Деңгейлік тапсырмалар1-тапсырма Периодтық жүйедегі орына сәйкес металдарды қасиетіне қарай үш топқа бөл. 2 тапсырма Металдарды ата.
3 тапсырма реакция теңдеуін жаз. А) Литий сутегімен белсенді әрекеттесіді.Литийдің кішкенбай бөлігі осы газдың үлкен көлемімен әрекеттеседі. Одан алынған литий гидриді табеткасы теңіздегі апатты жағдайда қолданылады. Литий гидриді судың әсерінен тез ыдырап, құтқару қайықтары мен құтқару желеттерін тез арада сутегіге толтырады.Осыған сәйкес литий гидридінің сумен әрекеттесу реакция теңдеуін жаз..________________________________________________________
Б) Массасы 5г А тұзында 0,6 г көміртек және 2г Б металы бар .Б металы көп мөлшері сумен әрекеттесіп белгілі «әк суы»реактивін түзеді. А тұзы қыздырғанда бөлінетін газ осы реактивпен әрекеттеседі.Мұндағы Б металы және А тұзы болады. 1)Ва. ВаСО3 2) Са, СаСО3 3)Na, Na2CO3 4) Mg, MgCO3 4- тапсырма Металдардың кристалды құрылысы оның маңызды қасиеттерін айқындайды. Олай болса сілтілік (К,Rb және Cs)металдарға қандай кристалдық торлардың қайсысы тән.
| ||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| |||||
| Бағалау |
Бірін- бірі бағалау |
| |||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | №4 сабақ | Уақыты:28,09 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сабақтың атауы | Металдарды ашылу тарихы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Металдардың ашылу тарихын біледі оларды ашылу жылдарын салыстыра отырып, ажырата алады. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Қызығушылықты ояту | 1) Қандай металдар ертеден пайда болды
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сергіту сәті | «Молекулалар» биі | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Жаңа сабақ | Химиялық элементтер — ядродағы зарядтары бірдей болып келетін атомдар тобы. Табиғатта кездесетін барлық жай және күрделі заттар химиялық элементтерден түзіледі. Сілтілік металдар ЛИТИЙ-1817ж. А.Арфедсон ашты. НАТРИЙ мен КАЛИЙДІ-1807 ж. Г.Дэви ашты.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Деңгейлік тапсырмалар 1 тапсырма Мына сұрақтарға жауап беріңдер. 1.Сом күйінде кездесетін металдар. 2.Табиғатта қандай металдар қосылыстары тұз түрінеде кездеседі 3.Оксидтері мен сульфит түрінде кездесетін металдар. 4.Қазақстаның қай жерлерінде қара металдар өндіріледі. 2 тапсырма.Берілген сөз жұмбақты шешіңдер.
1.Б.Ғ.Д 2500 жыл бұрын табылған Америкадан австралияға 1874 жылы еуропадан әкелген металл. 2.Тас дәуірінен белгілі металл. 3.Адамзат қоғамымен бірге туып,бірге жасасып қызмет етіп келе жатқан металл 4.Қола дәуірінен белгілі ежелгілі мысырдан 4ооо жыл бұрын табылған металл. 5. 1828 жылы неміс химигі ф.Велер алған металл. 6.1910 жылы француз химиктері П. Кюри мен М.Кюри ашқан радиоактивті металл 7.Алғаш қытай мен үндістер пайдаланған грек дәрігері Диоскрид «хидр»-«су», «аргирос»-күміс немесе сұйық күміс деп аталған металл. 8. Біздің заманымыздан 3-4 мың жыл бұрын Мысыр Римнен табылған металл. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бағалау |
Бірін- бірі бағалау |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | №5 сабақ | Уақыты:5,10 | |||||
| Сабақтың атауы | Металдардың кернеу қатары | |||||||
| Мақсаты Күтілетін нәтиже | Металдардың алу әдістерін біледі оларды қасиеттерін салыстыра отырып, ажырата алады. | |||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | ||||||
| Қызығушылықты ояту | 1).Қазақстанда аса бағалы металдар өндіріледі ме? 4) Авиация саласына аса қажет металдар қандай қасиетке ие? | |||||||
| Сергіту сәті | «Қара жорға» биі | |||||||
| Жаңа сабақ | Активтік қатар химияда — металдардың электролиттік ерітінділерінің электродтық потенциалының өсу реті бойынша орналасу тәртібі. Оны “ығыстыру қатары” деген атпен 1865 жылы орыс ғалымы Н.Н.Бекетов (1827 — 1911) мынадай жүйемен ұсынды:
Бұл қатарда металдардың электрон беру, яғни тотықсыздандырғыш қасиеті солдан оңға қарай кемиді. Басқаша айтқанда әр металл өзінен кейінгілерін тұздар ерітіндісінен ығыстырып шығарады. Салыстыру үшін қатарға сутек те орналасқан. Активтік қатарда сутекке дейін орналасқан металдар сутекті қышқылдардан ығыстыра алады. Сутектен кейін тұрған мыс, сынап, күміс, платина және алтын қышқыл ерітінділерімен әрекеттеспейді, өйткені сутекті ығыстыра алмайды. Активтік қатарға сүйеніп, металл, тұз және қышқыл ерітінділерінің арасындағы реакциялардың жүру мүмкіндігін алдын-ала болжауға болады. Активтік қатар заңдылығы металды бос күйінде бөліп алуға және оны коррозиядан қорғауға мүмкіндік береді.
| |||||||
| Жаңа сабаққа байланысты жеке тапсырмалар |
2 тапсырма Төменде формулалары келтірілген және екі-екіден алынған заттардың қайсыларының арасында химиялық реакциялар жүреді а) АІ және Нg(NO3)2 б) Zn және MgCI2 в) Fe және СuСІ2 в) Fe және ZnСІ2 реакция теңдеулерін молекулалық теңдеуін жазыңдар. 3 тапсырма Бекетовтің кернеу қатарын пайдаланып металдарды үш топқа бөліңдер.
Металдар кернеу қатары бойынша
Сумен әрекеттеспейтіндер.   Қыздырғанда сумен әрекеттесетіндер.
Кәдімгі жағдайда сумен әрекеттесетіндер еріметалдар
4 тапсырма Берілген реакция теңдеулерін аяқтаңдар.Белсенді металдар өзінен белсенділігі төмен металдарды тұзынан ығыстырып шығарадымүмкін болатын реакция теңдеулерін аяқтаңдар. a)Zn+CuCI2→ Cu+Mg(NO3)2→ Ag+H2O→ Cu+AgNO3→ AI+H2SO4→ Ca+ H2O | |||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| ||||||
| Бағалау |
Бірін- бірі бағалау |
| ||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | ||||||
Қысқа мерзімді жоспар
|
Пәннің аты |
| № 6сабақ | Уақыты: 12.10 | |||||||||||||||||||||||||||||
| Сабақтың атауы | Зертханалық жұмыс.» «Металдар үлгісімен танысу.» | |||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Металдардың физикалық қасиетіне сүйене отырып,оларды ажырата біледі.Ерекшелігін салыстыра отырып анықтайды. | |||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | ||||||||||||||||||||||||||||||
| Қызығушылықты ояту | 1).қандай металдар судан сутегін ығыстарады 4) гидроксид түзетін металдар? | |||||||||||||||||||||||||||||||
| Сергіту сәті | «Қара жорға» биі | |||||||||||||||||||||||||||||||
| Жаңа сабақ | Зертханалық жұмыс металдармен танысу | |||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Тапсырма. Өздеріңе берілген металл үлгілерінің физикалық қасиеттерін зерттеңдер .Жетіспеген мәліметтерді қосымша әдебиеттен алыңдар. Көрнекіліктер: Металдар жиынтығы мен магнит
| |||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||||||||||||||||||||||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| ||||||||||||||||||||||||||||||
| Бағалау | Топтарды бағалау |
| ||||||||||||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | ||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | №7 сабақ | Уақыты:19.10 | ||||||||||||||||||||||||||||||||||
| Сабақтың атауы | Сілтілік металдарға жалпы шолу | ||||||||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Металдардың алу әдістерін біледі оларды қасиеттерін салыстыра отырып, ажырата алады. | ||||||||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | |||||||||||||||||||||||||||||||||||
| Қызығушылықты ояту | 1) сілтілік металдарды қалай алады. 4) Электролиз арқылы алынатын металдарға тән қасиет? | ||||||||||||||||||||||||||||||||||||
| Сергіту сәті | «Молекулалар» биі | ||||||||||||||||||||||||||||||||||||
| Жаңа сабақ | Сілтілік металдарда валенттілік электрондары s-деңгейшесінді орналасқан, сондықтан оларды s-элементтері деп те атайды. S элементтері қалыпты жағдайда кристалдық күйде болады, басқа металдарға қарағанда тығыздықтары төмен (27-кесте). Литий, калий және натрий судан жеңіл (0,53 - 0,86 г/см3), сондықтан су бетінде қалқып жүреді. Олардың балқу және қайнау температуралары төмен, бұл олардың кристалдық торларындағы металдық байланыстың әлсіз болуынан. Бұл металдар және олардың қосылыстары жалын түсін төмендегідей өзгертеді: литий — кармин қызыл, натрий - сары, калий - күлгін түске бояйды. Бұл элементтердің сыртқы электрондық қабаттарында тек бір ғана электрондары бар, оларды оңай беріп жіберіп, өзінің алдында тұрған бекзат газдардың аяқталған электрондық құрылысын қабылдайды. Қосылыстарында үнемі бір валентті, тотығу дәрежелері -0, + 1, күшті тотықсыздандырғыштар. Тотықсыздандырғыштық қасиеттері топ бойынша жоғарыдан төмен қарай артады, себебі атом радиустары осы бағытта өседі. Литий сумен енжарлау, ал натрий белсендірек, калий шабытты әрекеттессе, рубидий қопарылыс бере реакцияласады. Бұл элементтердің оксидтері – негіздік оксидтер, ал гидроксидтері суда жақсы еритін сілтілер, олардың қасиеттері жоғарыдан төмен қарай артады. Литийді 1817 жылы А. Арфведсон, рубидий мен цезийді 1861 жылы Р. Бунзен, натрий мен калийді 1807 жылы Г. Дэви ашқан. Литий ұшақ құрылысында қолданылатын қорғасынды, алюминийлі құймалар алу үшін пайдаланылады, құймаларға қаттылық қасиет береді. Рубидий мен цезий фотоэлементтерді жасауда қолданыс табады, өйткені жарық әсерінен ядросымен нашар байланысқан электрондары оңай үзіліп кетеді.
| ||||||||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Деңгейлік тапсырмалар1тапсырма Сілтілік металдар және оның қосылыстарының қасиеттерінің өзара ұқсастықтарын атом құрылысы мен периодтық заң тұрғысынан қалай түсіндіруге болады. 2 тапсырма Химиялық диктант қажетті сөздерді жазыңдар
3 тапсырма Сілтілік металдарың ашылуын ашқан ғалымдарды кестеге толтырыңдар.
4 тапсырма Калий бромидінің натрий хлориді ерітінділерінің электролиз сызбанұсқасын құрындар.
| ||||||||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||||||||||||||||||||||||||||||||
| Үйге тапсырма | Тұрмыста қолданылатын натрий тұздары туралы эссе |
| |||||||||||||||||||||||||||||||||||
| Бағалау |
Бірін- бірі бағалау |
| |||||||||||||||||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Уақыты: 26.10 | №8 сабақ |
| ||||||||||||||||||||||||||||||||||
| Сабақтың атауы | Натрийдің физикалық және химиялық қасиеттері | ||||||||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Натрийдің физикалық және химиялық қасиеттерін қасиетін біле отырып ерекшілігін ,белсенді металдің қасиетін біледі.Ерекшелігін салыстыра отырып анықтайды. | ||||||||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | |||||||||||||||||||||||||||||||||||
| Қызығушылықты ояту | Сұрақ жауап иә және жоқ 1) сілтілік металдар судан сутегін ығыстарады 4) ас тұзының құрамында болтын металдар? | ||||||||||||||||||||||||||||||||||||
| Сергіту сәті | «Қара жорға» биі | ||||||||||||||||||||||||||||||||||||
| Жаңа сабақ | Сілтілік металдардың ең көп қолданылатын өкілі - натрий. Сондықтан сілтілік металдардың қасиеттерімен осы металдың мысалында танысамыз. Физикалық қасиеттеріНатрий пышақпен оңай кесілетін жұмсақ металл (р =0,97, г/см3), жаңа кескен кезде жылтырап тұрады, бірақ ауада оңай тотығып күңгірт тартады, сондықтан ол барлық сілтілік металдар сияқты сусыз керосиннің астында сақталады. Электр тоғы мен жылуды өте жаксы өткізеді. Натриймен жұмыс істегенде аса сақ болу керек, оның түйірін қолмен ұстауға болмайды, себебі ол терідегі сумен әрекеттесіп, оны күйдіреді. Металдың қалдығын кез келген жерге тастауға болмайды. Химиялың қасиеттері Натрий химиялық белсенді элемент, себебі валенттілік электроны ядросымен әлсіз байланысқан, олай болса, валенттілік электронын оңай беріп, тотықсыздандырғыштық қасиет көрсетеді. Сонда мына үдеріс жүреді:Na0 - е — Na+ | ||||||||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | 1тапсырмаСілтілік металдар және оның қосылыстарының қасиеттерінің өзара ұқсастықтарын атом құрылысымен периодтық заң тұрғысынан қалай түсіндіруге болады. 2 тапсырма Химиялық диктант қажетті сөздерді жазыңдар
3 тапсырма Сілтілік металдарың ашылуын ашқан ғалымдарды кестеге толтырыңдар.
Металл натрийдің қолданылуы. Na
5 тапсырма Натрийдің оттекпен ,галогендер және фосформен әрекеттесу реакция теңдеулерін жазыңдар. | ||||||||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||||||||||||||||||||||||||||||||
| Үйге тапсырма | Натрий тұздарын қолданатын салалары |
| |||||||||||||||||||||||||||||||||||
| Бағалау | Топтарды бағалау |
| |||||||||||||||||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 9сабақ | Уақыты: 9.11 | |||||||||||||||||||||||||||||||||||||
| Сабақтың атауы | Натрий тұздары олардың қолданылуы | |||||||||||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Натрий тұздары олардың қолданылуын біледі.Өндірісте және тұрмыста қолдану салаларын біледі | |||||||||||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Не қорқынышты | Оқушылар шеңберде жиналып,бір қалтаға өздері қорқатын сөздерді жазып салады.кейін оны мусорға салады | ||||||||||||||||||||||||||||||||||||||
| Қызығушылықты ояту | Сөзжұмбақ жасыру | |||||||||||||||||||||||||||||||||||||||
| Сергіту сәті | «гүл сыйлау» биі | |||||||||||||||||||||||||||||||||||||||
| Жаңа сабақ | Натрий қосылыстары – натрий элементі түзетін химиялық қосылыстар. Натрий қосылыстары бір валентті. Натрий оттекпен қосылып натрий оксидін (Na2O) оттек мөлшері артық болса натрий асқын тотығын (Na2O2) түзеді. Na2O – түссіз кристалл, булану t 1275С. Сумен өте жақсы әрекеттеседі. Na2O2 – түссіз кристалл, тығыздығы 2,6 г/см3, ыдырау t 460С. Суда ериді, ауадан ылғал және СО2 газын сіңіреді. Күшті тотықтырғыш. Органикалық заттармен жанасқанда тұтанады. Сулы ерітіндісі мата, қағаз ағартуда, сүңгуір қайықтарында оттекті регенерациялауда, тыныс алу аппаратында қолданылады. Натрий галогендермен NaF, NaCl, NaBr, NaІ қосылыстарын түзеді. Натрий хлориді (ас тұзы, тас тұзы) NaCl – түссіз кристалл, тығыздығы 2,161 г/см3, балқу t 801С, қайнау t 1465С, суда, аммиакта, этиленгликолда, құмырсқа қышқылында, метанолда ериді. Табиғатта – галит минералы теңіз және мұхит суларында, тұзды көлдердің рапаларында, грунт тұздықтарында кездеседі. Cl2, Na2CO3, NaOH, т.б. алуда, тамақ өнеркәсібінде консервілеуші зат ретінде қолданылады. Натрий гидроксиді (күйдіргіш натр, каус-тик. сода) NaOH – түссіз кристалл, тығыздығы 2,13 г/см3, балқу t 322С, қайнау t 1385С, суда, этанолда, метанолда ериді. Күшті негіз; ауадан СО2 газы мен суды сіңіреді. Сулы ерітіндісі шыныны, балқымасы фарфор мен платинаны коррозияға ұшыратады. Тері және шырыш қабықтарын күйдіреді. Мұнайды, майды тазалауда, қағаз, сабын, жасанды талшық, т.б. өндірісінде, газ және көптеген органикалық сұйықтықтарды құрғатқыш агент ретінде қолданылады. Натрий гидрокарбонаты (натрий бикарбонаты, ас содасы) NaHCO3 – кристалл, ыдырау t 100 – 150С, суда ериді. Нан пісіруде және кондитерлік өнімдер дайындауда, дәрілік зат ретінде қолданылады. Натрий карбонаты (кальцинирленген сода) Na2CO3 – балқу t 853С, суда ериді. Шыны өнеркәсібінде шихта құраушы, сабын, жуғыш заттар, т.б. натрий қосылыстарын алуда қолданылады. Натрий сульфаты Na2SO4 – түссізкристалл, тығыздығы 2,698 г/см3, балқу t 884С, суда ериді. Табиғатта тенардит, мирабилит минералы түрінде кездеседі. Na, Na2S, H2SO4, (NH4)2SO4, сода, т.б. алуда шикізат ретінде қолданылады. Натрий нитраты (натрий селитрасы) NaNO3 – балқу t 308С, бұдан жоғары температурада ыдырайды. Суда, глицеринде, сұйық аммиакта ериді. Табиғатта чили селитрасы түрінде кездеседі. Тыңайтқыш, натрий тұздары және нитраттар өндірісінде, металл өңдеу өнеркәсібінде, т.б. қолданылады. Натрий алюминаты NaAlO2 – балқу t 1800С, суда Al(OН)3 түзе гидролизденеді. Спиртте ерімейді. Суды жұмсартуда, тазалауда, матаны бояуда қолданылады. Натрий ацетаты СН3 СООNa – балқу t 324С, су, спирт, эфирде ериді. Бояу, сабын, сірке ангидриді, ацетилхлорид, т.б. өндірісінде, медицинада қолданылады. Натрий-органикалық қосылыстар – натрий атомы көміртек атомымен тікелей байланысқан органикалық қосылыстар. Олар қатты, химиялық активті заттар, қыздырғанда балқымай айырылады, ауада өздігінен тұтанады. Су, спирт, қышқылдармен оңай реакцияласады. Қанықпаған көмірсутектермен және ароматты, гетероциклді қосылыстармен реакцияласады. Алкилдейтін зат ретінде, т.б. қолданылады.
| |||||||||||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | 1-тапсырма Берілген натрий катионын мына аниондарды пайдаланып қосылыстарын жазып атаңдар,
CO32- SO42- Na+ Na+
CI- OH-
NO3-
2-тапсырма.Мына тұздардың ас содасыны,натрий селитрасының мирабилит,кальцийленген сода формуласын жазып,олардың құрамындағы натрийдің массалық үлестерін анықтаңдар,
3 тапсырма Берілген қосылыс аттарын дұрыс анықтаған жағдайда натрийге тән қасиетін оқуға болады.
4-тапсырма мына айналымдарды жүзеге асырындар (А,В және С) белгісіз қосылыстарды анықтаңдар. B Na2S
5 тапсырма Массасы 10,6г натрий карбанатын тұз қышқылымен әрекеттестіргенде (қ.ж) түзілген көмір қышқыл газының көлемі қандай. | |||||||||||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||||||||||||||||||||||||||||||||||
| Үйге тапсырма | Натрий сілтісінің қолданылуы |
| ||||||||||||||||||||||||||||||||||||||
| Бағалау | Топтарды бағалау |
| ||||||||||||||||||||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | ||||||||||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 10 сабақ | Уақыты: 16.11 | |||||
| Сабақтың атауы | Зертханалық жұмыс «Натрий гидоксидінің қасиетін зерделеу» | |||||||
| Мақсаты Күтілетін нәтиже | Натрий гидроксидінің белсенділігін сипаттай алады. қасиетіне сүйене отырып,оларға тән реакция теңдеуін жаза алады. | |||||||
| Психологиялық ахуал | Психологиялық дайындық «Қара жорға» биі | Оқушылар шеңберде жиналып,билейді. | ||||||
| Қызығушылықты ояту | 1) Диктант. Ия, және Жоқ 1. 1807 жылы ағылшын ғалымы Дэви алды (ия) 2. I-ші топтың қосымша топшасында (жок) 3. Сілтілік метал (ия) 4. Тотығу дәрежесі +1 (ия) 5. Ас тұзының минералын галит деп атайды (ия) 6. Натрий қан плазмасында кездеседі (ия) 7. Натрий қатты металл (жоқ) 8. Электр тогын өткізеді (ия) 9. Ядролық реакторларда жылу тасымалдағыш (ия) 10. Су бетінде жүгіреді (ия) 11. Инертті газдармен әрекеттеседі (жоқ) 12. Бейметалдармен әрекеттеседі (ия) 13. Натрий ионы жалынды сары түске бояйды (ия) 14. Натрий судан ауыр (жок) .
| |||||||
| Сергіту сәті | «Қара жорға» биі | |||||||
| Жаңа сабақ | Зертханада натрий гидроксидін натрийді және оның оксидін сумен әрекеттестіру арқылы алады: 2Na + 2Н20 = 2NaOH + Н2 Na2O Н2O = 2NaOH Физикалық қасиеті Өндірісте натрий гидроксиді оның тұздарының ерітінділерінің электролизі нәтижесінде түзіледі. NaOH - ақ түсті қатты зат, күйдіргіш натр деп аталады, себебі қағазды, теріні күйдіреді. Натрий гидроксиді суда жақсы еритін су тартқыш (гидроскопиялық) зат болғандықтан жақсы жабылған ыдыста сақтау керек. Қолға тигенде сабындай болып сезіледі, натрий гидроксидін суға еріткенде көп мөлшерде жылу бөлінеді, сондықтан оны кәрлен ыдыста еріту керек. Химиялық қасиеті
| |||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Натрий гидроксиді берілген заттардың қайсысымен әрекеттесе алады: | |||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||
| Үйге тапсырма | Натрий гидросидінің өндірісте қолданылуы |
| ||||||
| Бағалау | Топтарды бағалау |
| ||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | ||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | №11 сабақ | Уақыты: 23.11 | ||||||||||||
| Сабақтың атауы | калийге сипаттама | ||||||||||||||
| Мақсаты Күтілетін нәтиже | Калийдің қасиетіне сүйене отырып,олардыерекшелігін анықтайды. | ||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Ауа райы | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | |||||||||||||
| Қызығушылықты ояту | 1).қандай металдар судан сутегін ығыстарады 4) гидроксид түзетін металдар? | ||||||||||||||
| Сергіту сәті | «Қара жорға» биі | ||||||||||||||
| Жаңа сабақ | Калий, К – элементтердің периодтық жүйесінің I тобындағы химиялық элемент. Ат. н. 19; ат. м. 39,102; балқу t 63,55•С; қайнау t 760•С; тығыздығы 0,862 г/см3. Калийді 1807 ж. ағылшын химигі Г.Деви ашқан. Түсі күмістей ақ, жеңіл, жұмсақ, оңай балқитын металл. Негізгі минералдары сильвин, карналлит, кайнит. Табиғатта тұрақты екі изотопы 39К, 41К және бір радиоактивті изотопы 40К бар. Таза Калийді оның балқыған қосылыстарын (KОН, KCl) электролиздеп не осы балқымаға Na қосып, КОН(KCl)+Na=NaOH(NaCl)+К реакциясы бойынша өндіреді. Калий ауадағы оттекпен жақсы әрекеттесіп, К2О – оксид, К2О2 – пероксид, КО2 – асқын пероксид түзеді. Барлық металлоидпен, сумен, спирттермен жақсы әрекеттеседі, суда жанады. Таза Калий зертханада, синтетикалық каучук алуда, катализатор ретінде, су асты мен ғарышта асқын пероксидтен (4КО2+СО2=2К2СО2+3О2) оттек алу үшін қолданылады. 42К жасанды изотопы – химияда, медицинада және биологияда қолданылатынрадиоактивті индикатор. Калий қосылыстары тыңайтқыш ретінде сіріңке, оқ-дәрі, ем-дәрі жасау, сабын өндіру, т.б. үшін пайдаланылады. | ||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Периодтық жүйедегі орыны бойынша калий жай зат ретінде сипаттама беріңдер.
2 тапсырма Калий өте белсенді болғандықтан кәдімгі температурада оттегімен,күкіртпен,азотпен әрекеттесіп оксидтер,сульфиттер,нитраттар түзеді.осыған сәйке реакция теңдеулерін жазыңдар. 3 тапсырма Калий белсенді металдар болғандықтан тек электролиздеу арқылы алынады.Берілген сызбаға сәйкес калий хлориді балқымасы мен калий гидроксидін электролиздеу процесінің теңдеуін жаз................ .................................................................................................................. 4-тапсырма Калийдің оттекпен қосылысында металдың массалық үлесі 44,8 –ды құрайды .Осы қосылыстың қарапайым формуласы анықтаңдар 5-тапсырма. есептеңдер. Қара дәрі копарылғанда мынандай реакция жүреді:2KNO3+S+3C→K2S+N2+3CO2↑ Көлемі 44,8л(қ.ж)газ қоспасы түзілу үшін қанша (моль)калий нитраты қажет? | ||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||||||||||
| Үйге тапсырма | Берілген тапсырмаларды аяқтау |
| |||||||||||||
| Бағалау | Топтарды бағалау |
| |||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | №13 сабақ | Уақыты: 30.11 | ||||||||||||||
| Сабақтың атауы | Калий қосылыстары | ||||||||||||||||
| Мақсаты Күтілетін нәтиже | Калий қосылыстарын ажырата біледі.Ерекшелігін салыстыра отырып анықтайды. | ||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық Еркін атмосфера | Оқушылар шеңберде жиналып,мұғаліммен бірге бүгінгі сабақтағы көңіл күйлерін білдіреді. | |||||||||||||||
| Қызығушылықты ояту | Мына заттар сілтілік металдардың табиғатта кездесетін қосылыстарының аттары: 1)натрий хлориді; 2)сильвинит (натрий хлориді-калий хлориді) 3)карналит (калий хлориді-магний хлориді-6 су молекуласы) 4)калий хлориді 5)микрабилит (натрий сульфаты-10 су молекуласы) Осы заттардың формуласын жазыңдар. | ||||||||||||||||
| Сергіту сәті | «Қара жорға» биі | ||||||||||||||||
| Жаңа сабақ | Дэви Гемфри 1807 жылы ағылшын химигі Дэви қатты күйдіргіш калиді электролиздеу арқылы калийді бөліп алды және оны «потассий» (лат. potassium; бұл атау әлі күнге ағылшын, француз , испан, португал тілдерінде қолданылады). В 1809 жылы Л. В. Гильберт «калий» (лат. kalium, араб. аль-кали —ПОТАШ) Калий
Калий бос күйінде кездеспейді. Ол сильвинит KCl•NaCl, карналлит KCl•MgCl2•6H2O, сондай-ақ кейбір өсімдіктердің күлдерінде K2CO3 (поташ) кездеседі. Калий барлық өсімдіктердің құрамында кездеседі.
| ||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | сабақКалий қосылыстары, 1-тапсырмаКалий оксиді мен калий гидроксидін салыстыра сипаттаңдар.
2 тапсырма Берілген тұздардың сәйкес формулаларын жазыңдар Калий тұздары формулалары Сельвинит .................. Карнилит .................. Сақар ................... Бертолле тұзы ................... 3 тапсырма Мына заттардың (K2CO3,NaCI∙ KCI,KNO3) құрамыдағы калийдің массалық үлесін анықтаңдар. ............................................................................................................................ ............................................................................................................................
4 тапсырма Берілген қосылыстары өнеркәсіпте қолданылуын жазыңдар.
5 тапсырма Егер суға массасы 4,6г натрий мен 3,9 г калийден тұратын құйманы салса,қанша көлем сутек (қ,ж) бөлінеді. | ||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||||||||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| |||||||||||||||
| Бағалау | Топтарды бағалау |
| |||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 12сабақ | Уақыты: 7,12 | ||||
| Сабақтың атауы | Калийдің қасиеті мен биологиялық маңызы. | ||||||
| Мақсаты Күтілетін нәтиже | Металдардың физикалық қасиетіне сүйене отырып,оларды ажырата біледі.Ерекшелігін салыстыра отырып анықтайды. | ||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | |||||
| Қызығушылықты ояту | 1).қандай металдар судан сутегін ығыстарады 4) гидроксид түзетін металдар? | ||||||
| Сергіту сәті | «Қара жорға» биі | ||||||
| Жаңа сабақ | Калийдің қолданылуы Құймасы атомдық реакторларда сұйық металдық жылу тасымалдағыш ретінде қолданылады; Тыңайтқыш ретінде пайдаланамыз; Оның қосылыстары жалынды күлгін түске бояйды; Биологиялық рөлі Калий — маңызды биогенді элемент, әсіресе өсімдіктер әлемінде. Топырақта калий жетіспесе өсімдік өте нашар дамиды. Өнім түсімі азаяды, сондықтан 90 % өндірілген калий тұздары тыңайтқыштар түрінде қолданылады.
| ||||||
| Жаңа сабаққа байланысты жеке тапсырмалар |
KCl —
KOH —
KCL KMn О4
| ||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||
| Үйге тапсырма | Металдардың алу әдістеріне деректер әкелу |
| |||||
| Бағалау | Топтарды бағалау |
| |||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 14сабақ | Уақыты: 14,12 | |||||||||||||||||||||||||||||||||
| Сабақтың атауы | Сілтілік металдарға тест жұмысы | |||||||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Металдардың физикалық қасиетіне сүйене отырып,оларды ажырата біледі.Ерекшелігін салыстыра отырып анықтайды. | |||||||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | ||||||||||||||||||||||||||||||||||
| Қызығушылықты ояту | 1
| |||||||||||||||||||||||||||||||||||
| Сергіту сәті | «Қара жорға» биі | |||||||||||||||||||||||||||||||||||
| Жаңа сабақ | Өткен тарау бойынша қайталау,өткен тақырыптарды пысықтау | |||||||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар |
| |||||||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||||||||||||||||||||||||||||||
| Үйге тапсырма | Сілтілік жер металдарға лездеме |
| ||||||||||||||||||||||||||||||||||
| Бағалау | Өзін-өзі бағалау |
| ||||||||||||||||||||||||||||||||||
| Кері байланыс | Жасыл*- білдім Сары- толық емес Қызыл- әліде дайындалу керек | севетофор | ||||||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 15сабақ | Уақыты: 21.12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сабақтың атауы | ІІ топша металдарына жалпы сипаттама | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | ІІ топша металдарына жалпы сипаттама бере отырып оларды жалпы қасиеттерін біледі | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Қызығушылықты ояту | Неге сілтілік жер металдар аталған
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сергіту сәті | «Қара жорға» биі | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Жаңа сабақ | Сілтілік жер металдар — екінші топта орналасқан металдар. Оларға: бериллий, магний,кальций, стронций, барий, радий жатады. Бұл элементтердің сыртқы электрондық қабаттарында екі электрондары болады, оларды оңай беріп жіберіп, өзінің алдында тұрған бекзат газдардан аяқталған электрондық құрылысын қабылдайды. Тарих сілтілік жер металдар. Әктас, Ежелде (5000 жыл бұрын) мәрмәр және алебастр мысырлықтар пайдаланылды құрылыс бизнесінде. 18 ғасырдың соңына дейін химиктер жай белгілі сенген зат. 1746 жылы Дж Pott өте таза және кальций оксиді сипатталған. B Заттар - Lavoisier әк, магний, барит ұсынды 1789 кешені. Ұзақ барий мен стронций, оларды ашу алдында «undeciphered» тиісінше, қызыл пиротехникалық пайдаланылатын, және оның қосылыстары жасыл шамдары. Стронций ортасында 40-шы жылға дейін, ең алдымен, болды металл «қызықты шамдары». 1787 жылы Scottish жақын қорғасын шахтада Strontsian ауылы strontianite SrCO 3 деп аталатын жаңа минерал, табылған. A. Кроуфорд басқа болуын ұсынды белгісіз «жер». 1792 жылы Т. Hop минерал құрамы табылған екенін дәлелдеді Стронций - жаңа элемент бар. Sr пайдаланып (OH) 2 деп жатқанда оқшауланған disaharat ерімейтін стронций (C 12 H 22 O 4 . 2SrO ) Сірне қант өндіру үшін. Sr өндіру артты. Алайда, ол көп ұзамай болды бұл ұқсас кальций saccharate, сондай-ақ еритін және кальций оксиді емес деп атап өтті әрине арзан болды. Стронций қызығушылық бірден жоғалып және қайтадан өсті ол тек өткен ғасырдың 40-шы жылдары болып табылады. Ауыр шпатты бірінші белгілі болды барий қосылыстары. XVII ғасырдың басында ашылды. Италиялық Алхимик Kastsi...
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | 1 тапсырма Периодтық жүйе бойынша 2 топша «сілтілік жер металлдарына сипаттама беріңдер.
2 тапсырма.Кальций мен магнийді өзара салыстырып,айырмашылығымен ұқсастықтарын сипаттаңдар.
3 тапсырма Тұрмыста қолданылатын кальций тұзы мен магний тұздарын атап,колданылатын жерлерін көсетіңдер.
4 тапсырма .1,84г доламитті ерітуге тұз қышқылының қандай мөлшері жұмсалады.
5 тапсырма.Массасы 6г ІІ-Атопша элементін тотықтыруға 2,8г оттегі жұмсалса,ол қандай металл болғаны. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Үйге тапсырма | Сілтілік жер металдарға лездеме |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бағалау | Топты бағалау |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 16 сабақ | Уақыты: 28.12 | ||||||||||||||||||||
| Сабақтың атауы | Кальцийді алу және қолдану | ||||||||||||||||||||||
| Мақсаты Күтілетін нәтиже | Кальцийді алу және қолдану жолдарын біледі және анықтай алады. | ||||||||||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | |||||||||||||||||||||
| Қызығушылықты ояту |
Ұлу тас деген қандай тас
| ||||||||||||||||||||||
| Сергіту сәті | «Қара жорға» биі | ||||||||||||||||||||||
| Жаңа сабақ | Кальций -IV период, II топтың негізгі топшасының элементі. Реттік немірі 20, ендешеядросында 20 протон мен 20 нейтроны бар (Аr=40), электрондарының жалпы саны да 20. Кальцийдің электрондық формуласы ls22s22p63s23p64s2, валенттілік электрондары 4s2 болғандықтан кальций косылыстарында II валентті.Кальций ақ түсті, жеңіл (р=1,55 г/см3), сілтілік металдардан қаттырақ зат, t°балқу = 851°С, керосиннің астында сақталады.Ат. н. 20; ат. м. 40,08; балқу t 842°С; қайнау t 1495°С тығыздығы 1,55 г/см2. Кальцийді 1808 жылы ағылшын ғалымы Г.Дэви ашқан. Түсі күмістей ақ, жеңіл металл, белгілі изотоптары 14, табиғиизотоптары 6. Негізгі минералдары: кальцит, ангидрит, гипс, флюорит, апатит, т.
| ||||||||||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Кальцийдіалу және қолдану.
1 тапсырма.Химиялық диктант Кажетті сөздерді пайдаланып мәтінді оқыңдар. Кальций кең тараған элементке жатады.Жер қыртысында кальций құрамы бойынша ........орында.массалық үлесі ..... болады.Кальций адам ағзасында ,,,,,,,,,, .........және ....... 1кг-ға дейін кальций болады.Көп тараған қосылысы.......әртүрлі минералдар түзеді.Ал магний атомы жасыл өсімдіктердің ,,,,,,,,, құрамында болады.Оның қатысуынсыз ...........процесі жүруі мүмкін емес.онсыз тіршілік жоқ.
2 тапсырма Кальций қатыса жүретін мына реакция теңдеулерін аяқтап,алынған өнімді атаңдар. Кальций+ хлор кальций + тұз қышқылы Кальций + оттегі кальций + күкірт қышқылы. 3 тапсырма. Кальций қосылыстарын атаңдар.
4 тапсырма.Ерігіштік кестені пайдалан кальций катионымен мына аниондар сәкестендіріп тұздардың формуласын жазыңдар.
5 тапсырма.Кейбір аллергиялық және тері ауруларын емдегенде кальций хлоридін ерітіндісі қолданылады 100г суда кальций хоридінің кристаллогидратының 11г еріткенде түзілген ерітіндінің массалық үлесі және көлемін анықтаңдар | ||||||||||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| ||||||||||||||||||||||
| Үйге тапсырма | Техникалық кальций қосылыстары |
| |||||||||||||||||||||
| Бағалау | Өзін-өзі бағалау |
| |||||||||||||||||||||
| Кері байланыс |
| Смайликтерді өзі қалаған нұсқаға жабыстырады | |||||||||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 17 сабақ | Уақыты: 11.01 | |||||||||||||
| Сабақтың атауы | Кальций оксиді мен гидроксидтері | |||||||||||||||
| Мақсаты Күтілетін нәтиже | Кальций оксиді мен гидроксидінің қасиеттерін салыстыру;еркешелігін білу | |||||||||||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | ||||||||||||||
| Қызығушылықты ояту | тұрмыста қолданылатын әк формуласы қалай аталады.
| |||||||||||||||
| Сергіту сәті | «Қара жорға» биі | |||||||||||||||
| Жаңа сабақ | Кальций оксиді немесе сөндірілмеген әк немесе кирабит — негіздік оксид, ақ ұнтақ. Құрылымдық формуласы: Ca=O (химиялық формуласы CaO) Кальций оксиді — ақ түсті қиын балқитын зат. Техникада оны "сөндірілмеген әк" деп атайды. Оны әктасты жоғарытемпературада (1000 C0 шамасында) қыздырып, ыдырату арқылы алады: СаС03 =t= СаО + СО2↑- 180кДж Кальций оксиді — нағыз негіздік оксид. Кальций сілтілікжер металл болғандықтан, оның оксиді сумен оңай әрекеттесіп кальций гидроксидін, яғни сілтісін түзеді: Бұл реакция өте қуатты жүреді, су бұрқылдап "қайнап" жатады, тіпті біразы буланады. Нөтижесінде, сөндірілген әк деп аталатын көпсіген кеуек ақ ұнтақ түзіледі. Кальций гидроксиді суда аз ериді. Оның қанық ерітіндісі лабораторияда әк суы деген атпен жиі колданылады. Кальций гидроксиді ерітіндіде иондарға толық диссоциацияланады: Са(ОН)2 = Са+2 + 2ОН Сілті ерітіндісінің түзілгені фенолфталеиннің таңқурай түске боялуынан байқалады. Кальций гидроксиді қышқылдармен және қышқылдық оксидтермен әрекеттесіп бейтараптанады. Бұл реакцияны зертханада көмірқышқыл газын анықтау үшін қолданады. Әқ суына көмір қышқыл газын жібергенде, ол алдымен ерімейтін карбонат түзіп, лайлана бастайды: Са(ОН)2 + CO2 = СаСО3↓ + Н2О
Қатты күйдегі кальций гидроксидінің Са(ОН), судағы жүзгіні, түсі ақ болғандықтан, техникада әк суті деп аталады. Сөндірілген өк құрылыста кеңінен қолданылады. Әк сүтін құрылыста әктеу үшін пайдаланады, ал сөндірілген өктің күммен қоспасын кірпіш қалаганда және сылағанда байланыстырушы зат ретінде жүмсайды. Бүл коспа ауада біртіндеп "ұстасып" қатая бастайды, себебі көмірқышқыл газымен әрекеттесіп, қатты карбонат (бор) түзеді.
| |||||||||||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | 1-тапсырма Кальций оксидімен әрекеттесетін заттарды «ноль» және «шаршы» түрінде белгілеңдер.
2 тапсырма Кестені толтырыңдар. Берілген қасиеттер қай қосылысқа сай келеді. Реттік саны бойынша кестеге толтырыңдар.
1)негізгі оксид 2)Қиын балқитын зат 3)ақ ұнтақ 4)сөндірілмеген әк 5)суда нашар ериді 6)әк суы 7)көмір қышқыл газымен тұнба түзеді. 8)сумен әрекетесіп әк суын түзеді. 9)зерханада көмір қышқылына реактив болады.10)
3 тапсырма.Төмендегі реакция теңделерін аяқтап,толық және қысқарген теңдеулерін жазып,реакция типтерін анықтаңдар. А) Сөнділмеген әк+көмірқышқыл газы Б) Кальций гидроксиді + тұзқышқылы мен
4 тапсырма Массасы 20г аммоний хлориді кальций гидроксидінің артық мөлшерімен әрекеттескенде неше литр аммиак (қ.ж) түзіледі. Кқмір қышқыл
5 тапсырма Тыныс алғанда көмірқышқыл газының шығатынын тәжірибе арқылы кальцидің қандай қосылысы арқылы дәлелдеуге болады.
| |||||||||||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||||||||||
| Үйге тапсырма | Сілтілік жер металдарға лездеме |
| ||||||||||||||
| Бағалау | Өзін-өзі бағалау |
| ||||||||||||||
| Кері байланыс | Жасыл*- білдім Сары- толық емес Қызыл- әліде дайындалу керек | севетофор | ||||||||||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 18сабақ | Уақыты: 18.01 | |||||
| Сабақтың атауы | Кальций тұздары және бинарлы қосылыстары. | |||||||
| Мақсаты Күтілетін нәтиже | Кальций тұздары және бинарлы қосылыстары | |||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | ||||||
| Қызығушылықты ояту | Медицинада қолданылатын гипс пен алебастырдың қандай ұқсастығы бар ма?
| |||||||
| Сергіту сәті | «Қара жорға» биі | |||||||
| Жаңа сабақ | Кальций тұздарының құрылыста үлкен маңызы бар. Олардың сумен химиялық байланысып, кристалгидраттар түзетін қабілетін кеңінен пайдаланады. Мәселен, табиғи гипсті CaS04 • 2Н20 өртегенде, өзінің кристалдық суының біразын жоғалтып, алебастрға айналады: CaS04 • 2НгО = CaS04 • 0,5Н20 + 1,5Н20 Алебастр ұнтағын сумен араластырғанда кері реакция жүріп, қайтадан гипс түзіп катаяды. Гипстің бұл қасиетін тек құрылыста қолданып коймайды, оны өшекейлік бедер, статуэткалар жасағанда және медицинада пайдаланады. Көпшілікке белгілі цементтің күрамында кальцийдің силикаттары мен алюминаттары жүреді. Бұл тұздарды күммен қосып араластырғанда қатая бастайды, ейткені түзілетін кристалдар өзара ұстасып, берік материалға айналады. Табиғаттағы кальций қосылыстарының айналымы. Табиғатта жүретін көптеген процестер кальций түздарымен байланысты болады. Осындай процестің моделі ретінде жоғарыда қарастырылған кальций карбонатыныңгидрокарбонатқа айналуын және оған кері реакцияларды алуға болады. Жаңбыр және басқа да табиғи сулар ауадағы кемірқышкыл газын ерітіп, көмір қышқылын түзеді: H2O + CO2 ↔ H2CO3 Қышкыл ерітіндісі топыраққа сіңіп, жолында әктасының қорын кездестірсе, оны ерітіп, карбонатты гидрокарбонатқа айналдырады. Гидрокарбонат оңай еріп кетеді, нәтижесінде әктасының қалың жынысында үлкен бос кеңістік ("карсты үңгірлер") пайда болады. Кальций гидрокарбонатының ерітіндісі баяу ыдырайды, ал кыздырғанда, бұл процесс күшейе түседі: Карбонаттардың гидрокарбонаттарға айналуы және кері жүретін процесс атмосферада көмірқышқыл газының шамасын (ауада 0,3% CO, бар) тұрақты ұстап тұруға тікелей әсер етеді. Ауадағы С02 мөлшері арта бастаса, оның суда еруі молайып, мұхиттағы өктастар оны байланыстырып, ерімтал түзға айналдырады. Ал көмірқышқыл газы азая бастаса, мүхиттагы гидрокарбонаттар ыдырап, С02 бөле бастайды, сөйтіп, ерімейтін карбонаттарды түнбаға түсіреді. Кальцийдің қоспалары табиғатта кең таралған. Кальций қосылыстарының бір-біріне айналуы, табиғаттағы кальцийдің айналымын іске асырады, сөйтіп, көптеген геологиялық процестер жүреді. Осылайша бір-біріне айналуының нәтижесінде кальцийдің қосылыстары адам өмірінде маңызды рөл атқарады. Кальцийдің қосылыстары құрылыста кеңінен қолданылады.
| |||||||
| Жаңа сабаққа байланысты жеке тапсырмалар |
| |||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||
| Үйге тапсырма | Сілтілік жер металдарға лездеме |
| ||||||
| Бағалау | Өзін-өзі бағалау |
| ||||||
| Кері байланыс | Жасыл*- білдім Сары- толық емес Қызыл- әліде дайындалу керек | севетофор | ||||||
Қысқа мерзімді жоспар
|
Пәннің аты | Химия қолданбалы | № 19 сабақ | Уақыты: 25.01 | |||||
| Сабақтың атауы | Судың кермектігі | |||||||
| Мақсаты Күтілетін нәтиже | 1.Судың кермектігі ұғымымен таныстыру, пайда болуы себептерін, оны кетірудің иондық механизімін түсіндіру, суды жұмсартудың негізгі әдіс-тәсілдерін білу | |||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | ||||||
| Қызығушылықты ояту | Табиғатта таза су бар ма? Кермек судың құрамында қандай тұздар көп Жұмсақ су болама?
| |||||||
| Сергіту сәті | «Қара жорға» биі | |||||||
| Жаңа сабақ | Табиғатта үздіксіз жүріп жататын кальцйи және магний қосылыстарының бір- біріне айналулары судың кермектігін түсінуге мүмкіндік береді. Табиғи суда еріген гипс, магний гидрокобонаты, кальций гидрокорбонаты суға кермектік қасиет береді. Кермек суда сабын нашар көпіреді. Себебі, судағы кальций және магний иондары сабынның құрамындағы органикалық қышқылдың қалдығымен ерімейтін тұз түзеді. Сондықтан кермек суда кір жуғанда сабынның бір бөлігі кальций және магний иондарын тұнбаға түсіруге жұмсалады. Кермек судың басқа да зияны бар. өнеркәсіпте суды көп мөлшерде қайнататын бу қазандарында қақ тұрып, отын артық шығындалады. Кермек су дәрі- дәрмек әзірлеуге жарамайды, матаны бояуға кедергі жасайды. Кермек суда тағам нашар піседі, себебі Са 2+ катиондары тағамдағы белоктармен ерімейтін қосылыстар түзеді. Мұндай суда шай және кофе нашар шығады. Кермек суды көп пайдаланудан адамның асқазаны ауырып, организмге тұз жиналуы мүмкін. /оқушыларға сұрақ: Адамның қай мүшелерінде тұз жиналуы мүмкін? Бүйрек, өт, бауыр, буын т.б./
| |||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Кермек су дегеніміз не? Берілген кестені толтырыңдар.
Кермек су
Иондары. Иондары.
2 тапсырма. Берілген кестені толтырыңдар.
3 тапсырма Кермек суда 200л 44,4г СаСІ2 бар осы судың бір литрінде қанша кальций бар.
4 тапсырма. Су кермектігін кетірудің әдістерін кетірудің әдістерін естеріңе түсіріп реакция теңдеулерін жазыңдар.Егер шайнек қабырғасында 10г қақ (СаСО3) тұрған болса,оны кетіруге қанша тұз қышқылы жұмсалады.
5 тапсырма, Сөндірілген әкпен үйді ақтағаннан кейін қандай реакциялық өзгеріс жүреді сәйкес реакция теңдеуін жаз.
| |||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||
| Үйге тапсырма | Сілтілік жер металдарға лездеме |
| ||||||
| Бағалау | Өзін-өзі бағалау |
| ||||||
| Кері байланыс | Жасыл*- білдім Сары- толық емес Қызыл- әліде дайындалу керек | севетофор | ||||||
|
Пәннің аты | Химия қолданбалы | № сабақ | Уақыты: 1.02.16 | |||||
| Сабақтың атауы | Екінші топша металдарына қорытынды тест жұмысы | |||||||
| Мақсаты Күтілетін нәтиже | Екінші топша металдарына қасиеттерін біледі | |||||||
| Психологиялық ахуал | Психологиялық дайындық «Кім бастады?» | Оқушылар шеңберде жиналып,билеп тұрады бір оқушы сыртқа шығарылып,келгеннен кейін биді кім бастап тұрғанын айтады | ||||||
| Қызығушылықты ояту | 1Сөндірілген ізбестің формуласын көрсетіңдер А)Ca(Он) 2 Ә)СаСо3 Б)СаО В)Са(НСО3)2 2Соданың ертіндісі мына заттардың қаисысымен әрекестескенде тұнба түзіледі А)NН2СІ Ә) ВаСІ2Б)NаСІ В) NaNО3 3Карбонаттық кереметілікті мына тұздардың6 қайсысы туғызады А)NаНСО3Ә)Са(НСО3)2 Б)МgSO4В)КNО3 4 Уақытша кереметілікті қалай жоюға болады ? А)Күйрену Ә) Буландыру Б)Қайнату В)Сұйылту
| |||||||
| Сергіту сәті | «Қара жорға» биі | |||||||
| Жаңа сабақ | Химиялық диктант | |||||||
| Жаңа сабаққа байланысты жеке тапсырмалар | Қай топтың элементтері «сілтілік жер металдар »деп аталады. а) 1 топ в)2 топ с)3 топ д)4 топ е)5 топ . 2 Кальций дің сыртында қанша электрон бар. а)1 в)2 с)3 д)4 е)5 3.Адам организмінде кальций қайда болады: а)қанда в)көзде с)теріде д)шашата е)тырнақта 4.Мына қосылыстың атауы (Са2SО4 ∙ Н2О ) а)алебастер в)гипс с)сөндірілген әк д)әктас е)әксуы 5.Гипс біздің елімізде қай елде өндіріледі а)Ақмола в)Жамбыл с)Семей д)Шымкент е)Қостанай 6.Кальцидің валенттілігі қанша а)+1 в)+2 с)-2 д)+4 е)-4 7. Сөндірілмеген әктің формуласы а)СаСО3 в)СаО с)Са д)Са(ОН)2 е) 2Са2SО4 ∙ Н2О 8. Сөндірілген әктің формуласы а)СаСО3 в)СаО с)Са д)Са(ОН)2 е)2 Са2SО4 ∙ Н2О 9. Лаборатори яда «әк суы » деп атадатын қосылыс а)СаСО3 в)СаО с)Са д)Са(ОН)2 е)2 Са2SО4 ∙ Н2О 10 Алебастрдың формуласы а)СаСО3 в)СаО с) Са2SО4 ∙ 0,5Н2О д)Са(ОН)2 е) Са2SО4 ∙ 2Н2О 11Құрамында кальций, мен магний тұздары болатын су қалай аталады. а)кермек су в)жаңбыр суы с)қар суы д)мұзды су е) тұзды су 12 Уақытша кермектіктің құрамында болатын тұзды көрсет. а)MgСО3 в)СаО с) Са2SО4 ∙ 0,5Н2О д)Са(ОН)2 е) Mg(HCO3)2 13 Тұрақты кермектіктің құрамында болатын тұзды көрсет а)MgСО3 в)СаСІ2 с) Са2SО4 ∙ 0,5Н2О д)Са(ОН)2 е) Mg(HCO3)2 14.Жұмсақ су а)жаңбыр, қар суы в)өзен суы с)теңіз, д) теңіз, бұлақ е)өзен, қар 15 Уақытша кермектікті қалай кетіруге болады? а)химиялық жолмен в)қайнату арқылы с)ион алмастыру арқылы д)айдау арқылы е)тұз қосу арқылы
| |||||||
| Рефлексия | Екі жақты күнделік стратегиясы
| |||||||
| Үйге тапсырма | Сілтілік жер металдарға лездеме |
| ||||||
| Бағалау | Өзін-өзі бағалау |
| ||||||
| Кері байланыс | Жасыл*- білдім Сары- толық емес Қызыл- әліде дайындалу керек | севетофор | ||||||







 4 тапсырма
4 тапсырма 

 O2 A H2O NaOH CO2 C
O2 A H2O NaOH CO2 C











