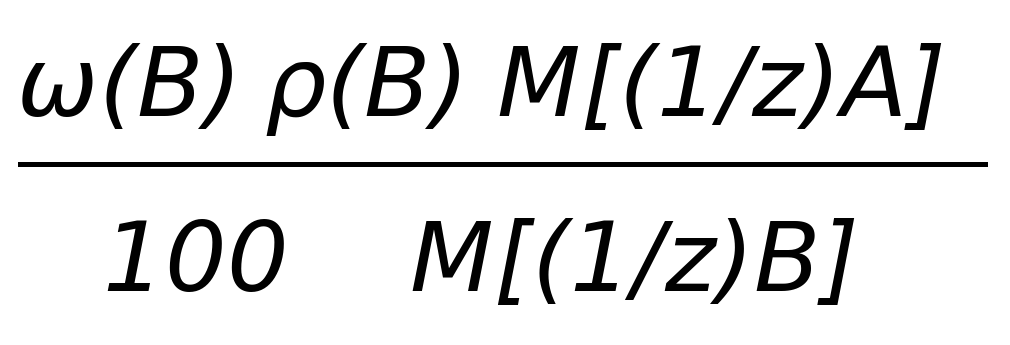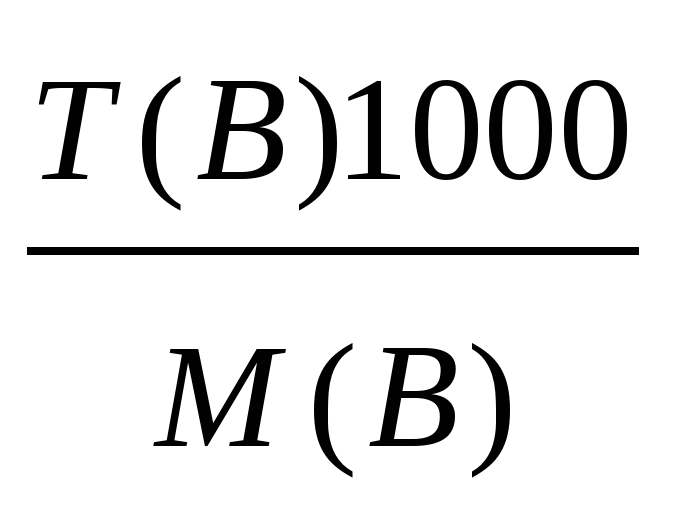Министерство образования и науки Республики Татарстан
Филиал ГАПОУ «Техникум нефтехимии и нефтепереработки»
в г. Менделеевске
«Утверждаю»
Зам.директора по УПР
____Э.Х.Гимазетдинова
«__»_________20______г
Методическая разработка
по МДК.02.01
«Основы приготовления проб и растворов различной концентрации»
Тема урока: Приготовление растворов щелочей
2 курс, 674 группа
Разработала:
мастер производственного обучения
Э.И.Малыхина
1 кв.категория
Менделеевск, 2015
План-конспект урока
Группа: 674 «Лаборант - аналитик», 2 курс
Тема программы: «Техника пробоотбора»
Тема урока: «Приготовление растворов щелочей»
Место проведения: учебный класс Филиала ГАПОУ «ТНН» в г. Менделеевске
Тип урока: комбинированный
Вид урока: лекция, беседа, решение расчетных задач
Цель урока, его воспитательные и развивающие задачи:
Обучающая: разработать алгоритм работы при приготовлении растворов щелочей, применение знаний по теме «Концентрация растворов, способы выражения концентрации растворов» для приготовления растворов щелочей.
Развивающая: развивать логическое мышление, наблюдательность, способность к анализу и синтезу, коммуникативные навыки работы в группе, формировать навыки самоконтроля. Стимулировать познавательную деятельность
Воспитательная: способствовать формированию ответственного отношения к учению, готовности к мобилизации усилий и безошибочное выполнение заданий, проявить наибольшую активность в их выполнении; воспитывать культуру учебного труда, навыки экономного расходования времени.
Профессиональные компетенции:
ПК.2.1 Готовить растворы точной и приблизительной концентрации
Общие компетенции:
ОК.2 Организовывать собственную деятельность, исходя из цели и способов ее достижения, определенным руководителем.
Примерные прогнозируемые результаты:
в результате изучения темы: «Способы приготовления растворов щелочей»
должны знать: способы выражения концентрации растворов;
способы и технику приготовления растворов;
должны уметь: готовить растворы щелочей
Комплексное методическое и материально-техническое оснащение урока: Методическое пособие для практической работы, инструкции по ОТ и ТБ в лаборатории, методики приготовления растворов, задачник
Ход урока
Организационный момент (5 мин)
Актуализация опорных знаний (15 мин)
Проверка домашнего задания (задача) – 3 человека у доски
Опрос:
Назвать основные способы выражения концентрации растворов, написать формулы (у доски) – 3 человека
Формулы пересчета концентрации растворов
| Определяемая концентрация | Исходная концентрация |
| ω, % | с(В), моль/дм3 |
| с(B) | 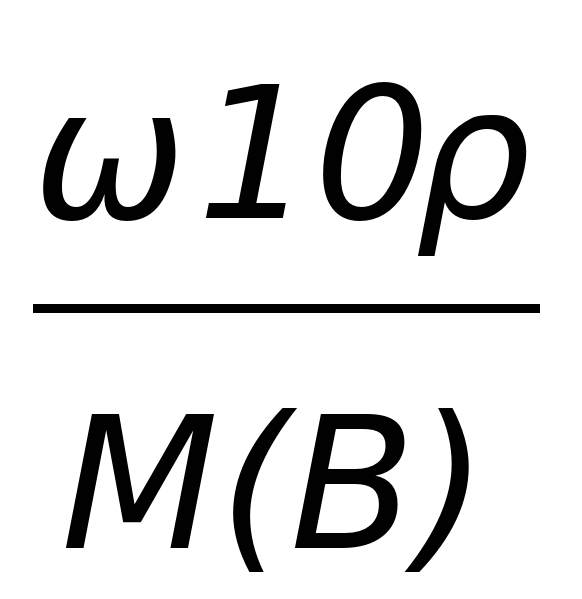 | - |
| c[(1/z)B] | 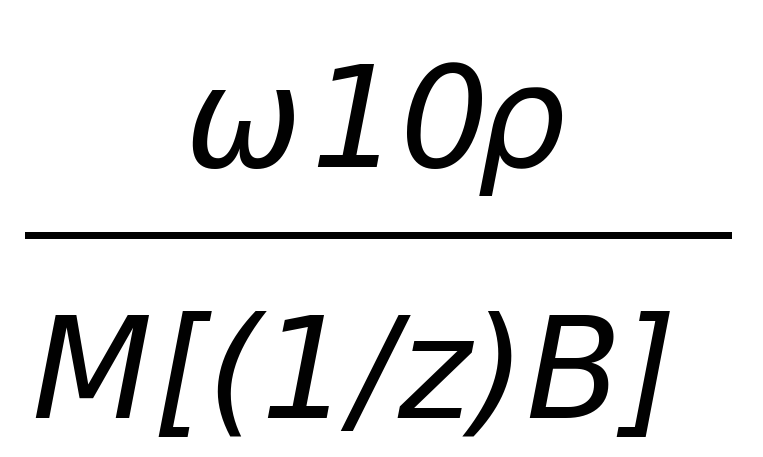 | c(B) z |
| T(B) | 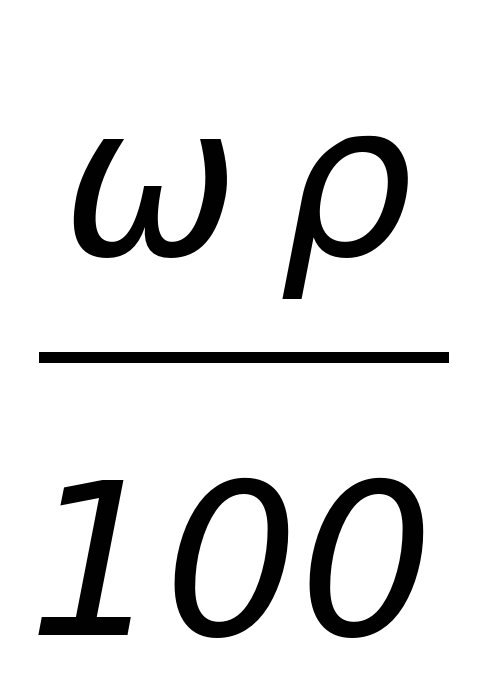 | 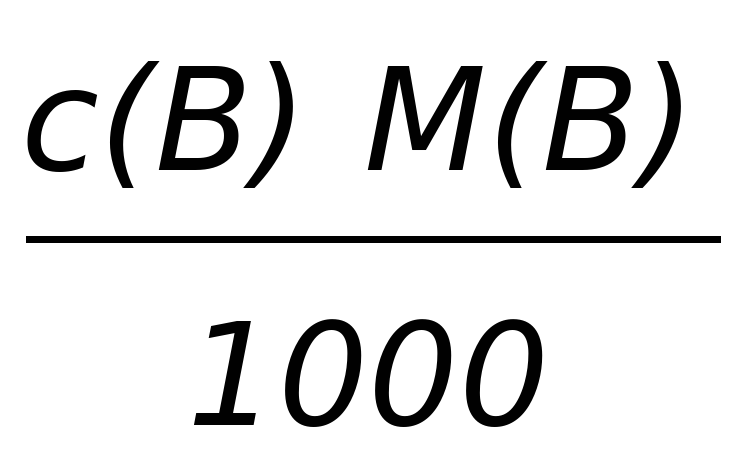 |
| T(B/A) | 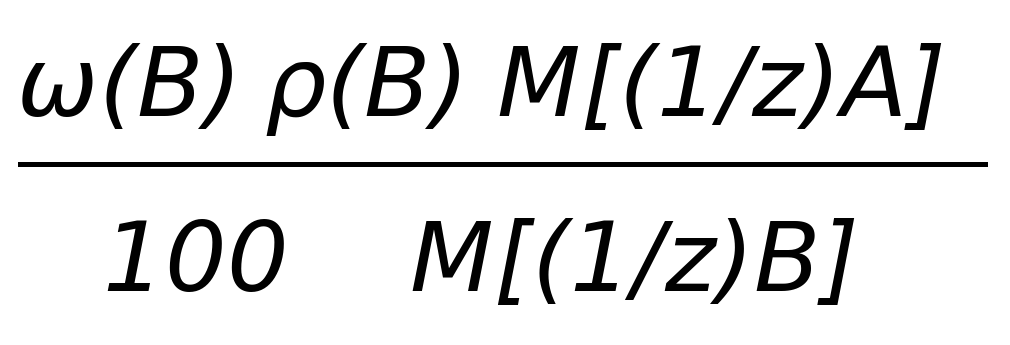 | 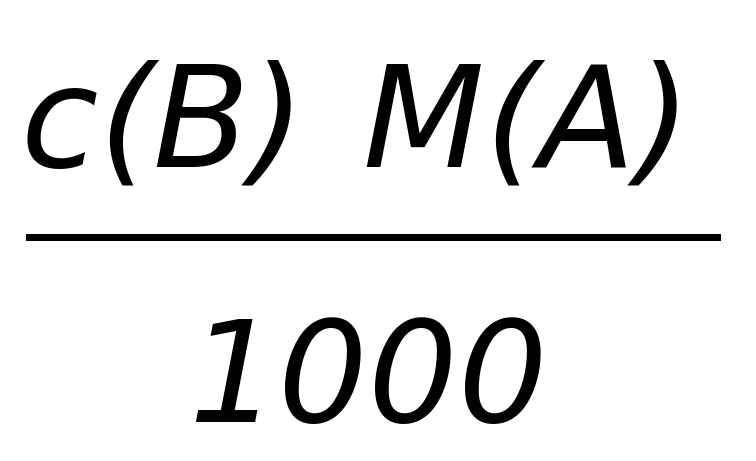 |
| ω (%) | - | 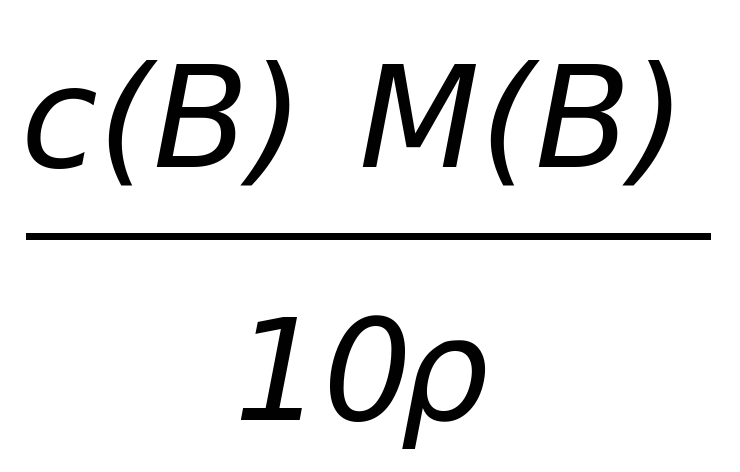 |
| Определяемая концентрация | Исходная концентрация |
| с[(1/z)B], моль/дм3 | T, г/см3 |
| с(B) | 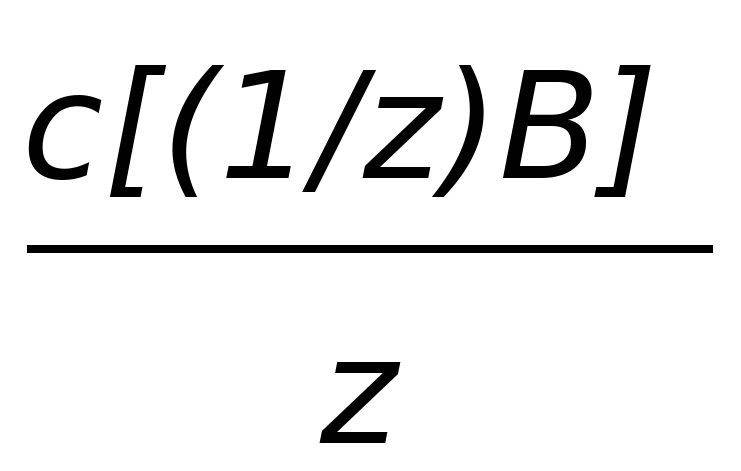 | 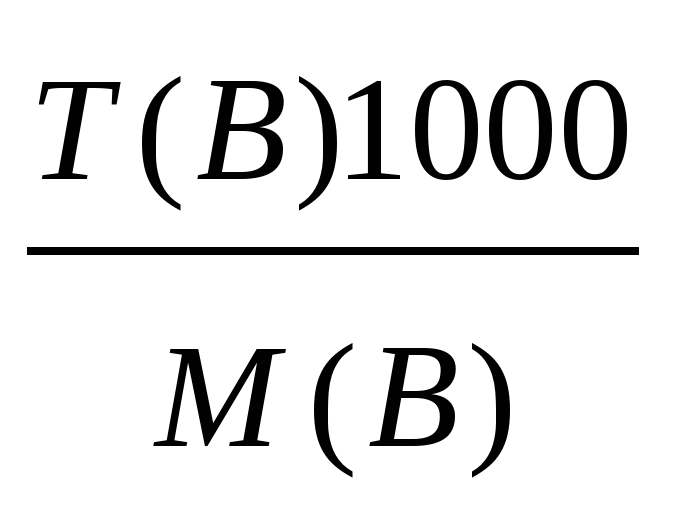 |
| c[(1/z)B] | - | 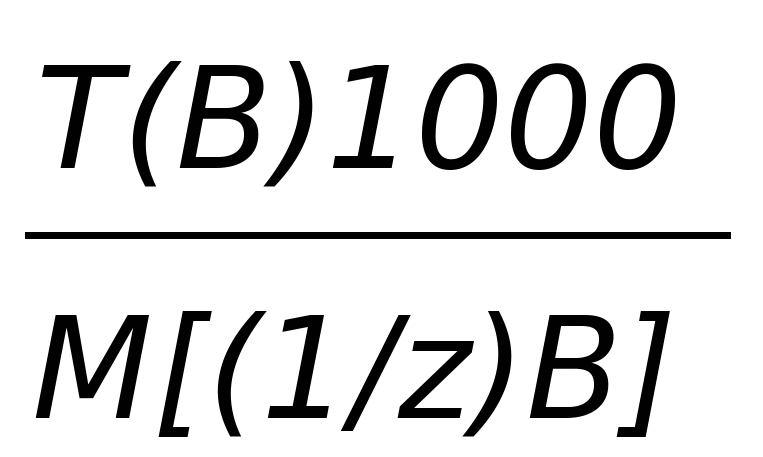 |
| T(B) | 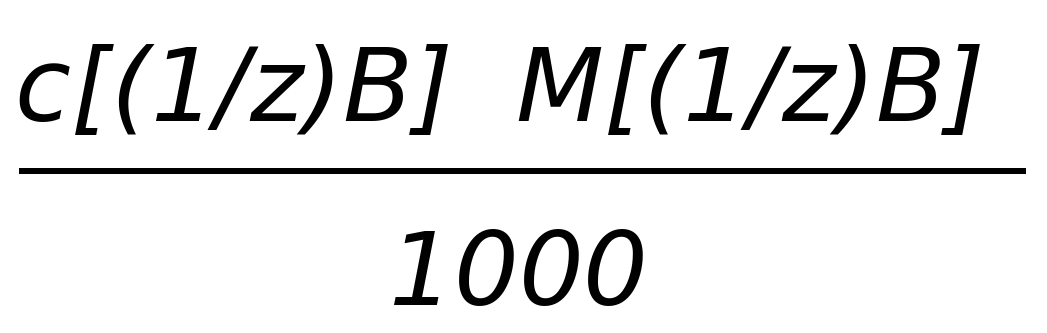 | - |
| T(B/A) | 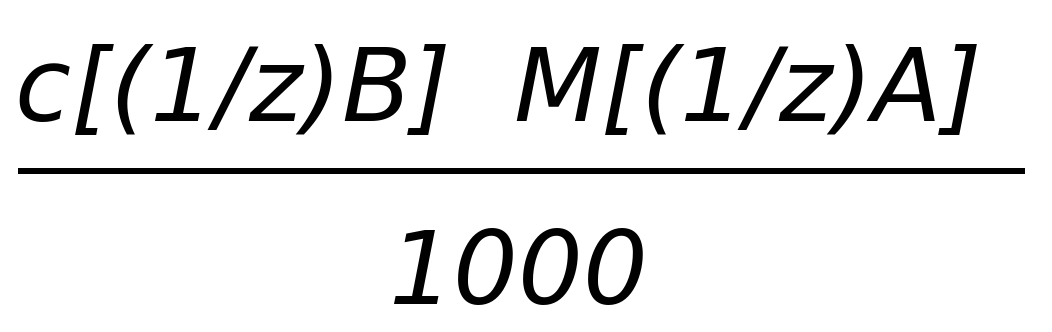 | 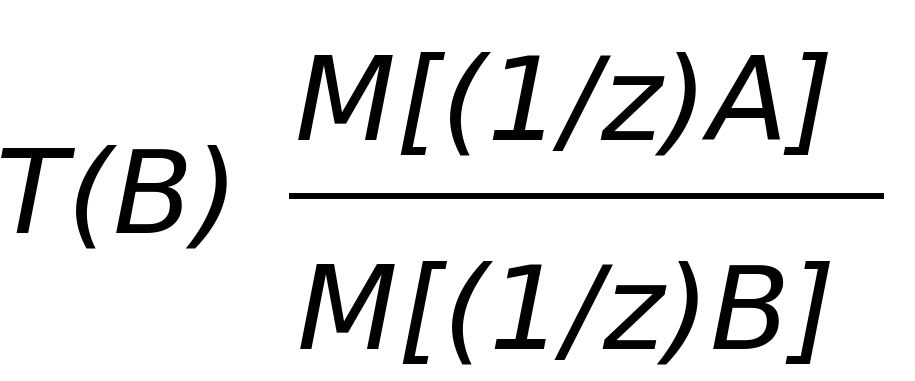 |
| ω (%) | 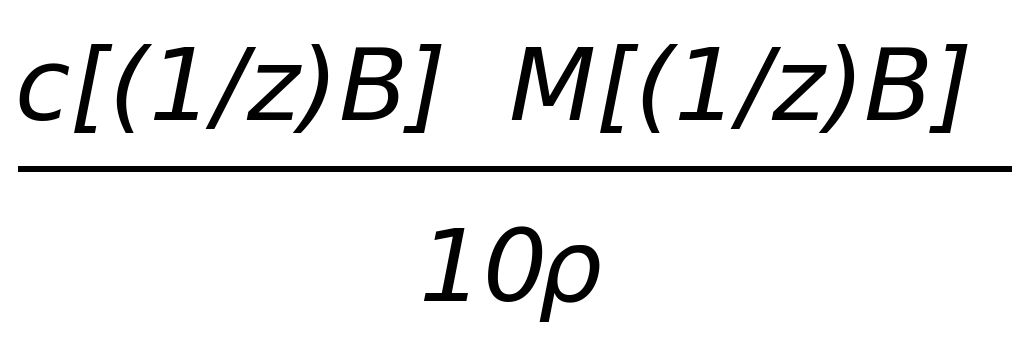 | 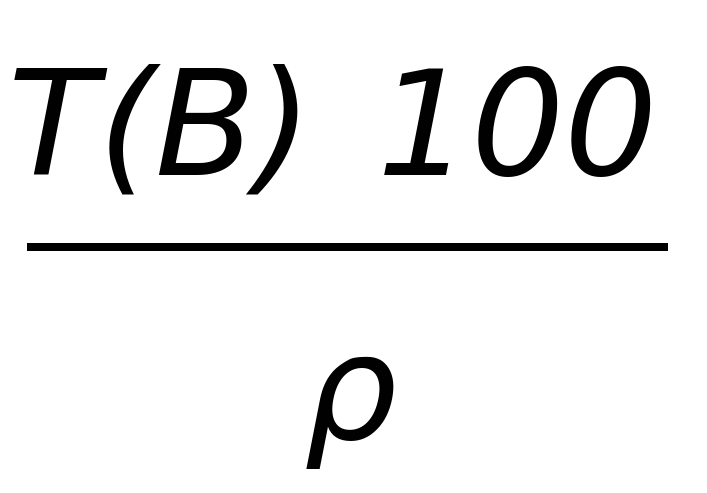 |
Вопросы для повторения
| Чем является вода для многих твердых, жидких и газообразных веществ? | растворителем |
| Какие признаки растворов вы знаете? | Однородность и прозрачность |
| Что образует вода со многими веществами? | Растворы |
| Гомогенная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия | растворы |
| Что происходит при упаривании растворов? | Кристаллизация |
| Какое понятие существует в химии между растворимым веществом и растворителем? | Концентрация растворов. |
Это надо знать
раствор – это то же самое, что гомогенная смесь.
растворителем называют жидкость, растворяющую вещество.
«Подобное растворяется в подобном»
На растворимость влияют площадь поверхности растворяемого вещества, давление и температура.
Разбавлением называют процесс добавления дополнительного количества растворителя в раствор, чтобы уменьшить его концентрацию
Изложение нового материала (20 мин)
Дать основную характеристику понятию щелочь, назвать щелочи с которыми вы встречались на практике и в лаборатории.
Существует три способа приготовления раствора нужной концентрации:
• растворение навески сухого вещества взятой на аналитических весах (в случае устойчивости вещества на воздухе) и на технических весах (в случае, когда вещество гигргоскопично и неустойчиво на воздухе) в известном объеме;
• приготовление раствора из фиксанала;
• разбавлением раствора высокой концентрации
• приблизительная навеска
Краткое описание методик по приготовлению щелочей (приложение)
Инструктирование по ОТ и ТБ в лаборатории, правила работы с щелочами
Работа с кислотами и щелочами.
При работе с концентрированными кислотами и щелочами нужно быть осторожным и следить за тем, чтобы они не попали на кожу или на платье, так как это вызывает ожоги тела и порчу одежды.
При разбавлении концентрированных кислот следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при приливании воды к кислоте может произойти разбрызгивание кислоты.
При переливании больших количеств кислот и щелочей необходимо:
а) надевать длинные резиновые перчатки (в которые заправляются рукава халата), прорезиненный фартук и защитные очки, закрывающие глаза не только спереди, но и с боков;
б) пользоваться сифоном и специальной нагнетательной грушей. Нельзя отливать концентрированные кислоты (Н2S04, НNОз и др.) из больших бутылей, наклоняя их. В случае, если бутыль лопнет или разобьется, разлившаяся кислота или брызги могут причинить сильные ожоги. При попадании концентрированной кислоты на ветошь, солому и т. п. может возникнуть пожар;
в) при отборе концентрированных кислот и щелочей пипетками нельзя засасывать жидкость ртом; для этого на пипетки надевают резиновые груши;
г) твердую щелочь из банок отбирают щипцами или пинцетом; при измельчении щелочи также следует защищать глаза специальными очками, надевать халат, прорезиненный фартук, резиновые перчатки. При необходимости отобрать порцию NаОН от большого куска пользуются зубилом и молотком. При раскалывании щелочь накрывают куском прорезиненной ткани с маленьким отверстием для зубила. В это время в помещении не должны находиться люди с незащищенными глазами. Отколотые куски немедленно помещают в банку, снабженную резиновой пробкой.
Самостоятельная работа (25 мин)
Согласно методике разработать алгоритм приготовления раствора щелочи. Выписать основное и вспомогательное оборудование, рассчитать навески, выписать основные правила приготовления растворов, рассказать об основных правилах охраны труда при работе с щелочами. Защита выполненной работы.
Закрепление (20 мин)
Решение расчетных задач
Задачи.
Задачи на приготовление растворов
Какую массу сульфата калия и воды надо взять для приготовления 300г.20% раствора
Сколько граммов воды содержится в 200г.40%-ного раствора поваренной соли? —
В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе
В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
В 80г. воды растворили 7 г. Семиводного сульфата железа (II) Определите массовую долю в безводной соли в растворе?
Задачи на расчет молярной концентрации раствора.
Какое количество вещества содержится в 1 л раствора с массовой долей нитрата натрия 4-% если его плотность равна 1.32 г/мл.?
В 100 мл. раствора содержится 0.98 г серной кислоты. Определите молярную концентрацию
Какая масса соли потребуется для приготовления раствора хлорида калия объемом 300 мл с концентрацией 0.15 моль/л .
Определите молярную концентрацию раствора с массовой долей гидроксида натрия 20% плотностью 1.22 г/мл. –
Какой объем раствора с массовой долей серной кислоты 9.3 % и плотностью 1,05 г/мл необходим для приготовления 0.35М серной кислоты объемом 40 мл
Задачи на смешивание растворов.
Смешали 200г. 15% раствора хлорида натрия и 300 г. 10% раствора этого же вещества. Определите концентрацию полученного раствора?
Сколько граммов воды необходимо взять для приготовления 200г. 25% раствора из 60% раствора серной кислоты? .
В лаборатории имеются растворы с массовой долей хлорида натрия 10 и 20%. Какую массу каждого раствора надо взять для получения 300 г.раствора с массовой долей хлорида натрия 12 %
Какой объем 60%-ной серной кислоты (плотность 1,5 г/мл) и 30 % раствора (плотность 1.2 г/мл) серной кислоты надо взять для приготовления 240г. 50%-нного раствора?
Сколько граммов кристаллогидрата 18 водного сульфата хрома (III) с массовой долей 15 % необходимы для приготовления 795 г. 20%-ного раствора сульфата хрома (Ш)
Оценка результатов (5 мин)
Выдача домашнего задания, объявление оценок