Данная методическая разработка предназначена для учащихся 9 класса к уроку по теме "Кислородные соединения азота". Карточка содержит как теоретический материал, так и практические задания по теме, что немаловажно для осуществления рефлексии на уроке.
Просмотр содержимого документа
«Методическая разработка по теме "Кислородные соединения азота"»
Тема «Кислородные соединения азота»
1. Составьте формулы оксидов азота со степенью окисления от +1 до +5. Назовите их. Какие из них являются солеобразующими кислотными оксидами, а какие несолеобразующими?
2. При взаимодействии какого оксида с водой образуются азотная и азотистые кислоты? Запишите уравнение реакции.
3. Предположите химические свойства азотной кислоты?
Запишите реакции HNO3 с веществами: а) CaO б) Cu(OH)2 в) Na2CO3 .
4. Запишите схему взаимодействия азотной кислоты с неметаллами, примените схемы для написания реакции между азотной кислотой и 1в – углеродом; 2 в – фосфором:
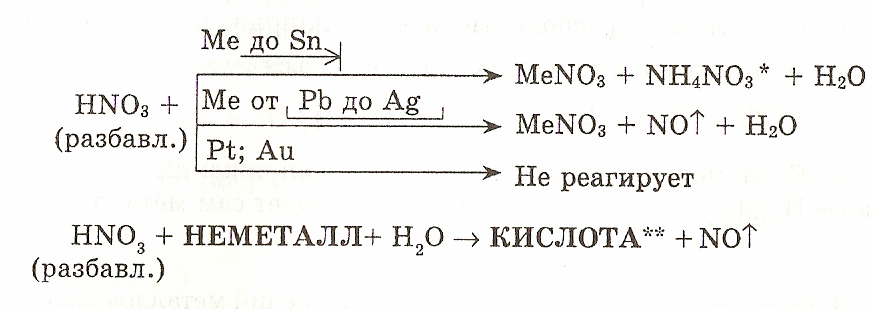
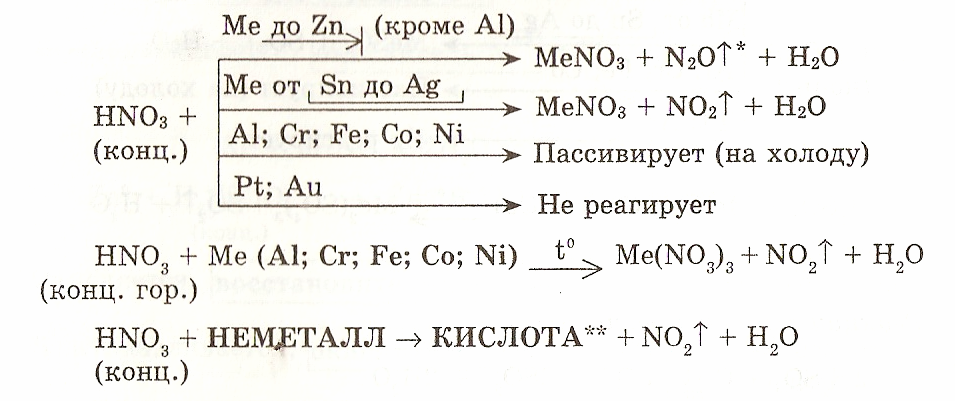
5. Запишите схему взаимодействия азотной кислоты с металлами:

 HNO3 + Ме → МеNO3 + Н2О + ?
HNO3 + Ме → МеNO3 + Н2О + ?
| Кислота | Металлы в ряду активности |
| От Li до Na | От Mg до Pb | От Cu до Ag | Au, Pt |
| HNO3 (разб) | NH4NO3 | N2O, N2 | NO | Не реагируют |
| HNO3 (конц) | N2O | NO2 |
Пассивируются в концентрированной HNO3 на холоду металлы: Al, Fe, Cr, Be, Pb, Co, Ni.
6. Закончите уравнение реакции, пользуясь схемой из п.5, расставьте коэффициенты в нем методом электронного баланса:
1в: Hg + HNO3 (разб) →
2в: Zn + HNO3 (конц) →
7. Запишите схему разложения нитратов при нагревании:

8. Разложите нитраты металлов при нагревании, пользуясь схемой из п.7:
1
 в: а) Pb(NO3)2 t … б) AgNO3 t …
в: а) Pb(NO3)2 t … б) AgNO3 t …
2
 в: а) Ca(NO3)2 t … б) Sn(NO3)2 t …
в: а) Ca(NO3)2 t … б) Sn(NO3)2 t …








 HNO3 + Ме → МеNO3 + Н2О + ?
HNO3 + Ме → МеNO3 + Н2О + ?

 в: а) Pb(NO3)2 t … б) AgNO3 t …
в: а) Pb(NO3)2 t … б) AgNO3 t … в: а) Ca(NO3)2 t … б) Sn(NO3)2 t …
в: а) Ca(NO3)2 t … б) Sn(NO3)2 t …

















